Mecanismos de antienvelhecimento e vida útil mais longa associados à restrição calórica: dados de estudos de animais geneticamente modificados.
É sabido que a restrição calórica (RC) aumenta a expectativa de vida e inibe várias alterações fisiopatológicas. O CR inibe a sinalização do hormônio do crescimento / fator de crescimento semelhante à insulina e mTORC1, ativa a sirtuina e melhora a regulação redox mitocondrial. Mas os mecanismos exatos estão sendo discutidos. Nesta revisão, discutimos mecanismos de RC usando dados de pesquisa com animais que foram geneticamente modificados de acordo com os recentes avanços nas tecnologias moleculares e genéticas, em termos da hipótese de resposta adaptativa proposta por Holliday em 1989. Também explicaremos os efeitos positivos da RC, classificados de acordo com o seu funcionamento em condições nutricionais ou de jejum.
Em 1935, a RC foi descrita para aumentar a longevidade em ratos [1]. A RC, também conhecida como restrição alimentar ou restrição energética, é amplamente utilizada em pesquisas sobre envelhecimento como uma manipulação alimentar forte e facilmente reproduzível para prolongar a vida. A RC tem sido observada em várias espécies, desde leveduras e nematóides até mamíferos. Nos mamíferos, foi estudado principalmente usando roedores nos quais o CR suprime várias alterações fisiopatológicas relacionadas à idade e prolonga a vida útil média e máxima. No entanto, os efeitos benéficos da RC desaparecem em certas cepas e / ou condições. Uma revisão recente detalha essas limitações [2]. O grau em que a RC exerce efeitos benéficos depende de fatores como espécies de roedores, linhagens e o momento do início da RC. Em geral, no entanto, a RC de longo prazo iniciada em tenra idade suprime as alterações fisiopatológicas relacionadas à idade e prolonga a longevidade em diferentes roedores. Também é importante que as limitações de nutrientes individuais (por exemplo, glicose, lipídios, proteínas) sem restrição energética não causem esses efeitos benéficos [3, 4].
Mais de 20 anos atrás, descobriu-se que os camundongos anões Ames que sofrem uma mutação no gene Prop1 vivem mais tempo do que os camundongos do tipo selvagem [5]. Este foi o primeiro relatório que uma única mutação genética ou modificação genética pode prolongar a longevidade em mamíferos. Até onde sabemos, mais de 40 camundongos e ratos com uma única mutação genética ou modificação genética vivem mais que os animais do tipo selvagem. Desses camundongos e ratos, aproximadamente um terço mostra sinalização de hormônio de crescimento suprimido (GH) / fator de crescimento semelhante à insulina 1 (IGF1). Como o CR também suprime a sinalização de GH / IGF1, os efeitos benéficos do CR podem ser baseados nisso. Outros mecanismos moleculares que foram propostos para regular os efeitos benéficos da RC incluem a inibição da atividade do alvo mecanicista do complexo 1 da rapamicina (mTORC1), ativação da autofagia, ativação do metabolismo de NAD + e sirtuína e aumento da regulação redox mitocondrial [6, 7]. No entanto, esses mecanismos não são totalmente compreendidos.
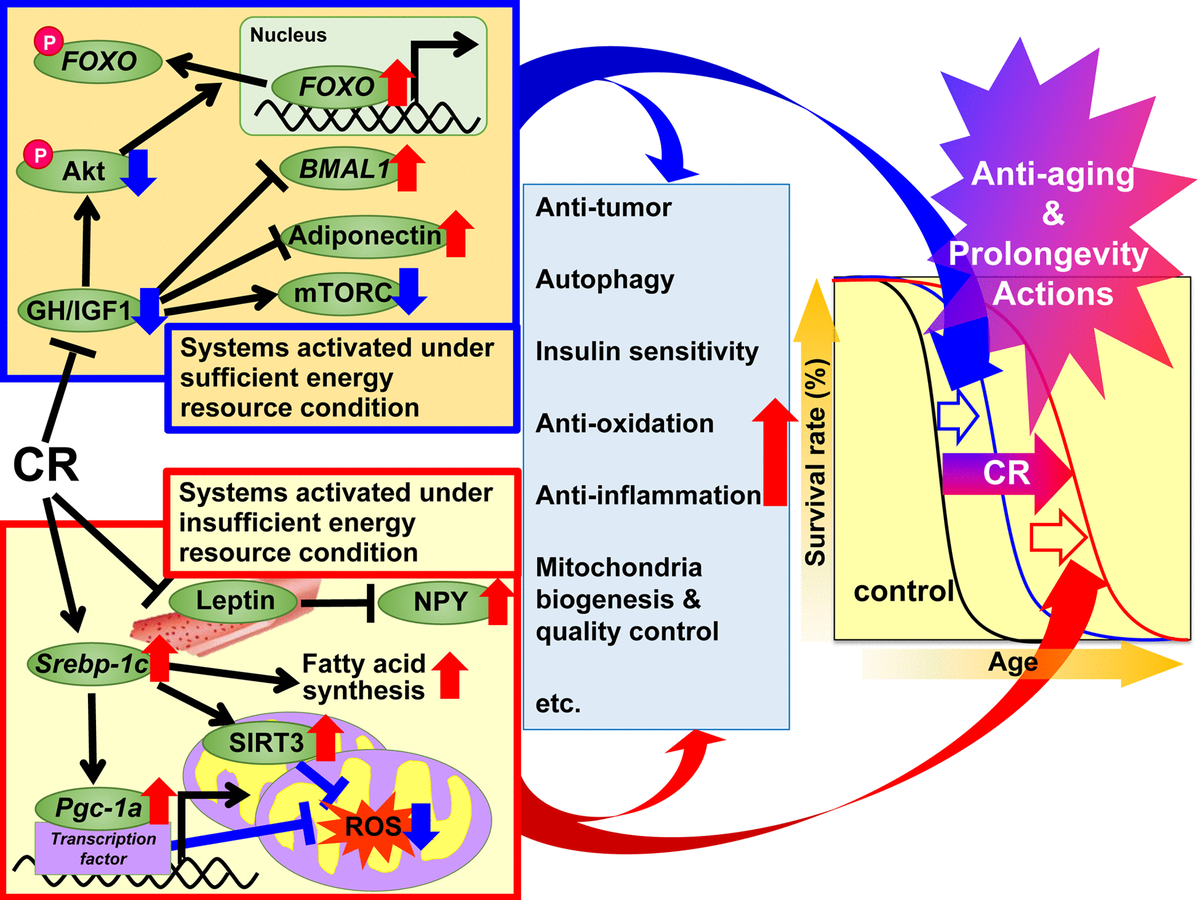 Fig. 1. Os mecanismos de ação propostos de restrição calórica (RC) contra o envelhecimento e para aumentar a vida útil com base na hipótese de resposta adaptativa. Propõe-se que os mecanismos reguladores da RC sejam divididos em dois sistemas. O primeiro sistema é ativado em condições de energia suficientes, quando é possível usar livremente energia, e os animais crescem bem, reproduzem mais e armazenam excesso de energia na forma de triglicerídeos (TG) no tecido adiposo branco (WAT) para uso subsequente. Este sistema inclui hormônio do crescimento (GH) / fator de crescimento semelhante à insulina 1 (IGF1), Akt, FOXO, mTORC, adiponectina e BMAL1. O segundo sistema é ativado em condições de energia insuficiente, quando não há benefício do uso excessivo de energia, e os animais suprimem o crescimento e a reprodução e usam a energia economizada para manter a função biológica. Este sistema inclui as seguintes vias de sinalização: proteína SREBP-1c, sirtuína (SIRT), proteína PGC-1α, espécies reativas mitocondriais de oxigênio (ERO), leptina e neuropeptídeo Y (NPY). Em animais com RC, esses sinais são eficazes para uso de energia. Além disso, vários sinais e / ou fatores podem contribuir para efeitos benéficos associados à RC, incluindo ações antioxidantes, anti-inflamatórias, antitumorais e outras ações de RC em graus variados em cada tecido ou órgão e, assim, levar ao rejuvenescimento e prolongamento da vida.
Fig. 1. Os mecanismos de ação propostos de restrição calórica (RC) contra o envelhecimento e para aumentar a vida útil com base na hipótese de resposta adaptativa. Propõe-se que os mecanismos reguladores da RC sejam divididos em dois sistemas. O primeiro sistema é ativado em condições de energia suficientes, quando é possível usar livremente energia, e os animais crescem bem, reproduzem mais e armazenam excesso de energia na forma de triglicerídeos (TG) no tecido adiposo branco (WAT) para uso subsequente. Este sistema inclui hormônio do crescimento (GH) / fator de crescimento semelhante à insulina 1 (IGF1), Akt, FOXO, mTORC, adiponectina e BMAL1. O segundo sistema é ativado em condições de energia insuficiente, quando não há benefício do uso excessivo de energia, e os animais suprimem o crescimento e a reprodução e usam a energia economizada para manter a função biológica. Este sistema inclui as seguintes vias de sinalização: proteína SREBP-1c, sirtuína (SIRT), proteína PGC-1α, espécies reativas mitocondriais de oxigênio (ERO), leptina e neuropeptídeo Y (NPY). Em animais com RC, esses sinais são eficazes para uso de energia. Além disso, vários sinais e / ou fatores podem contribuir para efeitos benéficos associados à RC, incluindo ações antioxidantes, anti-inflamatórias, antitumorais e outras ações de RC em graus variados em cada tecido ou órgão e, assim, levar ao rejuvenescimento e prolongamento da vida.Objetivos e mecanismos moleculares da RC
Sinalização GH, IGF1 e FOXO1
O GH regula positivamente a produção de IGF1 predominantemente no fígado através do receptor GH (GHR). O IGF1 atua no receptor IGF1 e depois fosforila Akt, serina / treonina-quinase nas células-alvo. A forma fosforilada de Akt então fosforila os fatores de transcrição do FOXO, facilitando a exportação nuclear. Portanto, a supressão da sinalização de GH / IGF1 transcricionalmente aumenta a expressão de vários genes ativados pelos fatores de transcrição FOXO.
Várias espécies de camundongos modificados, anão Ames, anão Snell e nocaute no GHR (GHR KO), mostram sinalização de GH suprimida e têm uma vida útil prolongada. Esses camundongos anões têm fenótipos semelhantes aos camundongos CR, incluindo a sinalização GH / IGF1 suprimida, níveis reduzidos de hormônio tireoidiano, insulina e glicose, temperatura corporal mais baixa e obesidade reduzida. No entanto, o perfil de expressão dos genes do fígado difere significativamente entre camundongos GHR KO e CR [8]. Também relatamos que parte do perfil de expressão gênica no tecido adiposo branco (WAT) de ratos CR é significativamente diferente do de ratos anões ao longo da vida portadores do transgene anti-sentido GH [9].
Bonkowski et al. relataram que a RC aumenta a sensibilidade à insulina e aumenta a expectativa de vida em camundongos do tipo selvagem, mas não em camundongos GHR KO [10]. Portanto, eles sugeriram que o efeito do aumento da vida de RC depende da supressão da sinalização de GH / IGF1. Em camundongos anões e ratos anões portadores do transgene anti-sentido GH, a CR aumentou ainda mais a expectativa de vida [11, 12]. Esses dados sugerem que ações antienvelhecimento e aumento da expectativa de vida de CR podem ser regulados independentemente do sinal GH / IGF1 e independentemente.
Os fatores de transcrição FOXO em mamíferos consistem em quatro isoformas, ou seja, FOXO1, 3, 4 e 6. Os camundongos FOXO1 KO (com um nocaute nesse gene) têm uma vida útil prolongada, mas não houve efeito antitumoral associado à RC [13]. Por outro lado, em camundongos FOXO3 KO, a adição de CR inibiu a tumorigênese, mas não houve aumento induzido por CR no tempo de vida [14]. Essas diferenças podem estar associadas a um padrão de ativação diferencial nos tecidos e / ou células das quatro isoformas dos fatores de transcrição FOXO induzidos por CROX.
A proteína BMAL1 é um fator de transcrição envolvido na regulação do ritmo circadiano. Nos camundongos BMAL1 KO (eliminados deste gene), a ingestão de alimentos aumentou, o peso corporal diminuiu e os fenótipos de envelhecimento se aceleraram. Nestes mesmos camundongos, o CR não diminuiu os níveis de insulina e IGF1 e não aumentou a expectativa de vida. O que indica a participação do BMAL1 no efeito benéfico da RC e que esse efeito benéfico depende da transmissão de sinais GH / IGF1 [15].
MTOR de alarme
A mTOR quinase, serina / treonina quinase, foi identificada como a molécula alvo da rapamicina. Ele forma dois complexos multiproteicos separados, conhecidos como mTORC1 e mTORC2. Sabe-se que o MTORC1 é ativado por aminoácidos e fatores de crescimento (por exemplo, insulina e IGF1). A ativação do mTORC1 promove a síntese protéica via S6 1 proteína ribossômica quinase, síntese de ácidos graxos via proteína de ligação regulatória esteroidal (SREBP) 1 e diferenciação de adipócitos por receptores ativados por proliferadores de peroxissomo (PPARγ). O mTORC1 inibe a autofagia e a biossíntese lisossômica através do fator de transcrição EB (TFEB). A função do mTORC2 é pouco conhecida, mas acredita-se que inclua ações anabólicas aumentadas e supressão de ações catabólicas, como no mTORC1 [16].
Os ratos que receberam uma regulação negativa da mTORC1 rapamicina por um longo período após a meia idade tiveram um aumento na expectativa de vida [17]. De acordo com esta descoberta, camundongos transgênicos com superexpressão da proteína TSC1, que regula negativamente o mTORC1, vivem mais que os camundongos do tipo selvagem [18]. Além disso, camundongos knockout com S6 1 ribossômica proteína quinase e camundongos mutantes mTOR também viveram mais tempo do que os camundongos do tipo selvagem [19, 20].
Até onde sabemos, os efeitos benéficos da RC ainda não foram estudados em camundongos com função mTORC1 defeituosa. No entanto, em leveduras com inibição genética, o mTOR CR não aumentou a vida útil [21]. A autofagia é aumentada pela inibição do mTORC1. Nos nematóides deficientes em genes associados à autofagia, a RC não aumentou a vida útil [22]. Com base nesses dados, é provável que uma diminuição na atividade do mTOR e a ativação do aparelho autofágico estejam associadas a um efeito positivo da RC.
Sirtuins
O Sir2 foi descoberto como um novo gene envolvido na supressão da transcrição em leveduras. Depois disso, foi relatado que desempenha um papel fundamental no prolongamento da vida na RC [23, 24]. Sete genes ortólogos da sirtuína, sirtuínas Sirt1 - Sirt7, foram identificados em mamíferos. As proteínas SIRT1, 6 e 7 estão localizadas principalmente no núcleo, SIRT2 no núcleo e citoplasma e SIRT 3, 4 e 5 principalmente nas mitocôndrias. As sirtuínas catalisam reações de desacetilação de várias proteínas, incluindo histonas, dependendo do NAD [25].
Entre sete sirtuínas de mamíferos, SIRT1, 3 e 6 são relatados como envolvidos na fisiopatologia relacionada à idade e na regulação da vida útil [26]. Camundongos transgênicos nos quais a proteína SIRT1 foi seletivamente superexpressa em neurônios hipotalâmicos tiveram uma vida útil mais longa que os camundongos do tipo selvagem. [27] Camundongos fêmeas transgênicos nos quais a proteína SIRT6 foi superexpressa tiveram uma vida útil mais longa do que camundongos do tipo selvagem [28]. Em camundongos idosos, a RC aumentou a expressão de SIRT6 e melhorou a insuficiência renal por 6 meses. Além disso, enquanto a superexpressão do SIRT6 suprimiu o envelhecimento celular, reduzindo a atividade do fator de transcrição relacionado à inflamação NF-κB, o nocaute do SIKT6 acelerou o envelhecimento celular [29]. Nos camundongos SIRT3 KO, várias patologias relacionadas à idade foram observadas anteriormente [30]. Embora a RC tenha evitado a perda auditiva relacionada à idade em camundongos do tipo selvagem, esse efeito não foi observado em camundongos SIRT3 KO [31].
Fator de transcrição NRF2
O NRF2 se liga a elementos da resposta antioxidante para induzir a expressão de genes alvo em resposta ao estresse oxidativo e melhora a expressão de genes envolvidos nas respostas antioxidantes e de desintoxicação. Sob condições fisiológicas, o NRF2 se liga à proteína Keap1 no citoplasma, onde se degrada. Sob estresse, incluindo estresse oxidativo, depois que o Keap1 é capturado pelo p62 fosforilado, o NRF2 se transloca para o núcleo, liga-se a elementos de resposta antioxidante e ativa a transcrição de genes antioxidantes [32].
Como a expressão de NRF2 diminui com o envelhecimento em roedores, presume-se que os níveis de espécies reativas de oxigênio e vários riscos de câncer aumentem. No entanto, a CR suprime um declínio relacionado à idade na capacidade antioxidante, aumentando a expressão de genes envolvidos na antioxidação e desintoxicação. Nos nematóides, o Skn-1, um homólogo da NRF2, é indispensável para a ação da CR para aumentar sua vida útil. Os camundongos knockout para NRF2 mostram uma diminuição na expressão de genes envolvidos na resposta antioxidante e desintoxicação, resultando em oncogênese acelerada. O papel do NRF2 nos efeitos benéficos do CR foi investigado usando camundongos NRF2 KO. Os resultados mostraram que o NRF2 é importante para o efeito antitumoral da RC, mas não está envolvido nos efeitos associados à expectativa de vida e ao aumento da sensibilidade à insulina RC [33].
Neuropeptídeo Y (NPY)
Nos mamíferos, os neurônios no núcleo arqueado hipotalâmico detectam o status energético dos níveis de circulação hormonal. O balanço energético negativo associado ao RC e a subsequente redução da massa gorda aumentam a circulação dos níveis de grelina e adiponectina e reduzem os níveis de leptina, insulina e IGF1 no sangue. Essas alterações hormonais ativam os neurônios NPY no núcleo arqueado hipotalâmico. A maioria desses neurônios sintetiza a proteína Agrp, enfraquecendo a atividade dos neurônios POMC no núcleo arqueado. Uma mudança na atividade dos neurônios primários inibe os neurônios hipotalâmicos secundários que secretam hormônio liberador de somatotropina, gonadotrofina e tireotropina e ativa os neurônios que secretam hormônio liberador de corticotropina. Essa alteração hipotalâmica suprime a sinalização de GH / IGF1, a função tireoidiana e a reprodução e ativa a função glicocorticóide adrenal. A maioria desses perfis alterados de secreção neuronal é observada em camundongos e ratos com RC [34].
Nos ratos NPY KO eliminados, a adição de CR não aumentou a expectativa de vida, causou tolerância ao estresse oxidativo no fígado e alterou o perfil de secreção de neurônios. No entanto, a RC diminuiu os níveis de insulina e IGF1 no sangue, aumentou os níveis de adiponectina e corticosterona no sangue e diminuiu a expressão de genes envolvidos na oxidação beta no fígado. Assim, o NPY deve ser um fator chave associado às ações independentes de RC de GF / IGF1 [35].
Mutação no DNA mitocondrial (mtDNA)
Acredita-se que o acúmulo de mutações no mtDNA seja um dos principais fatores de patogênese em doenças relacionadas à idade. Os camundongos PolgA D257A / D257A carregam uma mutação na mtDNA polimerase gama e mostram um desenvolvimento anterior de acúmulo relacionado à idade de mutações no mtDNA e fenótipos etários em vários tecidos [36]. Nos camundongos PolgA, o D257A / D257A CR não prolongou a vida útil, não afetou o acúmulo de deleção de mtDNA no músculo esquelético e não melhorou a função cardíaca, o que contribuiu para a sarcopenia. Esses dados indicam que o acúmulo de mutações no mtDNA pode inibir os efeitos benéficos da RC [37].
Nossos novos resultados: remodelação CR do tecido adiposo
A obesidade visceral associada ao diabetes, hiperlipidemia e hipertensão, conhecidas coletivamente como “síndrome metabólica”, é um fator de risco conhecido para o desenvolvimento de doenças ateroscleróticas com risco de vida, incluindo infarto do miocárdio e infarto cerebral. O tecido adiposo, originalmente pensado para ser relacionado apenas à função energética, foi recentemente descrito como um órgão endócrino que secretam várias moléculas biologicamente ativas chamadas adipocinas. Os adipócitos grandes que acumulam triglicerídeos (TG) aumentam excessivamente a secreção de adipocinas inflamatórias, incluindo o fator de necrose tumoral-α (TNF-α) e a interleucina-6 (IL-6) e diminuem a secreção de adiponectina em comparação com pequenos adipócitos, que acumulam menos TG. Esses perfis de secreção de adipocina estão diretamente envolvidos em patologias relacionadas à idade, incluindo resistência à insulina, hipertensão e aterosclerose [38]. Além disso, tecido adiposo e adipocinas foram recentemente relatados como atores-chave na regulação da vida útil. Por exemplo, camundongos com nocaute no receptor de insulina em adipócitos mostraram uma diminuição na obesidade, um aumento na biogênese mitocondrial e uma vida útil mais longa que os camundongos do tipo selvagem [39]. Camundongos transgênicos com superexpressão de adiponectina no fígado mostraram maior sobrevida que o controle [40]. Os fatores de transcrição PPARγ e proteínas de ligação a CCAAT / intensificador α (C / EBPα) e β (C / EBPβ) estão envolvidos na diferenciação de adipócitos. Camundongos com decomposição do gene C / EBPβ no locus C / EBP mostraram biogênese mitocondrial aprimorada e vida útil mais longa [41]. Por outro lado, os ratos nocauteados com PPARγ KO tiveram vida útil mais curta do que os controles [42].
Foi relatado que o CR aumenta a forma ativa da adiponectina em camundongos de qualquer idade. Essa regulação da adiponectina associada à RC depende da sinalização de GH / IGF1 [43, 44]. Analisamos a mudança associada à RC na ordem cronológica e obtivemos os seguintes resultados. A CR aumentou a expressão de genes e / ou proteínas envolvidas na biossíntese de ácidos graxos (FA) e na biogênese mitocondrial no tecido adiposo após uma fase inicial da RC. A mudança relacionada à RC ocorreu mais predominantemente no tecido adiposo do que em outros tecidos ou órgãos. Depois disso, ocorreram alterações morfológicas, incluindo uma diminuição no tamanho dos adipócitos e alterações metabólicas no fígado [45]. Para esclarecer as alterações metabólicas relacionadas ao CR no tecido adiposo que ocorreram independentemente do sinal GH / IGF1, comparamos o perfil de expressão gênica do CR no tecido adiposo de ratos do tipo selvagem com ratos transgênicos ad libitum (AL). Nossos resultados mostraram que a CR melhora a expressão de genes envolvidos na biossíntese de ácidos graxos, em particular no principal fator de transcrição da biossíntese de ácidos graxos, genes reguladores SREBP-1, independentemente de GH / IGF1 [9].
Portanto, comparamos o efeito da RC com vários parâmetros, incluindo a vida útil entre camundongos SREBP-1c KO nocauteados e camundongos do tipo selvagem. Os ratos SREBP-1c KO tiveram uma vida útil ligeiramente mais curta do que os ratos do tipo selvagem. Em camundongos do tipo selvagem com vida útil prolongada, a CR aumentou a expressão de proteínas envolvidas na biossíntese de ácidos graxos e na biogênese mitocondrial e no estresse oxidativo suprimido. A maioria dessas alterações foi observada principalmente no tecido adiposo, e não em outros tecidos. Em contraste, a extensão da vida associada ao CR e as alterações do tecido adiposo não foram observadas em camundongos SREBP-1c KO. A proteína PGC-1α foi relatada como um regulador chave da biogênese mitocondrial induzida por CR [46]. Observamos que o SREBP-1c se liga ao promotor do gene Pgc-1α, sugerindoque SREBP-1c regula diretamente a transcrição de Pgc-1α [47]. Além disso, os resultados da análise do proteoma do tecido adiposo mostraram que a CR ativa o ciclo piruvato / malato [48]. De fato, foi relatado que a CR ativa a biossíntese de novo de ácidos graxos no tecido adiposo, mas não no fígado [45]. Estes dados indicam que os ratos SREBP-1c KO não podem usar gorduras eficientemente sob condições de RC. Assim, o tecido adiposo pode não apenas funcionar como tecido para armazenar energia, mas também pode desempenhar o papel de converter glicose em um ácido graxo com maior consumo de energia via SREBP-1c em condições de RC.mas não no fígado [45]. Estes dados indicam que os ratos SREBP-1c KO não podem usar gorduras eficientemente sob condições de RC. Assim, o tecido adiposo pode não apenas funcionar como tecido para armazenar energia, mas também pode desempenhar o papel de converter glicose em um ácido graxo com maior consumo de energia via SREBP-1c em condições de RC.mas não no fígado [45]. Estes dados indicam que os ratos SREBP-1c KO não podem usar gorduras eficientemente sob condições de RC. Assim, o tecido adiposo pode não apenas funcionar como tecido para armazenar energia, mas também pode desempenhar o papel de converter glicose em um ácido graxo com maior consumo de energia via SREBP-1c em condições de RC.CR
Em 1989, Holliday explicou os efeitos do antienvelhecimento e da expectativa de vida da RC do ponto de vista evolutivo de organismos que desenvolveram sistemas de resposta adaptativos para maximizar a sobrevivência durante períodos de escassez de alimentos [49, 50]. Com base nesse ponto de vista evolutivo, dividimos as ações benéficas da RC em dois sistemas; “Sistemas ativados em condições suficientes de recursos energéticos” e “Sistemas operando em condições insuficientes de recursos energéticos”. O primeiro é ativado in vivo, que fornece aos animais o uso gratuito de energia, fornecendo nutrição abundante. Em outras palavras, quando há muito alimento para uso gratuito de energia, os animais crescem bem, reproduzem mais e armazenam excesso de energia como TG no tecido adiposo para uso posterior.mas não tanto que sejam obesos. O segundo sistema é ativado no ambiente natural, o que não permite o uso gratuito de energia devido à escassez de alimentos. Em outras palavras, quando não há benefício com o uso gratuito de energia, os animais inibem o crescimento e a reprodução e usam a energia economizada do crescimento e da reprodução para manter a função biológica. A adaptação às mudanças ambientais naturais é uma prioridade para a sobrevivência dos animais.os animais inibem o crescimento e a reprodução e usam a energia economizada do crescimento e da reprodução para manter a função biológica. A adaptação às mudanças ambientais naturais é uma prioridade para a sobrevivência dos animais.os animais inibem o crescimento e a reprodução e usam a energia economizada do crescimento e da reprodução para manter a função biológica. A adaptação às mudanças ambientais naturais é uma prioridade para a sobrevivência dos animais.Com base na hipótese de resposta adaptativa e nos achados recentes mencionados acima, propomos um conjunto de mecanismos para os efeitos benéficos da RC.Como condições experimentais de RC podem simular condições insuficientes de energia, hipotetizamos que o CR suprime "sistemas ativados em condições de energia suficientes" e ativa "sistemas ativados em condições de energia insuficientes" e induz aditivamente ações antienvelhecimento e para aumentar a vida útil. O primeiro conjunto de sistemas inclui os sinais GH / IGF1, FOXO, mTORC, adiponectina e BMAL1, e o CR parece suprimir essas reações anabólicas. O segundo conjunto de sistemas inclui a sinalização SREBP-1c / mitocôndrias, SIRT e NPY e, provavelmente, o CR ativa essas reações para o uso ideal de recursos energéticos insuficientes. Além disso, vários sinais e / ou fatores podem contribuir para os efeitos antienvelhecimento e prolongamento da vida da RC em graus variados com antioxidantes, anti-inflamatórios,antitumoral e outras ações em vários tecidos.Em relação aos paradigmas da intervenção alimentar, não apenas a RC foi aplicada, mas também a restrição intermitente de energia (IER) e a restrição de tempo nutricional (TRF) [2]. O IER geralmente inclui jejum em dias alternados ou 2-3 dias por semana. A TRF, que é mais popular na pesquisa sobre obesidade do que na bioheronologia, geralmente envolve a limitação do acesso a alimentos (ricos em gordura) por várias horas por dia. Os efeitos benéficos causados pelo IER ou TRF são parcialmente semelhantes aos causados pelo CR. No entanto, até onde sabemos, nenhum estudo utilizou planos de pesquisa rigorosos, incluindo horários de nutrição, para comparar as três intervenções alimentares. Portanto, estudos comparativos de RC, IER e TRF podem ser necessários no futuro.Perspectivas
Estudos usando macacos mostram que efeitos benéficos da RC também podem ocorrer em humanos e outros mamíferos [51]. Os estudos atuais sobre RC concentram-se em dois tópicos, ou seja, na identificação dos mecanismos moleculares da RC, bem como no desenvolvimento de preparações miméticas da RC. Acreditamos que o desenvolvimento de novos fármacos agindo como CR pode ser difícil sem entender os mecanismos moleculares do CR. Para desenvolver tais drogas aplicáveis aos seres humanos, são necessários mais estudos sobre os mecanismos moleculares da RC, principalmente em primatas. Neste relatório, propomos classificar e discutir os mecanismos moleculares dos efeitos benéficos do Cheka, dependendo se eles funcionam em condições de recursos energéticos ricos ou insuficientes. Estudos adicionais sobre os mecanismos moleculares dos benefícios da RC também devem levar em consideraçãoa medida em que os sinais / fatores envolvidos contribuem para as ações antioxidantes, anti-inflamatórias, antitumorais e outras ações de RC em cada tecido ou órgão e, assim, levam ao rejuvenescimento e aumento da expectativa de vida. Estudos de animais geneticamente modificados, com foco em um dos dois sistemas mencionados acima, mostram diferenças no grau de efeitos induzidos por CR em camundongos de origem diferente e aqueles que comparam os efeitos benéficos da CR com fatores IER ou TRF ajudarão a esclarecer não apenas os mecanismos moleculares adicionais da CR, mas também aqueles relacionados à expectativa de vida.e, assim, levar ao rejuvenescimento e aumentar a expectativa de vida. Estudos de animais geneticamente modificados com foco em um dos dois sistemas mencionados acima mostram diferenças no grau de efeitos induzidos por CR em camundongos de origem diferente e aqueles que comparam os efeitos benéficos da RC com fatores IER ou TRF ajudarão a esclarecer não apenas os mecanismos moleculares adicionais da RC, mas também aqueles relacionados à expectativa de vida.e, assim, levar ao rejuvenescimento e aumentar a expectativa de vida. Estudos de animais geneticamente modificados com foco em um dos dois sistemas mencionados acima mostram diferenças no grau de efeitos induzidos por CR em camundongos de origem diferente e aqueles que comparam os efeitos benéficos da RC com fatores IER ou TRF ajudarão a esclarecer não apenas os mecanismos moleculares adicionais da RC, mas também aqueles relacionados à expectativa de vida.relacionados à expectativa de vida.relacionados à expectativa de vida.Preparado por Alexey Rzheshevsky.Fonte:
Hoshino S, Kobayashi M, Higami Y. Mecanismos dos efeitos antienvelhecimento e prolongamento da restrição calórica: evidências de estudos de animais geneticamente modificados. Envelhecimento (Albany NY). 2018 16 de set.