Hoje, as células senescentes (antigas) são chamadas células nas quais o ciclo celular é interrompido sob a influência de vários fatores (estresse ou exaustão do recurso de divisão). Como resultado, essas células não se dividem e não são atualizadas.
A conferência Senescência Celular em Câncer e Envelhecimento da Universidade de Cambridge deu a seguinte definição de envelhecimento celular: “
O envelhecimento celular é o término da proliferação causada por vários gatilhos moleculares, incluindo a ativação de oncogenes, bem como excessivas divisões celulares. Além disso, as células senescentes são caracterizadas pela secreção de vários reguladores estromais e reguladores inflamatórios (os chamados "associados ao envelhecimento do fenótipo serotore"), que afetam o funcionamento das células vizinhas, incluindo as imunocompetentes. Vários fatos convincentes indicam que o envelhecimento celular é um mecanismo eficaz para suprimir o crescimento do tumor. Ao mesmo tempo, o envelhecimento celular pode contribuir para o envelhecimento dos tecidos e de todo o organismo . ”
Devido a vários mecanismos causais, são distinguidos três tipos de envelhecimento celular.
O primeiro, no início dos anos 60 do século passado, foi descoberto no envelhecimento da célula. No trabalho já famoso, os gerontologistas americanos L. Hayflick e P. Moorhead, em experimentos com fibroblastos humanos em cultura, estabeleceram que as células não se dividem indefinidamente e há um limite para a divisão celular (mais tarde chamado limite ou limite de Hayflick) [1]. Após 10 anos, o biólogo soviético Aleksey Olovnikov deu uma explicação lógica para esse fenômeno, ligando o limite das divisões celulares com o encurtamento gradual das seções terminais do DNA, os telômeros. Isto se deve ao fato de que a enzima telomerase, capaz de aumentar os telômeros após seu encurtamento, não é ativa na maioria das células somáticas. Depois que os telômeros são encurtados para um nível crítico, ocorre uma resposta a danos no DNA (DDR), como resultado do qual o ciclo celular para e a célula se torna senescente. Sabe-se que fatores externos que afetam adversamente a saúde e a longevidade (obesidade, falta de exercício, estresse) também têm um efeito negativo no encurtamento dos telômeros [2]. Além disso, a aceleração da redução do comprimento dos telômeros é observada em pacientes com doenças neurodegenerativas, como a doença de Alzheimer [3].
Para a maioria das células, acredita-se que o limite de Hayflick seja de cerca de 50 divisões, após o que a célula deixa de se dividir. Para distinguir o envelhecimento do corpo como um todo do envelhecimento celular, Hayflick e Moorhead introduziram um termo especial para a revolução científica, que se refere ao envelhecimento celular - senescência (em contraste com o envelhecimento - envelhecimento).
Além do envelhecimento replicativo, o envelhecimento celular também pode ser causado por outros fatores que induzem prematuramente o envelhecimento celular, independentemente do comprimento dos telômeros. Esses fatores compõem o segundo e terceiro tipos de envelhecimento celular.
Assim, a ativação de oncogenes como RAS e RAF causa o envelhecimento celular chamado senescência celular induzida por oncogene (OIS). Esta forma de envelhecimento celular está associada à supressão tumoral. Estudos comparativos genômicos de células com envelhecimento replicativo e OIS mostram que, embora haja algumas mudanças gerais na expressão gênica entre essas duas espécies em comparação com células em proliferação, também existem diferenças significativas [4]. Sabe-se que os danos ao DNA associados às espécies reativas de oxigênio (ERO) desempenham um papel importante nos mecanismos de envelhecimento da OIS. A ERK quinase também está ativamente envolvida na ocorrência de OIS, estimulando a degradação de proteínas necessárias para a progressão do ciclo celular. O papel da resposta a danos no DNA (DDR) nesse tipo de envelhecimento celular não foi esclarecido. Oncogenes mutantes, como H-Ras G12V, são conhecidos por terem o potencial de ativar as vias moleculares do envelhecimento celular associadas ao p38 MAPK quinase e ao fator de transcrição NF-kB, independentemente do dano ao DNA. O gene Ras oncogênico também pode contribuir para a regulação positiva da p53 via p19ARF e o envelhecimento celular, independentemente do dano ao DNA. [5] Portanto, a estimulação do envelhecimento celular da OIS não é excluída, mesmo na ausência de dano ao DNA.
Um terceiro tipo de envelhecimento celular, também independente do comprimento dos telômeros, é a senescência prematura induzida por estresse (SIPS). Surge em resposta a fatores de estresse de várias naturezas: radiação ionizante e ultravioleta, aumento do nível de ERO, quimioterapia. Em contraste com o envelhecimento do OIS, a ocorrência de SIPS é completamente dependente da resposta ao dano ao DNA (DDR). Fenotipicamente, o SIPS e a senescência celular replicativa são amplamente semelhantes, mas podem diferir no nível da expressão da proteína. O papel do SIPS no envelhecimento geral do corpo permanece não totalmente claro - o aumento da expressão de antioxidantes e a supressão de ERO, os principais fatores na ocorrência de SIPS, não levaram a um aumento no tempo de vida [6].
Os mecanismos moleculares de parar o ciclo celular em células senescentes estão sendo estudados ativamente hoje. Sabe-se que o grau de dano ao DNA afeta o ciclo celular de diferentes maneiras. Portanto, danos moderados ao DNA podem induzir uma interrupção temporária do crescimento, danos extensos ao DNA causam morte celular programada, danos persistentes ao DNA causam o envelhecimento celular. Determinantes moleculares (os principais fatores) que governam a transição da suspensão temporária do crescimento para a parada irreversível do ciclo são complexos e ainda não estão totalmente descritos. Sabe-se que o dano ao DNA ativa inicialmente a via p53-p21, que interrompe o ciclo celular. Então, se o dano ao DNA não for reparado, a célula entra em apoptose ou se torna senescente. No segundo caso, o papel principal é desempenhado pela proteína p16 INK4a, que regula a preservação a longo prazo da parada do ciclo celular através da via de sinalização pRb-E2F (proteína de retinoblastoma, proteína de retinoblastoma, fator de transcrição pRb-E2F) e alterações na estrutura da cromatina [7].
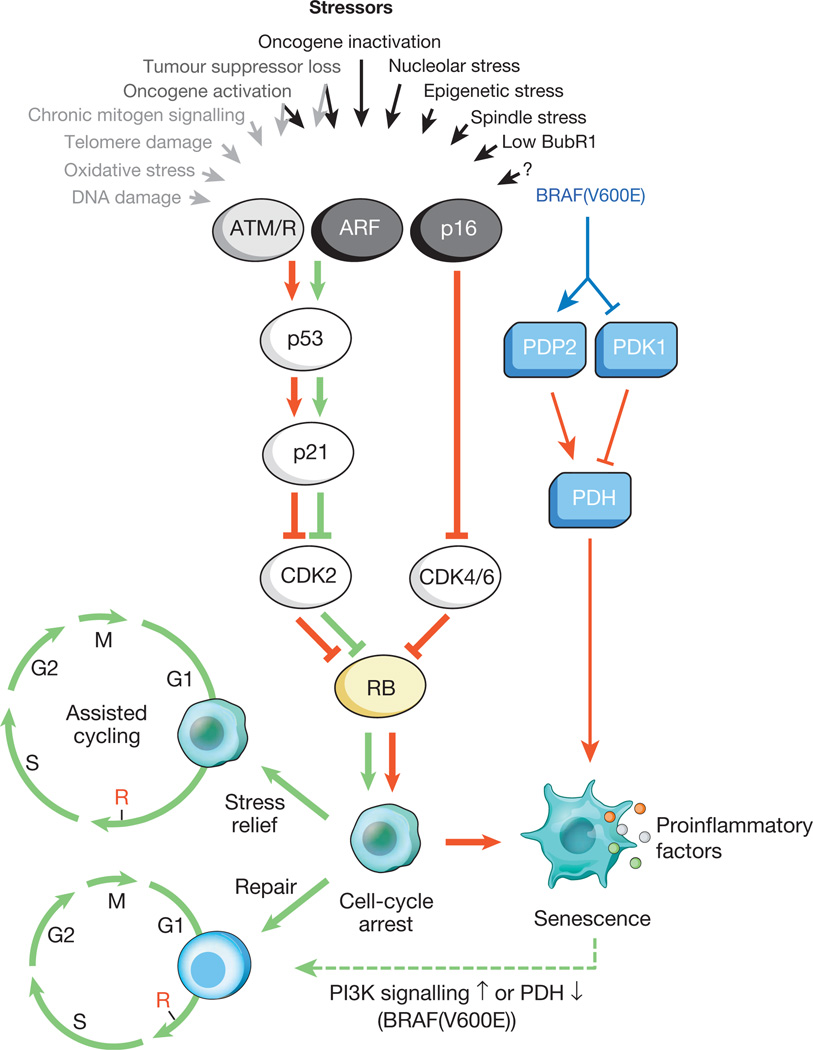
Fig. 1.
Estímulos que causam envelhecimento celular e principais vias efetorasUma variedade de tensões intracelulares e externas pode ativar o programa de envelhecimento celular. Esses estressores capturam várias cascatas de sinalização celular e, finalmente, ativam p53 e p16 INK4a. Os tipos de estresse que ativam a sinalização de p53 via DDR são indicados por setas e texto em cinza (ROS (ROS)) que causam uma resposta a danos no DNA (DDR), interrompendo a transcrição de genes e a replicação de DNA, além de encurtar os telômeros). A p53 ativada induz a p21, que causa a interrupção temporária do ciclo celular, inibindo a ciclina E-Cdk2. O p16 INK4a também inibe a progressão do ciclo celular, mas o faz visando os complexos ciclina D-Cdk4 e ciclina D-Cdk6. Tanto o p21 como o p16 INK4a atuam para impedir a inativação de Rb, o que leva à repressão contínua dos genes-alvo E2F necessários para o início da fase S. Com estresse severo (setas vermelhas), as células temporariamente bloqueadas entram no estágio de parada do ciclo celular. As células suscetíveis a danos menores podem ser restauradas com sucesso e retomar o ciclo normal. Assim, a via p53-p21 pode antagonizar ou sinergizar com p16 INK4a na velhice, dependendo do tipo e nível de estresse. BRAF (V600E) está associado ao envelhecimento através da via metabólica do efetor. BRAF (V600E) ativa a PDH induzindo a PDP2 e inibindo a expressão de PDK1, promovendo uma mudança da glicólise para a fosforilação oxidativa, que causa o estresse redox do envelhecimento. As células em envelhecimento induzem uma transcrição inflamatória, independentemente do estresse indutor relacionado ao envelhecimento (pontos coloridos representam vários fatores SASP). As setas vermelhas e verdes, respectivamente, indicam atividade que promove o envelhecimento e o "antienvelhecimento". A seta verde tracejada indica o mecanismo de "alteração de envelhecimento".Sabe-se que as células senescentes influenciam ativamente seu microambiente (os tecidos que as circundam), secretando várias moléculas ativas: citocinas pró-inflamatórias, quimiocinas, fatores de crescimento, proteases (um total de cerca de 40 tipos diferentes de moléculas). Essas substâncias foram combinadas em um único grupo - o fenótipo secretório associado à senescência (SASP) associado ao envelhecimento celular. Sabe-se que os fatores SASP estão ativamente envolvidos na remodelação do tecido no desenvolvimento embrionário. Além disso, sob sua influência, o corpo da mãe e o embrião são reconstruídos. Pensa-se que a natureza evolutiva do SASP esteja associada a vários mecanismos de defesa: supressão de tumores, recuperação de trauma e regeneração de tecidos.
O efeito fisiológico simplificado do SASP pode ser descrito da seguinte maneira. Moléculas pró-inflamatórias secretadas formam um foco de inflamação ao redor das células senescentes a serem removidas. O que atrai as células do sistema imunológico para este local para eliminar as células envelhecidas. As metaloproteases da matriz da matriz SASP (MMP-1, MMP-10, MMP-3) e as proteases de serina remodelam a matriz extracelular para facilitar a penetração das células do sistema imunológico nas células em envelhecimento. E, finalmente, fatores de crescimento secretados estimulam a proliferação de células vizinhas para substituir as células senescentes remotas.
É descrito como o mecanismo SASP deve funcionar normalmente, em um corpo jovem e saudável. Porém, com a idade e os desvios, sua eficácia pode diminuir significativamente, o que causa o acúmulo de células senescentes nos tecidos e, consequentemente, a secreção prolongada dos fatores pró-inflamatórios do SASP. O que é acompanhado pela ocorrência de focos de inflamação crônica. Além disso, sabe-se que a atividade prolongada do SASP atua como uma infecção nas células normais. Moléculas ativas secretadas por células senescentes entram no espaço extracelular e, agindo nas células normais vizinhas, iniciam a parada do ciclo celular e a parada da proliferação. O que acelera bastante o desenvolvimento do envelhecimento celular nos tecidos.
Além disso, a secreção prolongada de fatores SASP pelo envelhecimento das células está associada ao desenvolvimento de patologias relacionadas à idade. Assim, o aumento da secreção de metaloproteases da matriz por células senescentes estimula o desenvolvimento de doenças cardíacas coronárias, osteoporose e osteoartrite. As células senescentes do músculo liso estão envolvidas no desenvolvimento da aterosclerose, através da secreção de um grande número de citocinas pró-inflamatórias. A secreção prolongada do fator pró-inflamatório TNF-α pelas células T senescentes está envolvida em processos associados à disfunção óssea. Além disso, sabe-se que um aumento no nível de IL-6 pró-inflamatória está associado à resistência à insulina, diabetes, aterosclerose e doenças hepáticas. Para se referir a todos esses processos associados à inflamação crônica sistêmica e ao envelhecimento, nos quais os fatores SASP desempenham um papel fundamental, um termo especial foi introduzido - inflamação. Além disso, o duplo papel do SASP na carcinogênese foi descrito - sua atividade supressora e promotora de tumores [8].
Em conexão com o duplo papel do envelhecimento celular descrito acima em jovens e idosos, alguns cientistas consideram o envelhecimento celular como um exemplo de pleiotropia antagonista evolutiva, que ainda é humoristicamente formulada com a frase "use now - pay later". De acordo com essa teoria, processos que se tornaram arraigados na evolução para aumentar a sobrevivência de organismos jovens podem ter efeitos nocivos cumulativos em indivíduos mais velhos. Portanto, os mecanismos associados às células senescentes em tenra idade estão envolvidos na gravidez, recuperação de lesões e proteção contra tumores. Mais tarde, os mesmos mecanismos causam inflamação sistêmica, degeneração tecidual e desenvolvimento de patologias [9].
Entre o conjunto de células do corpo em envelhecimento, os autores do conceito SENS destacam dois tipos associados ao tecido adiposo: pré-adipócitos e células do tecido adiposo visceral. E isso não é coincidência, já que hoje se sabe que a gordura visceral é metabolicamente ativa e libera uma série de moléculas ativas - adipocinas. Que, por sua vez, estão associados ao desenvolvimento de várias patologias relacionadas à idade (resistência à insulina, diabetes, doenças cardiovasculares). Os autores do SENS também se concentram na deterioração relacionada ao envelhecimento do sistema imunológico. Na opinião deles, isso se deve à sobrecarga do corpo pelo envelhecimento das células e, como resposta, à superprodução de T-killers que destroem células senescentes à custa de outros tipos de células imunes. O que torna um corpo envelhecido vulnerável a várias infecções.
Os autores do SENS veem uma solução para o problema do acúmulo de células senescentes em duas direções. O primeiro é o desenvolvimento de drogas tóxicas para as células antigas ou causam sua apoptose, mas são inofensivas para as células saudáveis e normais. E a segunda direção é a busca de estimulantes do sistema imunológico para buscar e matar seletivamente as células-alvo do envelhecimento. A maneira mais provável de atacar seletivamente essas células anormais, de acordo com os desenvolvedores do SENS, seria usar as moléculas distintas encontradas em suas superfícies. De fato, diferentes tipos de células têm diferenças em suas superfícies. Portanto, o primeiro passo é a identificação e orientação dos marcadores da superfície celular que são específicos das células senescentes a serem removidas. Essa estratégia não é abstrata, mas já forma a base de alguns tratamentos contra o câncer que bloqueiam o crescimento celular e atraem células imunes para destruí-las [10].
Estudos demonstraram que as células senescentes realmente se acumulam com a idade em vários tecidos [11]. Também foi descrito que a eliminação de células senescentes que se acumulam no modelo de camundongos com envelhecimento rápido impede o aparecimento de três principais fenótipos de envelhecimento (catarata, sarcopenia, perda de gordura subcutânea) [12]. Nesse sentido, é bastante óbvio que é necessário identificar biomarcadores confiáveis e eficazes do envelhecimento celular. Que são necessárias em primeiro lugar para rastrear os efeitos de possíveis drogas senolíticas.
Na maioria das vezes, a beta-galactosidase associada à senescência, SA-β-Gal, é usada como biomarcador de células senescentes. A enzima β-galactosidase é uma hidrolase lisossômica que decompõe a beta-galactose terminal dos compostos que a contêm (lactose, sulfatos de queratina, esfingolipídios, etc.). Em 1995, foi descrito que a expressão de SA-β-Gal aumentou significativamente em células senescentes. Um método imuno-histoquímico é usado para determinar seu conteúdo nos tecidos envelhecidos. Como um método alternativo para determinar a atividade de SA-β-gal nas células, a citometria de fluxo é usada usando 5-dodecanoilaminofluoresceína di-β-D-galactopiranósido como substrato.
No entanto, o uso do SA-β-Gal como biomarcador do envelhecimento celular tem suas próprias limitações, uma vez que essa enzima pode dar falsos positivos, aumentando a expressão não apenas nas células envelhecidas, mas também nas células "jovens", pelas quais, por várias razões, a proliferação é limitada. Portanto, hoje é considerado aconselhável usar o SA-β-Gal junto com outros marcadores do envelhecimento celular.
Em 2017, a citologia israelense desenvolveu uma tecnologia nova e mais eficiente baseada na citometria de fluxo usando o citômetro ImageStreamX. Este método permitiu a detecção de SA-β-Gal em tecidos com uma eficiência superior a 80%. Para aumentar a eficiência da análise, os cientistas, juntamente com o SA-β-Gal, determinaram vários outros biomarcadores do envelhecimento celular - proteínas HMGB1 e γH2AX. HMGB1 é uma proteína do grupo de proteínas nucleares não histonas HMG, nas células senescentes sai do núcleo e se move para o espaço extracelular. γH2AX, a forma fosforilada da histona H2AX, é um marcador reconhecido por danos precoces no DNA e envelhecimento celular. Além disso, um novo método dos cientistas israelenses tornou possível determinar as células envelhecidas por seu tamanho aumentado. Segundo os pesquisadores, sua tecnologia pode ser usada para determinar rapidamente a eficácia de novos compostos farmacêuticos que serão projetados especificamente para eliminar células envelhecidas dos tecidos. [13]
Os focos de heterocromatina (SAHF) associados ao envelhecimento celular também podem ser outro biomarcador do envelhecimento. Os SAHFs são estruturas especiais de heterocromatina que se formam nos núcleos das células em envelhecimento. Sua formação está associada à heterocromatinização irreversível associada à inativação dos genes envolvidos no ciclo celular localizado neste local (MCM3, PCNA, Ciclina A). O SAHF pode ser visto ao microscópio após a coloração com um corante DAPI especial. Além disso, foi descrita uma expressão aumentada da proteína da leucemia promielocítica (PML) em células senescentes, o que também pode ser um marcador adicional do envelhecimento celular [14].
Pesquisadores americanos descreveram a proteína p16 INK4a de células T do sangue periférico humano como um biomarcador para o envelhecimento celular. O p16 INK4a, como descrito acima, participa ativamente da interrupção do ciclo celular das células senescentes. A expressão de p16 INK4a é aumentada nas células senescentes e, como se viu, foi significativamente associada ao tabagismo e à inatividade física. Além disso, a expressão de p16 INK4a foi associada a uma concentração de IL-6 plasmática, um marcador de inflamação relacionada à idade. Segundo os cientistas, a expressão de p16 INK4a é um biomarcador de sangue periférico facilmente medido para determinar o envelhecimento celular [15].Apêndice 1.Biomarcadores do envelhecimento celular.1. Associado ao β-galactosidase do envelhecimento celular (beta-galactosidase associada à senescência, SA-β-Gal).2. Proteína HMGB1 (proteína B1 do grupo de alta mobilidade).3. Histona fosforilada γH2AX.4. Associado aos focos de heterocromatina do envelhecimento celular (SAHF).5. Leucemia promielocítica de proteínas (PML).6. Proteína p16 INK4a.Autor: Alexey Rzheshevsky.Referências1. L. Hayflick P. S. Moorhead. O cultivo em série de linhagens de células diplóides humanas. Exp Cell Res. Dezembro de 1961; 25: 585-621.
2. Epel ES, Blackburn EH, Lin J, Dhabhar FS, Adler NE, Morrow JD, Cawthon RM. Encurtamento acelerado dos telômeros em resposta ao estresse da vida. Proc Natl Acad Sci US A. 2004, 7 de dezembro; 101 (49): 17312-5.
3. Panossian LA, Porter VR, Valenzuela HF, Zhu X, Reback E, Masterman D, Cummings JL, Effros RB. O encurtamento de telômeros nas células T se correlaciona com o status da doença de Alzheimer. Envelhecimento Neurobiol. 2003 Jan-Feb;24(1):77-84.
4. Nelson DM1, McBryan T, Jeyapalan JC, Sedivy JM, Adams PD. A comparison of oncogene-induced senescence and replicative senescence: implications for tumor suppression and aging. Age (Dordr). 2014 Jun;36(3):9637.
5. Palmero I, Pantoja C, Serrano M. p19ARF links the tumour suppressor p53 to Ras. Nature. 1998 Sep 10; 395(6698):125-6.
6. Pérez VI1, Van Remmen H, Bokov A, Epstein CJ, Vijg J, Richardson A. The overexpression of major antioxidant enzymes does not extend the lifespan of mice. Aging Cell. 2009 Feb;8(1):73-5.
7. Narita M, Nũnez S, Heard E, Narita M, Lin AW, Hearn SA, Spector DL, Hannon GJ, Lowe SW. Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence. Cell. 2003 Jun 13; 113(6):703-16.
8. .., .., .., .. « » : SASP ? Acta Naturae, 2018, 10(1). .4-15.
9. Shankar J. Chinta, Georgia Woods, Anand Rane, Marco Demaria, Judith Campisi, and Julie K Andersen. Cellular senescence and the aging brain. Exp Gerontol. 2015 Aug; 68: 3–7.
10. ApoptoSENS: Removing dysfunctional cells.
11. Jeyapalan JC, Ferreira M, Sedivy JM, Herbig U. Accumulation of senescent cells in mitotic tissue of aging primates. Mech Ageing Dev. 2007 Jan;128(1):36-44.
12. Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, Kirkland JL, van Deursen JM. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 2011 Nov 2;479(7372):232-6.
13. Anat Biran, Lior Zada, Paula Abou Karam, Ezra Vadai, Lior Roitman, Yossi Ovadya, Ziv Porat, and Valery Krizhanovsky. Quantitative identification of senescent cells in aging and disease. Aging Cell. 2017 Aug; 16(4): 661–671.
14. Bruno Bernardes de Jesus and Maria A. Blasco. Assessing Cell and Organ Senescence Biomarkers. Circ Res. 2012 Jun 22; 111(1): 97–109.
15. Yan Liu, Hanna K. Sanoff, Hyunsoon Cho, Christin E. Burd, Chad Torrice, Joseph G Ibrahim, Nancy E. Thomas, and Norman E. Sharpless. Expression of p16INK4a in peripheral blood T-cells is a biomarker of human aging. Aging Cell. 2009 Aug; 8(4): 439–448.