A história dos biomarcadores epigenéticos começou em 2013. Então, um pioneiro nessa direção, especialista em genética e bioestatística, um funcionário da Universidade da Califórnia em Los Angeles, Steve Horvath, introduziu seu novo e revolucionário método para determinar a idade biológica, chamado de "relógio epigenético". Como o nome indica, esse método foi baseado em alterações no epigenoma, a metilação do DNA.
A metilação do DNA é um dos mecanismos epigenéticos de regulação da expressão gênica. Durante a metilação, o grupo metil de enzimas especiais CH3 se liga a uma das bases de DNA, a citosina. Como resultado, a 5-metilcitosina é formada e a expressão gênica é inativada - o processo de transcrição é bloqueado. Como você sabe hoje, a metilação do DNA é um processo dinâmico. Pode mudar sob a influência de fatores externos, está associado ao desenvolvimento de várias patologias e pode ser herdado por várias próximas gerações. A metilação desempenha um papel fundamental na desativação de DNA estranho, bem como nos processos de desenvolvimento e envelhecimento. As alterações relacionadas à idade na metilação descritas como "desvio epigenético" são descritas. Assim, com a idade, observa-se hipometilação (desmetilação) e instabilidade cromossômica associada. Além disso, com o envelhecimento, o processo inverso também ocorre - hipermetilação de certas regiões promotoras, incluindo certos genes supressores de tumores, os quais estão associados ao desenvolvimento de patologias [1]. Hoje, em geral, acredita-se que as alterações na metilação desempenhem um papel fundamental no envelhecimento.
Com base no fato de que a idade cronológica está associada a alterações previsíveis no epigenoma, hipo e hipermetilação em muitas regiões do genoma, foi desenvolvida a primeira geração de biomarcadores de envelhecimento epigenético com base na metilação do DNA. Em 2011, o primeiro artigo de cientistas da Universidade da Califórnia, em Los Angeles, intitulado "Preditor epigenético da idade", mostrou que a metilação do DNA tem uma clara relação com a idade. Em 2013, Steve Horvat, usando uma técnica de aprendizado de máquina auxiliada por computador, identificou 353 locais de metilação altamente correlacionados com a idade cronológica de uma pessoa, que constituiu a base do primeiro "relógio epigenético" ou "relógio croata" [2].
É difícil superestimar a importância dessa descoberta. É preciso dizer que a história de sucesso de S. Horvat é cheia de drama não inventado. Segundo as memórias do próprio Horvat, a princípio eles não quiseram aceitar seu artigo sobre um novo método epigenético de medir a idade em mais de uma das revistas. Ele constantemente ouvia dos revisores a mesma frase que "é bom demais para ser verdade". Mas Horvath não desistiu e dedicou todo o seu tempo à finalização do novo método: "Eu escrevia em todos os tempos livres, como se fosse a última vez para concluir meu artigo". Pouco antes da conclusão do trabalho na família croata, ocorreu um desastre - sua filha recém-nascida morreu. Mas isso não perturbou o cientista teimoso. A última edição de seu artigo foi novamente rejeitada pela Genome Biology. E depois de receber outro comentário crítico dos revisores, Horvath, em suas lembranças, fez três coisas que não deveriam ser feitas: “Depois de ler os comentários dos revisores, passei os 10 minutos seguintes fazendo três coisas que nunca deveriam ser feitas. Primeiro, fui à geladeira e bebi três garrafas de cerveja o mais rápido que pude. Em segundo lugar, voltei ao computador e escrevi uma carta ao editor. Em terceiro lugar, enviei. " E desta vez, a sorte sorriu para ele, seu artigo foi aceito.

Como um "relógio epigenético" pode ser útil? Segundo o autor da descoberta, esse método pode desempenhar um papel importante na avaliação da eficácia de intervenções antienvelhecimento, pois pode reduzir significativamente o período de espera por resultados. Além disso, supõe-se que os locais de metilação identificados pela Croácia não sejam apenas marcadores, mas também participantes ativos no envelhecimento (pelo menos alguns). O que dá aos pesquisadores um potencial alvo terapêutico na luta contra o envelhecimento e as patologias relacionadas à idade. Além disso, esse novo método pode ser útil em procedimentos criminais, quando amostras de idade são necessárias a partir de amostras de tecido. Mas, é claro, o "relógio epigenético" adquiriu a maior importância posteriormente na previsão de doenças e no aumento do risco de mortalidade.
Como se viu, o "relógio epigenético" mostrou um valor "zero" no tronco embrionário e induziu células pluripotentes, espermatozóides, óvulos e células da placenta. E durante os primeiros 5 anos de vida - um curso acelerado associado ao desenvolvimento do corpo. Com 21 anos de idade, o "relógio epigenético" diminuiu gradualmente e depois foi a uma velocidade mais ou menos uniforme, alterando seu desempenho sob a influência de fatores externos. Além disso, descobriu-se que diferentes tecidos envelhecem em velocidades diferentes. O mais suscetível ao processo de envelhecimento foi o tecido mamário em mulheres. Do ponto de vista da epigenética, o cérebro está envelhecendo mais lentamente, enquanto as células sanguíneas e ósseas mostram um envelhecimento ligeiramente acelerado [3].
No mesmo 2013, um artigo foi publicado por cientistas chineses e americanos que apresentou outra versão do “relógio epigenético” - “relógio Hannum”. Gregory Hannum, bioengenheiro da Universidade da Califórnia na Universidade da Califórnia em San Diego, e seus colegas estudaram perfis de metilação do DNA de 450.000 dinucleotídeos CpG de células sanguíneas de pessoas de 19 a 101 anos, identificando 71 locais de metilação mais correlacionados com a idade [4]. A principal diferença entre o "relógio Hannum" e o "relógio Horvat" é sua especificidade: amostras de DNA são coletadas de células sanguíneas e não de nenhum tecido, como o método croata.
Muito rapidamente, o valor principal do "relógio epigenético" ficou claro. A comparação de seu progresso com a idade cronológica é de grande valor prognóstico para avaliar o risco de mortalidade por todas as causas e o desenvolvimento de muitas patologias. Se o "relógio epigenético" estiver com pressa - há doenças, envelhecimento acelerado e redução da vida útil. Se eles forem mais lentos que a idade cronológica, há boas chances de longevidade. Estudos demonstraram que o “relógio epigenético” tem uma alta correlação com a mortalidade por todas as causas e doenças relacionadas à idade.Em 2015, Horvat e colegas realizaram estudos para determinar a relação entre câncer de pulmão e idade epigenética. Depois de analisar os dados de 2.029 pessoas, verificou-se que a aceleração da idade epigenética estava associada a um risco aumentado de câncer de pulmão, e essa relação era mais forte em fumantes e em pessoas com mais de 70 anos: “Os resultados mostraram que indicadores padronizados da aceleração da idade epigenética (IEAA) foram significativamente associado à incidência de câncer de pulmão (HR: 1,50, P = 3,4 × 10 -3). Além disso, mostramos que a associação pode ser ainda mais forte entre os idosos (70 anos ou mais) ou os que atualmente são fumantes. Em geral, nossos resultados mostram que o IEAA pode ser um biomarcador útil para avaliar a suscetibilidade ao câncer de pulmão do ponto de vista do envelhecimento biológico ”[5].
No mesmo ano, outro grupo de pesquisadores estabeleceu a relação de "idade epigenética" com o risco de morte por todas as causas em pessoas com mais de 60 anos de idade. Para análise, foram coletados dados de quatro estudos (total de 4658 pessoas), cuja média de idade dos participantes foi de 79,1, 69,5, 66,3 e 72,9 anos, respectivamente. A idade epigenética foi determinada por dois métodos: o “relógio croata” (baseado em 353 locais de metilação CpG) e o “relógio Hannum” (baseado em 71 locais de metilação CpG). Ambos os métodos mostraram uma forte correlação entre si, embora os conjuntos básicos tenham correspondido apenas em 6 locais de CpGs. Os resultados do estudo mostraram que a aceleração da “idade epigenética” em comparação com a cronológica em 5 anos aumentou o risco de mortalidade em pessoas em 16%. Os autores concluíram: “As taxas aceleradas de envelhecimento derivadas da metilação do DNA são fatores herdados que predizem a mortalidade, independentemente do estado de saúde, do estilo de vida ou de fatores genéticos conhecidos. Portanto, pode-se supor que a idade prevista para a metilação do DNA é um “relógio epigenético” que mede a idade biológica que caminha junto, mas nem sempre em paralelo com a idade cronológica, e pode fornecer previsões de expectativa de vida ”[6].
Em 2016, oncologistas alemães conduziram um estudo descrevendo a relação entre envelhecimento epigenético acelerado e mortalidade por câncer e doenças cardiovasculares e todas as outras causas. Por seu trabalho, eles usaram o "relógio epigenético" de Horvath e Hannum. A idade de metilação do DNA foi avaliada em uma coorte de 1863 idosos participantes do estudo ESTHER, com idade média de 62,5 anos. Os resultados mostraram que uma idade epigenética superior à cronológica esteve associada a maior mortalidade. Uma aceleração de 5 anos da “idade epigenética” determinada pelo método croata resultou em um aumento na mortalidade em 22% e em 16% usando o método Hannum [7].
Em 2016, uma grande equipe internacional de pesquisadores liderada por Steve Horvath conduziu uma meta-análise em larga escala na qual foram examinados dados de 13.089 pessoas de três grupos raciais / étnicos: brancos, hispânicos e afro-americanos. A idade epigenética aqui também foi determinada por dois métodos: o "relógio croata" e o "relógio Hannum". Este trabalho mostrou que uma aceleração do “relógio epigenético” em 1 ano (em comparação com a idade cronológica) aumentou o risco de mortalidade por todas as causas para 4%. Além disso, o efeito oposto também foi observado: a desaceleração das “horas epigenéticas” levou a um menor risco de mortalidade. Além disso, os pesquisadores registraram um fenômeno interessante: “Descobrimos que 5% das pessoas têm um curso mais rápido da idade biológica, o que leva a uma vida útil mais curta. O envelhecimento acelerado aumenta o risco de morte dessas pessoas em 50% em qualquer idade adulta. ”[8, 9].
Já são conhecidos vários fatores externos que afetam o curso do "relógio epigenético". Em 2017, Horvath e colegas descreveram a relação entre dieta, álcool, educação e exercícios com o decorrer do tempo epigenético. Segundo os próprios autores, seu trabalho confirmou a verdade já conhecida: uma dieta com vegetais, peixe e carne magra, consumo moderado de álcool, atividade física e educação desacelera o curso do tempo epigenético e contribui para prolongar a vida. Níveis elevados de insulina e glicose, proteína C-reativa e triglicerídeos, assim como excesso de peso corporal e pressão alta, aceleraram o envelhecimento do epigenoma. No mesmo estudo, os cientistas não encontraram um efeito positivo da droga antidebásica metformina no decorrer do tempo epigenético [10]. No mesmo ano, pesquisadores finlandeses mais uma vez demonstraram a relação da obesidade com o envelhecimento epigenético acelerado [11]
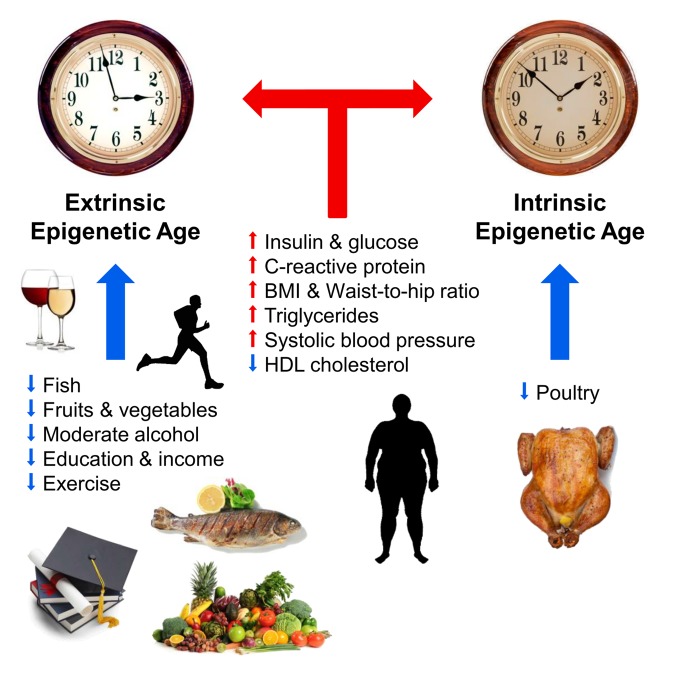
Fig. 1
Fatores que afetam a idade epigenética (de [10]).
As setas azuis e vermelhas indicam fatores que desaceleram e aceleram o envelhecimento, respectivamente. O relógio simboliza o relógio epigenético externo (relógio epigenético extrínseco, uma versão estendida do método Hannum) e o relógio epigenético interno (relógio epigenético intrínseco, relógio croata). Efeitos positivos no decorrer do tempo epigenético (desaceleração): peixes, aves, vegetais e frutas, lipoproteínas de alta densidade, álcool moderado, formação e atividade física. Afeta negativamente o curso do tempo epigenético (acelerar): níveis elevados de insulina, glicose, proteína C reativa, triglicerídeos, pressão alta, aumento do peso corporal e uma proporção incorreta da cintura e dos quadris.Várias equipes de pesquisa realizaram trabalhos descrevendo a relação entre o curso do tempo epigenético e as funções físicas e cognitivas, síndromes de Down e Werner, infecção pelo HIV, doença de Alzheimer e menopausa [12-17]. Uma relação clara entre longevidade e desaceleração do "relógio epigenético" também foi demonstrada usando o exemplo de centenários italianos de 100 anos de idade [18]. Por um longo tempo, Steve Horvath não pôde usar seu método para prever o curso acelerado da idade biológica durante a progeria de Hutchinson-Guildford. Mas este ano esse problema foi resolvido: ele e seus colegas criaram "relógios epigenéticos" especiais baseados em fibroblastos, consistindo em 391 locais CpG, chamados "relógios de pele e sangue" [19].
O próximo passo no trabalho de S. Horvat foi o desenvolvimento de um biomarcador mais eficaz do envelhecimento, com melhores capacidades de diagnóstico que preveem o risco de mortalidade por várias causas e o desenvolvimento de doenças relacionadas à idade. A desvantagem dos “relógios epigenéticos” anteriores, de acordo com Horvath, era que o uso da idade cronológica como padrão para determinar desvios etários pode excluir locais CpG cujos perfis de metilação não mostram mudanças fortes e dependentes do tempo. Em vez disso, mostram apenas a discrepância entre a idade biológica e a cronológica. Portanto, é importante não apenas capturar CpGs que exibem a diferença com o tempo cronológico, mas também aquelas que mostram diferenças de risco e status fisiológico entre pessoas da mesma idade cronológica. Em 2018, um novo biomarcador chamado DNAm PhenoAge, foi criado.
Na primeira etapa, a equipe de S. Horvath analisou em uma grande amostra de pessoas, 9926 pessoas, participantes do estudo NHANES III, a relação de 42 biomarcadores clínicos e a idade cronológica com o risco de mortalidade. Como resultado, 9 biomarcadores foram determinados para prever a idade fenotípica:
1. Albumina
2. Creatinina
3. Glicose
4. proteína C-reativa
5. Porcentagem de linfócitos
6. O volume médio de glóbulos vermelhos
7. A largura da distribuição dos glóbulos vermelhos
8. Contagem de glóbulos brancos
9. Fosfatase alcalina.Em seguida, eles validaram os biomarcadores selecionados - verificaram seu modelo de idade fenotípica em outra amostra de pessoas (6209 pessoas). A verificação mostrou uma correlação entre o aumento da idade fenotípica e o aumento do risco de mortalidade por todas as causas: um aumento de um ano na idade fenotípica foi associado a um aumento de 9% no risco de mortalidade por todas as causas, aumento de 9% no risco de mortalidade por doenças relacionadas ao envelhecimento, aumento de 10% no risco de mortalidade por doenças cardíacas doença vascular, um aumento de 7% no risco de morte por câncer, um aumento de 20% no risco de morte por diabetes e um aumento de 9% no risco de morte por doenças respiratórias.
Na segunda etapa do estudo, os autores associaram a metilação do DNA à idade fenotípica. Os cientistas identificaram quais locais GpC metilados estão associados a esses 9 biomarcadores clínicos que predizem a idade fenotípica. Eles identificaram 513 CpGs desses locais que previam a idade fenotípica. Um novo marcador epigenético foi denominado DNAm PhenoAge. O teste mostrou uma precisão bastante alta do novo biomarcador: entre 1998 e 2007, a alteração média no DNAm PhenoAge foi de 8,51 anos, enquanto a alteração média na idade fenotípica clínica foi de 8,88 anos.
Depois disso, os pesquisadores “testaram” seu novo biomarcador de marcadores usando dados de 4 grandes estudos, Women's Health Initiative (n = 4207), Framingham Heart Study (n = 2553), Normative Aging Study (n = 657) e Jackson Heart Study (n = 1747). Os resultados mostraram que o DNAm PhenoAge foi significativamente associado a um risco de mortalidade subsequente em todos os estudos (independentemente da idade cronológica): um aumento de um ano no DNAm PhenoAge foi associado a um aumento de 4,5% no risco de mortalidade por todas as causas.
A análise genética do DNAm PhenoAge mostrou que os locais de 513 CpG usados nele têm 41 CpGs idênticos ao relógio croata e 6 CpGs idênticos ao relógio Hannum. Cinco CpGs idênticos foram encontrados nos três métodos epigenéticos. 149 CpGs de DNAm PhenoAge estão localizados em aglomerados de dinucleotídeos CpG (ilhas CpG).
Todos os dados obtidos durante o estudo por Steve Horvath e sua equipe mostraram que o novo biomarcador tem um grande valor preditivo na determinação dos riscos de doenças relacionadas à idade e do risco de mortalidade. “
Usando um processo inovador de duas etapas, desenvolvemos um novo biomarcador epigenético do envelhecimento, o DNAm PhenoAge, que superou em muito os biomarcadores anteriores em termos de previsões para diversos fatores do envelhecimento, incluindo mortalidade por todas as causas, câncer, saúde geral, funcionamento físico e doença de Alzheimer. Embora esse biomarcador tenha sido desenvolvido usando dados de sangue total, ele se correlaciona fortemente com a idade em cada tecido e célula testada. Com base na análise transcricional aprofundada em células classificadas, descobrimos que o aumento da idade epigenética em relação à idade cronológica está associado ao aumento da ativação das vias pró-inflamatórias e interferon e à diminuição da ativação dos mecanismos transcricionais / traducionais, resposta a danos no DNA e assinaturas mitocondriais. Em geral, esse único biomarcador epigenético do envelhecimento é capaz de cobrir os riscos de muitos resultados diversos em diferentes tecidos e células e fornecer uma compreensão das importantes vias do envelhecimento ”[20].Autor: Alexey Rzheshevsky.Referências- Vayserman A.M., Voitenko V.P., Mekhova L.V. Epidemiologia epigenética de doenças relacionadas à idade. Ontogênese 2011.42, 1-21;
- Horvath S. Idade de metilação do DNA de tecidos humanos e tipos de células. Genoma Biol. 2013.14, R115.
- Josh Mitteldorf. Relógio de envelhecimento da metilação: uma atualização. 14 de fevereiro de 2018.
- Hannum, G; Guinney, J; Zhao, L; Zhang, L; Hughes, G; Sadda, S; Klotzle, B; Bibikova, M; Fan, JB; Gao, y; Deconde, R; Chen, M; Rajapakse, eu; Amigo, S; Ideker, T; Zhang, K (2013). Os perfis de metilação em todo o genoma revelam visões quantitativas das taxas de envelhecimento humano. Mol Cell. 49: 359-367.
- Morgan E. Levine, H. Dean Hosgood, Brian Chen, Devin Absher, Themistocles Assimes and Steve Horvath. DNA methylation age of blood predicts future onset of lung cancer in the women's health initiative. Aging (Albany NY). 2015 Sep; 7(9): 690–700.
- Riccardo E Marioni, Sonia Shah, et al. DNA methylation age of blood predicts all-cause mortality in later life. Genome Biol. 2015; 16(1): 25.
- Laura Perna, Yan Zhang, Ute Mons, Bernd Holleczek, Kai-Uwe Saum, and Hermann Brenner. Epigenetic age acceleration predicts cancer, cardiovascular, and all-cause mortality in a German case cohort. Clin Epigenetics. 2016; 8: 64.
- Brian H. Chen, Riccardo E. Marioni et al. DNA methylation-based measures of biological age: meta-analysis predicting time to death Aging (Albany NY). 2016 Sep; 8(9): 1844–1859.
- Epigenetic clock predicts life expectancy. ScienceDaily. 28 September 2016.
- Quach A1, Levine ME1 et al. Epigenetic clock analysis of diet, exercise, education, and lifestyle factors. Aging (Albany NY). 2017 Feb 14;9(2):419-446.
- Nevalainen T, Kananen L, Marttila S, Jylhävä J, Mononen N, Kähönen M, Raitakari OT, Hervonen A, Jylhä M, Lehtimäki T, Hurme M. Obesity accelerates epigenetic aging in middle-aged but not in elderly individuals. Clin Epigenetics. 2017 Feb 14;9:20.
- Marioni RE, Shah S, McRae AF, Ritchie SJ, Muniz-Terrera G, Harris SE, Gibson J, Redmond P, Cox SR, Pattie A, Corley J, Taylor A, Murphy L, et al.. The epigenetic clock is correlated with physical and cognitive fitness in the Lothian Birth Cohort 1936. Int J Epidemiol. 2015; 44:1388–96.
- Horvath S, Garagnani P, Bacalini MG, Pirazzini C, Salvioli S, Gentilini D, Di Blasio AM, Giuliani C, Tung S, Vinters HV, Franceschi C. Accelerated epigenetic aging in Down syndrome. Aging Cell. 2015; 14:491–95.
- Horvath S, Levine AJ. HIV-1 Infection Accelerates Age According to the Epigenetic Clock. J Infect Dis. 2015; 212:1563–73.
- Maierhofer A, Flunkert J, Oshima J, Martin GM, Haaf T, Horvath S. Accelerated epigenetic aging in Werner syndrome. Aging (Albany NY). 2017; 9:1143–52.
- Levine ME, Lu AT, Bennett DA, Horvath S. Epigenetic age of the pre-frontal cortex is associated with neuritic plaques, amyloid load, and Alzheimer's disease related cognitive functioning. Aging (Albany NY). 2015; 7:1198–211
- Levine ME, Lu AT, Chen BH, Hernandez DG, Singleton AB, Ferrucci L, Bandinelli S, Salfati E, Manson JE, Quach A, Kusters CD, Kuh D, Wong A, et al.. Menopause accelerates biological aging. Proc Natl Acad Sci USA. 2016; 113:9327–32.
- Horvath S, Pirazzini C, Bacalini MG, Gentilini D, Di Blasio AM, Delledonne M, Mari D, Arosio B, Monti D, Passarino G, De Rango F, D'Aquila P, Giuliani C, et al.. Decreased epigenetic age of PBMCs from Italian semi-supercentenarians and their offspring. Aging (Albany NY). 2015; 7:1159–70.
- Steve Horvath, Junko Oshima et al. Epigenetic clock for skin and blood cells applied to Hutchinson Gilford Progeria Syndrome and ex vivo studies. Aging. Volume 10, Issue 7, pp 1758—75.
- 20. Morgan E. Levine, Ake T. Lu, et al. An epigenetic biomarker of aging for lifespan and healthspan. Aging (Albany NY). 2018 Apr; 10(4): 573–591.