
Era uma vez um avô e uma mulher. E eles tinham um frango Ryaba. O frango colocou um testículo, mas não simples, mas geneticamente modificado. Uma virada inesperada, certo? Mas é exatamente isso que será discutido hoje. Os produtos farmacêuticos mudaram muito nas últimas dezenas, ou mesmo centenas de anos. Não usamos mais sanguessugas e não consideramos a lobotomia um excelente remédio para enxaqueca. Agora, existem muitos medicamentos que podem curar uma grande variedade de doenças. A base desses medicamentos naturalmente são certos compostos químicos, cuja produção é às vezes repleta de grandes dificuldades. E então os cientistas tiveram uma idéia brilhante - por que precisamos de todos esses bio-geradores complexos, se você pode usar galinhas. Sim, você ouviu direito, são as galinhas que transportam os ovos que contêm os compostos químicos necessários, como proteínas. Como os cientistas mudaram as galinhas para atingir esses objetivos, o que aconteceu e se não devemos ter medo de capturar o planeta com galinhas carnívoras geneticamente modificadas de dois metros, aprendemos com o relatório do grupo de pesquisa. Vamos lá
Base de estudoVale a pena começar pelo fato de que o uso de animais como biorreatores não é algo revolucionário. Por exemplo, a Antitrombina III - um medicamento obtido do leite de cabras geneticamente modificadas (GM) foi aprovado para uso em 2006. Em outras palavras, as cabras agiam como um "laboratório" produtor de leite, que incluía o composto químico usado na preparação.
No entanto, de acordo com os cientistas, o uso de animais grandes para tais fins é bastante caro, dado o pequeno número de filhos, um longo período de gestação e, em seguida, o crescimento etc. É por isso que voltaram sua atenção para as galinhas e também pelo fato de os ovos de galinha conterem uma quantidade suficiente de proteína. A média de 60 g de ovo de galinha contém aproximadamente 3,5 gramas de proteína. Em um ano, uma galinha pode botar cerca de 300 ovos. Acrescentamos aqui a manutenção barata de galinhas e o rápido crescimento dos números em condições normais.
Além disso, além das vantagens econômicas, os cientistas observam outras mais científicas. Assim, em galinhas e humanos, os padrões de glicosilação, o processo de adição de açúcares às moléculas orgânicas, são muito próximos. E isso significa que haverá baixa imunogenicidade das preparações de proteína do ovo que precisam de glicosilação para ativar.
Tudo isso parece muito, muito interessante, mas sabemos que até agora os ovos de galinha são usados mais para omeletes do que como fonte de bases medicinais. Ou seja, as galinhas deste estudo não são simples (não, não são de ouro, embora do ponto de vista financeiro possa ser) e geneticamente modificadas.
Os cientistas observam que anteriormente, os lentivírus eram usados para realizar modificações nos genes das galinhas, uma vez que transferiam perfeitamente as informações genéticas para a célula hospedeira. A expressão do transgene pode ser limitada no oviduto usando a sequência do gene da ovalbumina (albumina de ovo albumina). Este método permitiu a criação de duas proteínas biologicamente ativas na proteína do ovo, no entanto, o nível de expressão foi significativamente menor que 1 g / l. E isso não é suficiente para que essa técnica seja atraente do ponto de vista comercial e industrial.
Neste estudo, os cientistas decidiram implementar um método mais avançado de produção de duas novas proteínas, incluindo um dímero de citocinas, bem como um método de purificação aprimorado. O interferão α2a, uma preparação biológica patenteada para o tratamento de certas formas de câncer e hepatite (já obsoletas), foi usado como modelo.
O principal participante do estudo foi o fator estimulador de colônias de macrófagos (CSF1), que é um feixe de 4 hélices, ou seja, é estruturalmente semelhante a muitas citocinas, incluindo insulina, hormônio do crescimento, lactogênio placentário, etc. Bem, o principal "produtor" no estudo são as galinhas. Quais resultados foram mostrados por experimentos e consideraremos mais adiante.
Resultados da pesquisa Imagem Nº 1
Imagem Nº 1Sintetizou-se 0,5 kb (mil pares de nucleotídeos / mil bases emparelhadas) da sequência de codificação do interferon α2a e clonou-se no vetor lentiviral do vírus da anemia infecciosa eqüina com defeito de replicação em cavalos com o promotor EREOVA.
Para aumentar o grau de expressão, foi adicionada 0,9 TPN da sequência do promotor de ovalbumina entre o elemento de resposta ao estrogênio e o elemento regulador dependente de esteróide (
1a ). Foi esse vetor lentiviral que possibilitou a obtenção de aves transgênicas, entre as quais um macho (G1) foi revelado, portador de um transgene intacto (inteiro / intacto). Assim, foi a partir desse macho que a linhagem de aves transgênicas (descendentes) passou.
Através da utilização de anticorpos que respondem ao interferão α humano, a presença de interferão α2a na proteína do ovo de galinhas de teste (
1b ) foi detectada utilizando imunotransferência de proteínas.
A imunotransferência de proteínas * é um método analítico para determinar a presença de proteínas em uma amostra.
Quantitativamente, α2a foi descrito usando um ensaio imunossorvente ligado a enzima, quando os anticorpos se ligam a antígenos específicos, o que possibilita determinar sua quantidade.
Para confirmar a atividade biológica, antes do processo de limpeza, os cientistas colocaram a clara do ovo diluída em um transfetor de células com o gene repórter do elemento de resposta estimulado por interferon que controla a expressão da luciferase (
1c ).
Gene repórter * - une as seqüências reguladoras de outros genes para estudar as manifestações dos genes nas culturas celulares.
Luciferase * - enzimas oxidativas que desencadeiam uma reação, uma das características da bioluminescência.
Após todas as verificações, foi iniciado o processo de limpeza, que consistia em:
- clarificação da ovomucina (glicoproteína na proteína do ovo) diminuindo o pH;
- remoção de ovomucina usando uma centrífuga;
- purificação do interferão α2a usando captura HiTrap Blue e cromatografia de exclusão por tamanho adicional.
O grau de purificação (> 95%) foi confirmado por eletroforese de proteínas em gel de poliacrilamida (
1d ).
Foi possível obter 15 mg de interferon α2a a partir de 100 ml de proteína do ovo, e isso representa cerca de 60% do volume de interferon α2a (25 mg) detectado pelo imunoensaio enzimático (
1e ).
Você pode ter uma pergunta - mas e as doenças que podem pular de galinhas para humanos usando esse interferon α2a. Os cientistas verificaram isso e, mais precisamente, as propriedades antivirais do α2a, introduzindo o vírus H1N1 do tipo A em células previamente tratadas com α2a. E os resultados dessa análise foram mais do que positivos (
1f ) - a atividade antiviral do interferon da proteína do ovo foi de 1x10
9 U / mg, uma ordem de magnitude superior à das proteínas produzidas por bactérias.
 Imagem No. 2
Imagem No. 2Uma das proteínas mais importantes na diferenciação, proliferação e funcionamento dos macrófagos é o LCR1.
A sequência codificante de CSF1 de porco, combinada com Fc, foi sintetizada (pCSF1-Fc) e clonada no vetor lentiviral pLenti6 (isolado do HIV) entre o promotor EREOVA2 e o elemento regulador pós-transcricional do vírus da hepatite por marmota (
2a ).
F c * (fragmento de imunoglobulina em cristalização) é parte de uma molécula de imunoglobulina que interage com o receptor F c na superfície celular e com algumas proteínas.
Após a remoção do macho (G0), que se tornou a base de uma nova linhagem de filhos, entre os quais um transgene intacto foi revelado em duas fêmeas e um macho. Esses indivíduos posteriormente participaram da criação da prole da próxima geração (G2). A eletroforese em proteínas de gel de poliacrilamida confirmou a presença de pCSF1-F
c na proteína do ovo (
2b ).
O CSF1 de porco foi expresso em células Ba / F3. Isso levou ao fato de que a própria existência dessas células era dependente do CSF1-F
c . Assim, foi possível avaliar a viabilidade celular da proteína do ovo teste, que foi bastante alta em comparação com o grupo controle (proteína de ovos comuns), onde a taxa de sobrevivência foi quase nula (
2c ).
Em seguida, a proteína do ovo do pCSF1-F
dos ovos foi purificada da ovomucina e transferida para o estado sobrenadante (sobrenadante, líquido acima do resíduo seco), conforme mostrado na imagem
2d .
A forma dimérica ativa de pCSF1-F
c foi purificada por absorção de MabSelect SuRe e polimento adicional usando cromatografia de exclusão por tamanho (
2e ). A taxa de pureza foi superior a 97%.
Como resultado, o peso molecular médio foi de cerca de 95,1 kDa (kilodaltons), a monodispersidade da proteína também foi satisfatória - Mw / Mn = 1,011 (Mw é o peso molecular médio do peso, Mn é o peso molecular médio do número). A análise do modelo de copolímero mostrou a presença de proteína de 85,6 kDa e oligossacarídeo de 9,5 kDa.
A viabilidade celular também foi testada - alguns dos ovos foram colocados em uma geladeira a -20 ° C por 1 mês e parte durante o mesmo período, mas a -80 ° C. Nos dois casos, as células sobreviveram (
2g ), o que indica a possibilidade de armazenamento a longo prazo e seu uso posterior antes da purificação, sem perda de atividade.
Também foi feita uma análise da capacidade da proteína purificada para interagir com o receptor CSF1. Isso foi feito com células da medula óssea de camundongos e os resultados foram satisfatórios (
2h ).
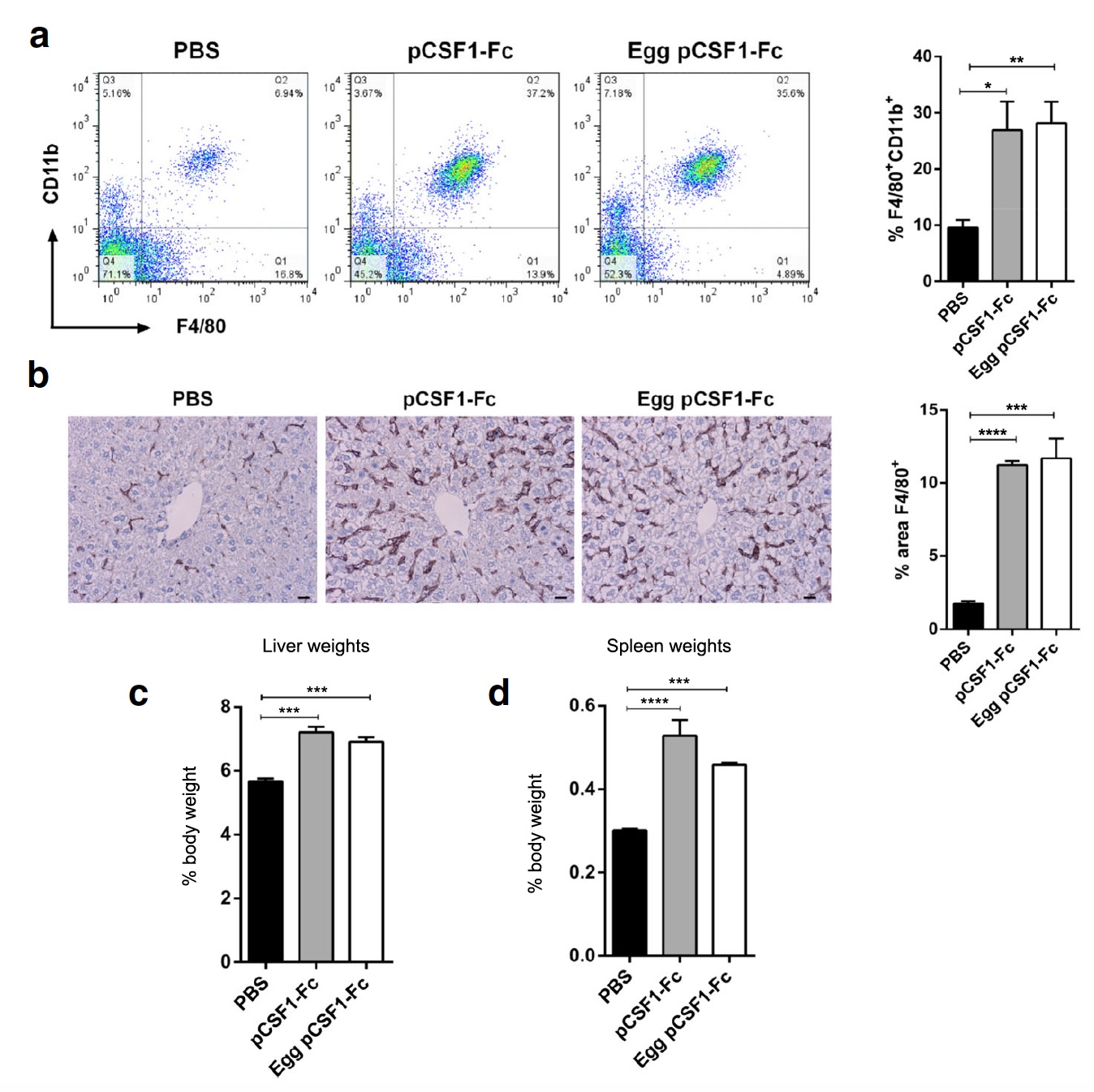 Imagem No. 3
Imagem No. 3Em seguida, os cientistas decidiram testar a atividade do pCSF1-F
c da proteína do ovo em condições de campo, ou seja, em ratos de laboratório que foram injetados com 1 μg / g de controle ou proteína pCSF1-F
c purificada. Depois disso, o peso e a histologia do fígado, baço e sangue de ratos foram verificados. Ambas as variantes de pCSF1-F
c levaram a um aumento no número de células F4 / 80
+ CD11b
+ no sangue (
3a ) e macrófagos do tecido F4 / 80
+ no fígado (
3b ). Também foi observado um aumento significativo no peso do fígado e do baço (
3c e
3d ).
 Imagem No. 4
Imagem No. 4Os testes, análises e experimentos acima mostraram resultados muito bons. Agora resta apenas provar que esses métodos podem permitir a produção de uma citocina humana, que pode ser usada em medicamentos.
Os cientistas observam que o pCSF1-F
c mostra boa atividade nas células humanas e pode ser imunogênico. Para confirmar isso, os ratos de laboratório foram imunizados com a proteína CSF1-F
c para produzir anticorpos monoclonais que reagem cruzadamente com o CSF1 humano.
Antes de realizar testes reais e analisar seus resultados, os cientistas prepararam galinhas que expressam a proteína CSF1-F
c humana (hCSF1-F
c ). Para isso, usamos a técnica e o sistema vetorial descritos anteriormente. Em duas galinhas, foi revelado um transgene intacto que mostrava a necessária expressão protéica de 1 mg / ml (
4a ). Seguido pelo processo de limpeza acima (
4b ). A taxa de sobrevivência de hCSF1-F
c purificado também foi alta, mesmo após a secagem e redução a vácuo (
4c ).
Para um conhecimento mais detalhado das nuances do estudo, recomendo fortemente que você analise o
relatório dos cientistas .
EpílogoO resultado deste estudo é a confirmação de que o interferon α2a e CSF1-F
c são perfeitamente sintetizados como componentes da clara de ovo comum. A extração dessas proteínas também não requer esforços especiais, mas apenas técnicas cromatográficas padrão. As proteínas obtidas são ativas tanto no laboratório quanto no corpo de um sujeito vivo (ratos).
Muitos são muito céticos em relação às modificações genéticas. Alguns até têm medo dessa frase e de tudo o que pode ser conectado a ela. No entanto, vale apenas uma pequena compreensão de quais perspectivas as modificações genéticas humanas podem dar, como os medos e os dogmas ultrapassados são dissipados. Nesse caso em particular, examinamos um estudo no qual os cientistas literalmente obrigaram as galinhas a botar ovos com proteínas humanas, que podem ser usadas para produzir de maneira barata, eficiente e rápida os componentes necessários para criar medicamentos. Talvez essas galinhas não carreguem ovos de ouro, mas seu valor é muito maior.
E, claro, sexta-feira offtopic:
Alguma música antes do fim de semana :)
Obrigado por assistir, fique curioso e tenha um ótimo final de semana a todos, pessoal.
Obrigado por ficar conosco. Você gosta dos nossos artigos? Deseja ver materiais mais interessantes? Ajude-nos fazendo um pedido ou recomendando a seus amigos, um
desconto de 30% para os usuários da Habr em um análogo exclusivo de servidores básicos que inventamos para você: Toda a verdade sobre o VPS (KVM) E5-2650 v4 (6 núcleos) 10GB DDR4 240GB SSD 1Gbps de US $ 20 ou como dividir o servidor? (as opções estão disponíveis com RAID1 e RAID10, até 24 núcleos e até 40GB DDR4).
VPS (KVM) E5-2650 v4 (6 núcleos) 10 GB DDR4 240 GB SSD de 1 Gbps até a mola gratuitamente, ao pagar por um período de seis meses, você pode fazer o pedido
aqui .
Dell R730xd 2 vezes mais barato? Somente nós temos
2 TVs Intel Dodeca-Core Xeon E5-2650v4 128GB DDR4 6x480GB SSD 1Gbps 100 a partir de US $ 249 na Holanda e nos EUA! Leia sobre
Como criar um prédio de infraestrutura. classe usando servidores Dell R730xd E5-2650 v4 custando 9.000 euros por um centavo?