Já
falamos sobre o microRNA circulante, mas há outra coisa igualmente interessante - DNA circulante extracelular (DNA livre de células em inglês, DNA circulante). Foi inaugurado em 1948. Agora o interesse nela se intensificou, e esse é, de fato, o problema.
O DNA extracelular (cfDNA) é encontrado em vários fluidos corporais: no plasma e soro, urina, saliva, sinovial, peritoneal e líquido cefalorraquidiano.
Vamos considerar as características do cfDNA em dois fluidos: sangue e urina. É claro que é mais conveniente para o diagnóstico.
Fontes de cfDNA no corpo
Como ficou conhecido, o cfDNA circula no sangue como parte de corpos apoptóticos, microvesículas, nucleossomos, exossomos, complexos de nucleoproteínas com proteínas do sangue e, presumivelmente, de forma livre.
Acredita-se que as causas do cfDNA no sangue sejam os processos de morte celular, a maturação dos glóbulos vermelhos, a secreção de DNA pelas células, além de bactérias e vírus. Notamos imediatamente que a última fonte, o DNA de bactérias e vírus, contribui de maneira insignificante para o pool total de DNA circulante, e o nível de DNA exógeno durante infecções não excede várias dezenas de pkg / ml. Considerando que, de acordo com dados modernos, o nível normal de cfDNA em um corpo saudável é de 3-44 ng / ml no plasma e 50-100 ng / ml no soro sanguíneo.
É provável que uma parte significativa do cfDNA no corpo resulte da morte celular durante apoptose, necrose e netose. Cerca de cem bilhões de células morrem todos os dias em um adulto através da morte celular programada (apoptose), como resultado da qual cerca de 1 g de DNA é degradado por dia.
No processo de apoptose, o DNA nuclear é clivado por uma enzima especial, a DNase. Depois disso, aparecem fragmentos de DNA com um comprimento de múltiplos nucleossomos (pares de 200-200 bp, bp - nucleotídeo), que devem ser descartados pelos macrófagos como parte dos corpos apoptóticos (embalagem especial após apoptose). Todo mundo sabe que os pares de nucleotídeos (adenina-timina e guanina-citosina) em nosso DNA são repetidos três bilhões de vezes. Os nucleossomos são estruturas especiais na cromatina, constituídas por proteínas histonas, nas quais uma fita de DNA é enrolada uma vez e meia.
Então a coisa estranha acontece. Por razões desconhecidas, parte do DNA das células mortas evita o encontro com macrófagos e entra na corrente sanguínea. Em momentos diferentes, foram realizadas experiências confirmando a natureza apoptótica do cfDNA [1,2].
Quando o cfDNA de doadores saudáveis é separado por eletroforese em gel, são detectadas bandas correspondentes a comprimentos de fragmentos de 180-200 bp. e comprimentos múltiplos desse número, que correspondem à clivagem internucleossomo da cromatina durante a apoptose. A detecção de DNA fetal no sangue da mãe também fala em favor da apoptose como fonte de cfDNA [3].
Normalmente, a necrose contribui menos significativamente para o aparecimento do cfDNA, aumentando seu número em lesões graves. O cfDNA necrótico no plasma é detectado na forma de fragmentos mais longos - com mais de 10 mil pb de comprimento. Utilizando PCR (reação em cadeia da polimerase) é possível distinguir entre fragmentos longos de cfDNA resultantes de necrose e fragmentos mais curtos devido à apoptose.
Além da apoptose e necrose, existe outro tipo pouco conhecido de morte celular, que é uma fonte de cfDNA - netose (NETosis).
Com a netose, as células neutrófilas ejetam estruturas especiais em rede, armadilhas extracelulares de neutrófilos (NET, armadilha extracelular de neutrófilos), cuja tarefa é desativar o patógeno que entrou no corpo: vírus, fungos e bactérias. Nesse caso, o neutrófilo morre, jogando DNA, histonas, várias proteínas e enzimas no espaço extracelular. Sabe-se que, às vezes, o processo NET é de natureza patológica, contribuindo para o desenvolvimento de trombose, doenças cardiovasculares e autoimunes, além de câncer.
Recentemente, em 2018, foi descoberto que, no caso de infecção pelo HIV, ocorrem neutrófilos hiperativos, o mecanismo NET e netose. Como resultado, houve uma extensa morte de células imunes capturadas por redes de neutrófilos, células T CD4 + e CD8 +, células B e monócitos e o desenvolvimento de patologias cardiovasculares concomitantes [4].
Outra fonte potencial de cfDNA é a secreção de DNA por células normais e tumorais. Em 1972, foram obtidas evidências da liberação ativa de DNA por linfócitos no meio extracelular [5].
A presença de um fenômeno como a liberação de DNA pelas células no meio extracelular sugere a existência de mecanismos especiais para a transferência de DNA através da membrana celular. No decorrer dos estudos, verificou-se que a liberação de DNA dos linfócitos ocorre com a ação ativa da tripsina, pronase e plasmina no contexto de uma deficiência de íons Ca2 + e Mg2 +. Um excesso de íons cálcio inibe a saída de DNA da célula [6].
De acordo com bioquímicos russos da Universidade Estadual de Kazan, outra fonte provável de cfDNA no sangue pode ser uma forma completamente desconhecida de DNA citoplasmático, diferente do DNA nuclear e mitocondrial - DNA associado à membrana dos linfócitos diplóides humanos (DNA associado à membrana no citoplasma dos linfócitos humanos diplóides) ) [7]
Apesar do fato de esse tipo de DNA ter sido descoberto em 1971, ele ainda permanece inexplorado e existem poucos trabalhos dos mesmos autores, embora em PNAS e Nature.
De acordo com o pressuposto de Abramova Z.I. et al., parte do cfDNA pode ser formada a partir desse DNA citoplasmático, conforme indicado pelas características de alguns fragmentos do cfDNA, diferentes dos nucleares e mitocondriais [6].
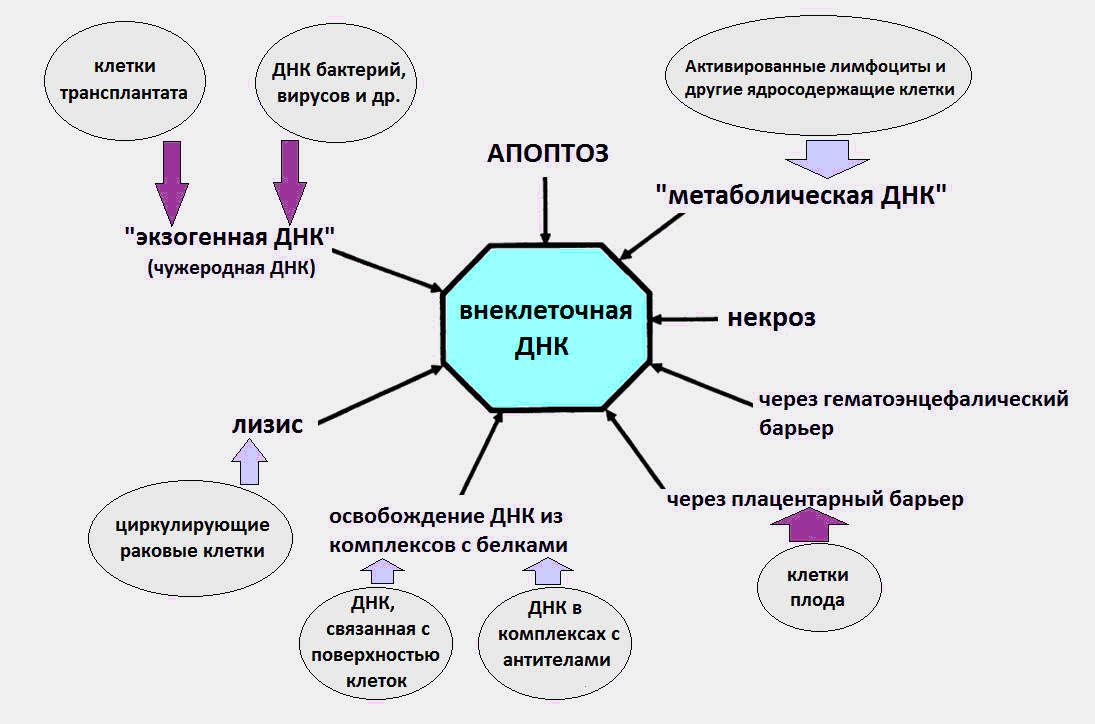 Fig. 1 As várias maneiras pelas quais o cfDNA entra na circulação.
Fig. 1 As várias maneiras pelas quais o cfDNA entra na circulação.Mais detalhes sobre todos os aspectos da biologia do cfDNA (efeitos imunomoduladores, recepção de cfDNA na superfície celular, etc.) podem ser encontrados em uma revisão detalhada do professor Kozlov V.A. (Instituto de Pesquisa de Imunologia Clínica SB RAMS) [8].
DNA extracelular como biomarcador para várias patologias
A lógica sugere que os níveis de cfDNA devem mudar com as patologias que acompanham a morte celular de massa. Vários estudos mostraram um aumento significativo nos níveis de cfDNA com o desenvolvimento de doenças autoimunes (lúpus eritematoso sistêmico, esclerodermia sistêmica, artrite reumatóide, etc.) e que existem características do cfDNA típico de uma determinada patologia autoimune [8-10].
Sabe-se também que no infarto agudo do miocárdio, que acompanha a morte das células cardíacas pelo tipo de necrose e apoptose, os níveis de cfDNA também aumentam. E isso era de potencial valor diagnóstico, pois os pacientes que desenvolveram complicações apresentaram níveis mais altos do que aqueles que estavam se recuperando melhor [11].
Em pacientes que tiveram um AVC agudo, a concentração de cfDNA no plasma sanguíneo, medida em 24 horas, se correlaciona com a gravidade do AVC e pode servir como um preditor de mortalidade e gravidade do resultado, mesmo naqueles pacientes que não apresentam alterações visíveis detectadas pelos métodos de neuroimagem [12,13] .
Sabe-se que o cfDNA é caracterizado pela presença de um grande número de sequências de guanina-citosina (GC), que são mais resistentes à destruição por nucleases do que fragmentos de DNA de adenina-timina. Assim, o conteúdo de uma sequência específica do genoma enriquecido por GC - a região transcrita da repetição ribossômica - no cfDNA é várias vezes maior que o conteúdo dessa repetição no DNA nuclear [14].
E nas patologias crônicas acompanhadas pela ativação da morte celular (doença cardíaca coronária, hipertensão arterial, patologias autoimunes), o conteúdo dessas sequências marcadoras ricas em GC no fcDNA no sangue aumenta em 10 ou mais vezes [15]. Isso torna possível usar os parâmetros do DNA ribossômico enriquecido por GC como parte do cfDNA como biomarcador de um processo patológico de ocorrência crônica.
Na luta contra o câncer, a tarefa é detectar um tumor o mais cedo possível. Aqui, o cfDNA é de extremo interesse como biomarcador da tumorigênese.
Mutações pontuais no fcDNA do tumor foram detectadas no sangue de pacientes muito antes do diagnóstico [16].
Sobre os níveis de cfDNA em oncologia, pesquisando mutações específicas de ccDNA na carcinogênese, como oncogenes KRAS, HER2, BRCA1, APC, PIK3CA, BRAF, etc., usando o DNA mitocondrial como marcador no ccDNA, estudando alterações genéticas e epigenéticas características cfDNAs, como hipometilação dos elementos móveis de Alu, no caso de tumores, o uso do "índice de integridade" do cfDNA e outros aspectos podem ser encontrados nos trabalhos de Vasilyeva et al., Gonzalez-Masia et al. [17, 18].
Foi estabelecido que o cfDNA é caracterizado por um estado de oxidação muito mais forte sob a influência de espécies reativas de oxigênio (ROS) do que o DNA nuclear.
Assim, o conteúdo do conhecido marcador de oxidação do DNA, 8-ohodG, na composição do DNA nuclear normalmente e para várias patologias varia de 1 a 10 por milhão de nucleotídeos, e o conteúdo desse marcador no cfDNA é de 300 ou mais por milhão de nucleotídeos [19].
Um aumento acentuado no conteúdo de 8-oxodG no cfDNA foi estabelecido em oncologia e doenças cardiovasculares, que são acompanhadas por estresse oxidativo, e podem atingir valores de 3000 8-oxodG por milhão de nucleotídeos [20].
Em geral, acredita-se que os níveis de 8-ohdG no cfDNA sejam um marcador sensível do estresse oxidativo total no corpo.
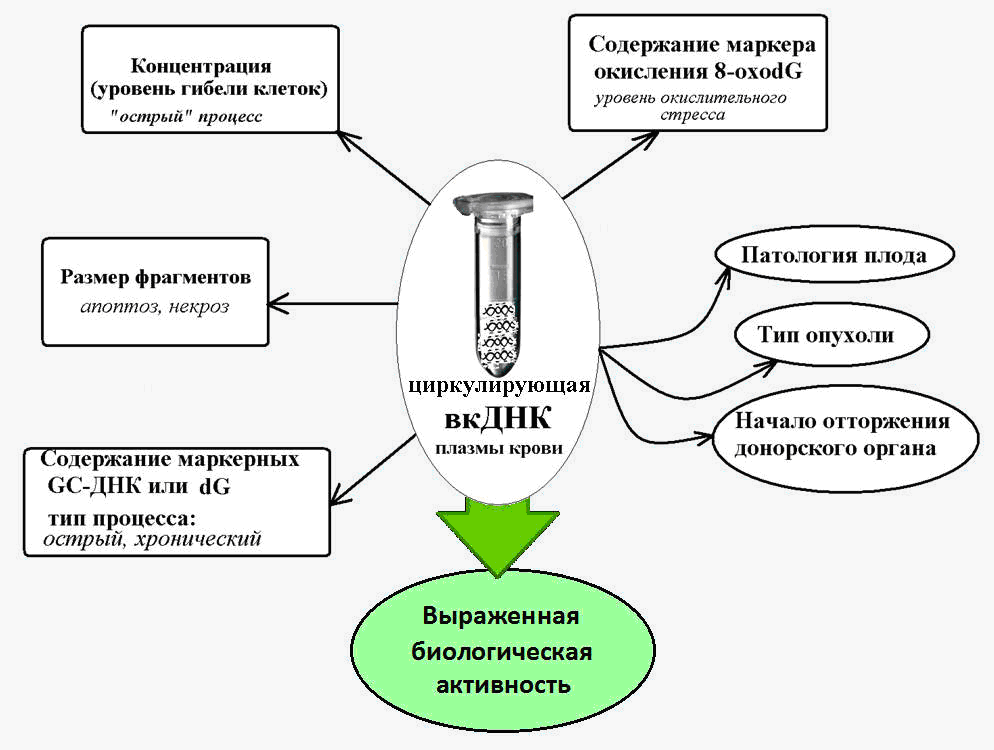 Fig. 2. DNA extracelular circulante - um marcador em várias condições patológicas, acompanhado por aumento da morte celular.
Fig. 2. DNA extracelular circulante - um marcador em várias condições patológicas, acompanhado por aumento da morte celular.DNA extracelular como elemento móvel
Um avanço importante e muito importante nos estudos sobre o papel do cfDNA nos processos internos ocorreu há 3 anos. Em 2015, um grupo de pesquisadores fez uma descoberta emocionante, que mostrou que o cfDNA, como elementos genéticos móveis, é capaz de invadir o DNA nuclear e causar mutações no genoma [21]. Tudo isso é muito surpreendente.
Em trabalhos anteriores, já foi demonstrado que o DNA tumoral do sangue pode ter a capacidade de se integrar ao DNA nuclear. Os fibroblastos de camundongo foram colocados no plasma retirado de pacientes com câncer de cólon, após o qual os oncogenes K-ras e os genes da proteína p53 envolvidos na apoptose foram detectados no DNA das células de camundongos e as próprias células foram transformadas no oncogene (câncer causado em camundongos saudáveis) [22 ] Isso indica que o DNA do plasma foi absorvido e integrado pelas células nele colocadas. Esse alegado fenômeno - a captação de células saudáveis de oncogenes do vcDNA circulando no sangue - pode ser responsável pelo processo de metástase e é chamado de "genomeastasis".
Em outro trabalho, foram fornecidos dados sobre a absorção e integração de fragmentos do gene DYS14 específico para o cromossomo Y no cérebro de uma mulher portadora de um feto masculino [23].
Em um estudo de 2015, os cientistas acompanharam como os cfDNAs marcados com fluorescência, retirados de pacientes com câncer e pessoas saudáveis, eram facilmente inseridos no DNA nuclear de fibroblastos murinos em experimentos in vitro (ou seja, fora de um organismo vivo, em culturas de células). Além disso, o cfDNA humano foi localizado nos núcleos das células de camundongo por vários minutos, e quase 100% dos núcleos das células de camundongo apresentaram sinais fluorescentes por 30 minutos.
A sequenciação de todo o genoma das células de camundongo mostrou a presença de fragmentos de DNA humano, incluindo os elementos móveis característicos do Alu. Além disso, os autores encontraram a indução de focos γ-H2AX decorrentes de danos no DNA, bem como um aumento na atividade da caspase-3 e expressão dos genes ATM, p53, p21, GADD-34 e DNA ligase. Todos juntos indicam aumento da instabilidade do genoma, ativação da resposta a danos no DNA e apoptose.
Os autores testaram o efeito do vcDNA estrangeiro in vivo em um organismo vivo. Os ratos foram injetados por via intravenosa com cfDNA humano, cujos fragmentos foram encontrados no coração, pulmões, fígado e cérebro de camundongos que foram sacrificados 7 dias após a injeção.
Além disso, as partículas do DNA humano administradas aos ratos foram capazes de atravessar a barreira hematoencefálica e penetrar no cérebro. Como no caso de células em cultura, a administração intravenosa de cfDNA causou a indução de γ-H2AX, casapase-3 proapoptótica e ativação da resposta a danos no DNA. E é a resposta aos danos no DNA, segundo os cientistas, que desempenha um papel central na integração do cfDNA no nuclear.
O DNA nuclear percebe a introdução do extracelular como uma ruptura de fita dupla e começa a "remendar", incorporando o DNA circulante em sua composição: "A ativação da resposta ao dano ao DNA combina vários cfDNAs heterogêneos e cromatina fragmentada em concorredores longos por meio de conexão não homóloga das extremidades como parte do processo de recuperação".
Como resultado, os autores chegam à conclusão paradoxal: “Sendo onipresente e ocorrendo constantemente, os danos ao DNA nuclear causados pelo DNA circulante extracelular podem ser a principal causa do envelhecimento associado às anormalidades do envelhecimento e à morte definitiva do corpo. Assim, o DNA, talvez, desempenha um papel paradoxal como detentor dos fundamentos da vida e destruidor da própria vida. ”
Escusado será dizer que esta conclusão é muito contrária a todas as idéias sobre o envelhecimento atual.
A lógica sugere que essa hipótese corresponderia à seguinte dependência: quanto maior a vida de uma espécie, menor o indivíduo dessa forma de DNA e / ou é menos perigoso para essa espécie.
Mas até que esse estudo comparativo seja concluído, resta supor que nas espécies de vida longa (humanos) e de curta duração (camundongos) os cfDNAs são produzidos, presumivelmente, em quantidades relativamente comparáveis. E a descoberta de concentrações crescentes dessas moléculas em idosos pode muito bem ser uma conseqüência do processo de envelhecimento, e não sua causa.
Embora isso seja uma consequência que pode fortalecer a causa. Leia o artigo de Belikov.
Além disso, os autores da descoberta sugerem atribuir o cfDNA a outra classe de elementos genéticos móveis. E então, talvez, uma ampla participação na evolução de um processo como a transferência horizontal de genes, tanto em representantes de invertebrados quanto de vertebrados do mundo animal, obtenha sua explicação. Graças ao qual, de acordo com um dos dados mais recentes, o genoma humano poderia emprestar várias dezenas de genes de outras espécies [24]
Uma questão muito importante permanece em aberto: como exatamente os cfDNAs entram na célula? As hipóteses existentes incluem a sugestão de que partículas contendo DNA podem penetrar nas células através dos poros da membrana, bem como através de diferentes tipos de endocitose, macropinocitose dependente de proteoglicano ou quando interagindo com proteínas da membrana.
DNA extracelular para obesidade, inflamação, raios X e estresse de vários tipos
Outra descoberta interessante foi feita um ano depois por pesquisadores japoneses. Eles foram capazes de descrever a participação ativa do cfDNA, que apareceu no sangue como resultado da morte de adipócitos em pessoas obesas, no desenvolvimento de inflamação e resistência à insulina. O fator chave que interage com o cfDNA nesses processos foi a molécula de imunidade inata receptor Toll-like 9 (TLR9) [25].
Não sem intrigas por parte dos cientistas russos do Instituto de Biofísica Teórica e Experimental da Academia Russa de Ciências. Eles descobriram que a irradiação de raios-x e a droga antidiabética metformina causam um aumento na excreção urinária de cfDNA (nuclear e mitocondrial) em ratos.
Seus dados mostraram que, antes das experiências, a quantidade de cfDNA nuclear era 40% maior e a do fcDNA mitocondrial era 50% maior na urina de ratos idosos em comparação com ratos jovens.
12 horas após a irradiação, o conteúdo de i-fcDNA e mt-fcDNA na urina de ratos jovens aumentou 200% e 460%, respectivamente, em comparação com o controle, enquanto na urina de ratos idosos aumentou 250% e 720%.
6 horas após a administração de metformina a outros ratos, a quantidade de i-cfDNA e mt-fcDNA na urina de ratos jovens aumentou em 25% e 55% e em 50% e 160% na urina de ratos idosos.
Segundo os autores, esses dados sugerem que os raios X e a metformina causam um aumento significativo no cfDNA na urina de ratos (principalmente os antigos), causada pela morte celular ativa nos tecidos. Esses resultados também sugerem que a metformina pode atuar como um senolítico, iniciando a morte de células antigas contendo distúrbios estruturais e funcionais [26].
Em outubro do ano passado, os cientistas acompanharam a relação dos níveis de cfDNA com o estresse mental e a atividade física em jovens de 18 a 36 anos. Os resultados mostraram um aumento duplo no cfDNA após estresse laboratorial agudo psicossocial (TSST) e um aumento de cinco vezes no cfDNA após o exercício na esteira (com a realização de exaustão da esteira).
Também foi registrada uma quantidade aumentada de fragmentos mais curtos de cfDNA, característico da apoptose, no sangue após a exaustão física.
O DNA mitocondrial extracelular mostrou o mesmo aumento após as duas cargas de estresse. Além disso, os perfis de metilação do cfDNA utilizados neste trabalho como marcador para diferentes origens celulares foram significativamente diferentes para diferentes testes de estresse.
Para a análise da metilação, os cientistas selecionaram o gene HOXA5 ativamente envolvido no desenvolvimento embrionário, devido à especificidade de sua metilação em diferentes tipos de células. Assim, é caracterizada por hipermetilação nas células musculares, hipometilação nas células cerebrais, a partir de linhas celulares do hipocampo e neurônios cultivados, e metilação diferencial nas células sanguíneas.A metilação do gene HOXA5 no cfDNA diminuiu imediatamente após o estresse psicossocial e aumentou após o estresse físico, o que, segundo os autores, indica várias fontes celulares de liberação de DNA nuclear ativo. [27]DNA extracelular e envelhecimento
Agora a principal coisa. Vamos examinar a relação entre os níveis e as características específicas do cfDNA com o envelhecimento.Os primeiros trabalhos que mostraram essa relação foram publicados em 2011–13. Os microbiologistas e imunologistas finlandeses da Universidade de Tampere estudaram os valores de cfDNA em fígados com mais de 90 anos de idade, participantes do estudo Vitality 90+ e jovens (de 22 a 37 anos) como um grupo de controle.Os resultados de seu trabalho mostraram que a concentração de cfDNA nos fígados longos foi significativamente maior do que nos jovens. Também houve diferenças características no cfDNA: nos idosos foi representado mais por fragmentos de baixo peso molecular, nos jovens foi representado por mais fragmentos de alto peso molecular, ou seja, por mais tempo.Nos estudos a seguir, o mesmo grupo mostrou que os níveis de cfDNA tinham uma relação clara com marcadores de inflamação (correlacionados positivamente com os níveis de proteína C reativa, amilóide sérica A (SAA), etc.) e mortalidade em pessoas com mais de 90 anos de idade. E também o fato de que níveis mais altos de cfDNA total e hipometilado foram associados à inflamação sistêmica e ao desenvolvimento de astenia senil (fragilidade) [28-30].Dois dos estudos recentes mais recentes sobre cfDNA e envelhecimento mostraram alterações epigenéticas características nesse DNA.Em um deles, uma equipe de cientistas analisou como a metilação dos elementos genéticos móveis LINE-1 e Alu no cfDNA de pessoas saudáveis com idades entre 23 e 61 anos muda com a idade.O elemento LINE-1 tem um comprimento de cerca de 6 mil pb, enquanto os fragmentos de alto peso molecular do cfDNA, em comparação, têm um tamanho superior a 10 mil pbA LINHA-1 refere-se a retroelementos, ou seja, a elementos móveis que usam a transcrição reversa para sua reprodução, a transferência de informações genéticas do RNA para o DNA. O LINE-1 é o único elemento móvel do genoma conhecido atualmente que mantém a capacidade de reproduzir e mover suas cópias no genoma. Além disso, esta é a mais numerosa das estruturas móveis humanas: cópias da LINE-1 ocupam uma proporção enorme no DNA - um quinto de todo o genoma.O segundo elemento, Alu, não pode se multiplicar e fazer novas inserções no genoma por conta própria, e nesse processo depende do aparato genético do elemento LINE-1 (para obter mais detalhes sobre elementos do genoma retro, consulte o artigo na Mecânica Popular “ Retrovírus: a“ quinta coluna do DNA ”).Os resultados do estudo mostraram que, com o envelhecimento, há uma diminuição significativa na metilação dos retroelementos LINE-1 e Alu, e esse processo foi notavelmente mais intenso em fumantes.Como foi encontrado hoje, a atividade dos elementos LINE-1 e Alu, capazes de inserir suas cópias no genoma, contribui para uma parte significativa das doenças genéticas humanas e do câncer. São conhecidas mais de 100 inserções (inserções) mediadas por LINE-1 que levam a doenças genéticas humanas, e foram encontradas várias inserções LINE-1 que interrompem os genes supressores de tumores e provocam câncer [31].Em um segundo estudo, os cientistas confirmaram uma diminuição na metilação dos elementos LINE-1 e Alu no cfDNA com a idade. Além disso, entre os 4 grupos do estudo (fígados longos saudáveis acima de 100 anos, fígados longos não saudáveis acima de 100 anos, idosos (71 anos) e jovens (25 anos)), os fígados longos saudáveis com jovens e idosos com fígados longos apresentaram características semelhantes:“Constantemente em nosso estudo, observamos uma maior semelhança nos perfis de cfDNA, global e localmente, entre fígados jovens e saudáveis, diferentemente dos idosos e fígados insalubres. Portanto, nosso estudo sugere que o perfil de fcDNA pode ser usado não apenas como um biomarcador de idade, mas também como um preditor de saúde geral. ” [32]Assim, o DNA extracelular circulante mostrou-se intimamente relacionado ao estado de saúde e aos processos que ocorrem no corpo durante o envelhecimento: estresse oxidativo, inflamação e patologias relacionadas à idade.Os métodos modernos de pesquisa, como a PCR quantitativa em tempo real, permitem o uso do cfDNA como um biomarcador muito sensível dos processos relacionados ao envelhecimento.Estudos têm demonstrado o grande valor potencial da análise do cfDNA no diagnóstico de câncer, transplantologia, doenças cardiovasculares e renais, fibrose, diagnóstico pré-natal (durante a gravidez), lesões e sepse, além de medicina esportiva.Os dados obtidos de que o cfDNA pode exibir as propriedades de um elemento móvel e integrar-se ao DNA nuclear, afetando o desenvolvimento de patologias associadas a mutações e envelhecimento em geral, também são de interesse indiscutível.Tudo isso requer mais pesquisas e aperfeiçoamentos.A revisão foi preparada por: Alexey Rzheshevsky e um pouco de Mikhail BatinReferências- Jahr S, Hentze H, Englisch S, Hardt D, Fackelmayer FO, Hesch RD, Knippers R. DNA fragments in the blood plasma of cancer patients: quantitations and evidence for their origin from apoptotic and necrotic cells. Cancer Res. 2001 Feb 15;61(4):1659-65.
- Deligezer U1, Yaman F, Erten N, Dalay N. Frequent copresence of methylated DNA and fragmented nucleosomal DNA in plasma of lymphoma patients. Clin Chim Acta. 2003 Sep;335(1-2):89-94.
- Bishoff FZ, Dang D., Horne C., Marquez-Do D., Brincley WR, Levis DE Fetal DNA in maternal plasma circulates as apoptotic bodies: elucidations of structural nature of fetal DNA for non-invasive prenatal genetic diagnosis // Am. J. Hum. Genet. 2003. V. 73. P. 189.
- Sivanandham R, Brocca-Cofano E, Krampe N, Falwell E, Venkatraman SMK, Ribeiro RM, Apetrei C, Pandrea. Neutrophil extracellular trap production contributes to pathogenesis in SIV-infected nonhuman primates. J Clin Invest. 2018 Nov 1;128(11):5178-5183.
- Rogers JC, Boldt D., Kornfeld S. Excretion of deoxyribonuclein acid by lymphocytes stimulated with phytohemagglutinin or antigen // Proc. Nat. Acad. Sci. USA. 1972. V. 69, No 7. P. 1685–1689.
- ., .. . 2007. . .149, .23-32.
- Lerner RA, Meinke W., Goldstein DA Membrane-associated DNA in the cytoplasm of diploid human lymphocytes // Proc. Nat. Acad. Sci. USA. 1971. V. 68, No 6. P. 1212–1216.
- .. . . 2013;15(5):399-412.
- Galeazzi M, Morozzi G, Piccini M, Chen J, Bellisai F, Fineschi S, Marcolongo R. Dosage and characterization of circulating DNA: present usage and possible applications in systemic autoimmune disorders. Autoimmun Rev 2003;2:50-5.
- Leon SA, Revach M, Ehrlich GE, Adler R, Petersen V, Shapiro B. DNA in synovial fluid and the circulation of patients with arthritis. Arthritis Rheum 1981;24:1142-50.
- Destouni A, Vrettou C, Antonatos D, Chouliaras G, Traeger-Synodinos J, Patsilinakos S, et al. Cell-free DNA levels in acute myocardial infarction patients during hospitalization. Acta Cardiol 2009;64:51-7.
- Rainer TH, Wong LKS, Lam W, Yuen E, Lam NYL, Metreweli C, Lo YMD. Prognostic Use of Circulating Plasma Nucleic Acid Concentrations in Patients with Acute Stroke. Clin Chem 2003; 49:562-9.
- Lam NY, Rainer TH, Wong LK, Lam W, Lo YM. Plasma DNA as a prognostic marker for stroke patients with negative neuroimaging within the first 24 h of symptom onset. Resuscitation 2006; 68:71-8.
- .., .., .., .., .., .., .., .., .., .., — , , 2008, : 54(1), 78-93.
- Bulicheva, N. et al. Effect of cell-free DNA of patients with cardiomyopathy and rDNA on the frequency of contraction of electrically paced neonatal rat ventricular myocytes in culture. Ann NY Acad Sci. 2008. V. 1137. P. 273-277.
- Lecomte, T. Circulating free tumor DNA and colorectal cancer/ T. Lecomte, N. Ceze, E.
- Dorval, P. Laurent-Puig // Gastroenterol Clin Biol. 2010. V. 34. № 12. P. 662- 681.
- ., .. . . 2013.-N 6.-.673-681
- Gonzalez-Masia, JA et al. Circulating nucleic acids in plasma and serum (CNAPS): applications in oncology. Onco Targets Ther. 2013. V. 8. № 6. P. 819-32.
- Ermakov, AV et al. Oxidized extracellular DNA as a stress signal in human cells. Oxid Med Cell Longev. 2013. V. 2013. P. 649-747.
- Loseva, P. et al. Extracellular DNA oxidation stimulates activation of NRF2 and reduces the
- production of ROS in human mesenchymal stem cells. Expert Opin. Biol. Th. 2012. V.12. № 1. P. 85-97.
- Mittra I, Khare NK, Raghuram GV, et al. Circulating nucleic acids damage DNA of healthy cells by integrating into their genomes. J Biosci. 2015;40(1):91–111.
- Garcia‐Olmo DC, Dominguez C, Garcia‐Arranz M, Anker P, Stroun M, Garcia‐Verdugo JM, Garcia‐Olmo D (2010) Cell‐free nucleic acids circulating in the plasma of colorectal cancer patients induce the oncogenic transformation of susceptible cultured cells. Cancer Res. 70, 560–567
- Chan W, Gurnot C, Montine TJ, Sonnen JA, Guthrie KA, Lee Nelson J (2012) Male Microchimerism in the Human Female Brain. PLoS ONE 7, e45592.
- Crisp A, Boschetti C, Perry M, et al.: Expression of multiple horizontally acquired genes is a hallmark of both vertebrate and invertebrate genomes. Genome Biol. 2015;16:50. 10.1186/s13059-015-0607-3
- Sachiko Nishimoto, Daiju Fukuda et al. Obesity-induced DNA released from adipocytes stimulates chronic adipose tissue inflammation and insulin resistance. Sci Adv. 2016 Mar; 2(3): e1501332.
- Gaziev A, Abdullaev S, Minkabirova G, Kamenskikh K. X-rays and metformin cause increased urinary excretion of cell-free nuclear and mitochondrial DNA in aged rats. J Circ Biomark. 2016 Oct 25; 5:1849454416670782.
- Hummel EM, Hessas E, Müller S, Beiter T, Fisch M, Eibl A, Wolf OT, Giebel B, Platen P, Kumsta R, Moser DA Transl Psychiatry. 2018 Oct 29;8(1):236.
- Jylhävä J1, Kotipelto T, Raitala A, Jylhä M, Hervonen A, Hurme M. Aging is associated with quantitative and qualitative changes in circulating cell-free DNA: the Vitality 90+ study.
- Mech Ageing Dev. 2011 Jan-Feb;132(1-2):20-6.
- Jylhävä J1, Jylhä M, Lehtimäki T, Hervonen A, Hurme M. Circulating cell-free DNA is associated with mortality and inflammatory markers in nonagenarians: the Vitality 90+ Study. Exp Gerontol. 2012 May;47(5):372-8.
- Jylhävä J1, Nevalainen T, Marttila S, Jylhä M, Hervonen A, Hurme M. Characterization of the role of distinct plasma cell-free DNA species in age-associated inflammation and frailty. Aging Cell. 2013 Jun;12(3):388-97.
- Lars Erichsen,a Agnes Beermann et al. Genome-wide hypomethylation of LINE-1 and Alu retroelements in cell-free DNA of blood is an epigenetic biomarker of human aging. Saudi J Biol Sci. 2018 Sep; 25(6): 1220–1226.
- Teo YV, Capri M, Morsiani C, Pizza G, Faria AMC, Franceschi C, Neretti N. Cell-free DNA as a biomarker of aging. Aging Cell. 2019 Feb;18(1):e12890.