A questão do dispositivo de visão é uma parte perceptível da neurobiologia. Enormes volumes de literatura e quatro prêmios Nobel são dedicados a esta edição, mas nesta situação não se pode deixar de notar que o dispositivo de visão de mamíferos descrito nos livros didáticos não lida com a tarefa. O objetivo deste ensaio é mostrar um conjunto de razões pelas quais você não deve fechar os olhos para isso. De fato, um retrato do segredo da visão será apresentado, variando de uma variedade de pequenos detalhes no início do fluxo de informações visuais em mamíferos, a ameaça de ignorá-los e terminando com uma pilha de problemas na compreensão do processamento cerebral no final do caminho.
Dispositivo do sistema de visão
Aos olhos de qualquer livro sobre visão, vemos em três estágios. O primeiro estágio: a luz entra na retina e é convertida na excitação nervosa dos fotorreceptores - neurônios sensoriais da retina. Além disso, o olho normaliza o contraste e o brilho, foca a imagem.
A segunda etapa: o processo na retina, quando o mapa de excitações nervosas dos fotorreceptores é transformado em um fluxo de informações paralelo, cada elemento codificando seu próprio aspecto da informação visual. As células ganglionares, cujos axônios formam o nervo óptico, na retina são muito menores que os fotorreceptores, ocorre a primeira compressão da informação. Uma célula ganglionar pode ser responsável pela codificação de um sinal de várias no centro para centenas e milhares de fotorreceptores na periferia da retina. (Figura 1) As células ganglionares são divididas em dois tipos principais, dependendo da rota do nervo óptico, o sinal entra no córtex dos hemisférios cerebrais. Um tipo predominante quantitativamente (80% nas pessoas) fornece alta acuidade visual e percepção de cores; o contraste estável da imagem é importante para eles. Por razões históricas, são chamadas células PC ou células anãs, uma vez que o sinal delas passa através das camadas parvocelulares (células pequenas) dos corpos dobrados laterais. O segundo tipo de células MC, seu sinal passa pelas camadas magnocelulares (células grandes) dos corpos dobrados laterais. Eles são responsáveis pela percepção do movimento, pois possuem uma sensibilidade aumentada às imagens que piscam ou se movem.


 Figura 1. Medindo as propriedades dos campos receptivos. (A) A resposta de um neurônio (uma sequência de potenciais de ação ou "aderências") é controlada pelo registro extracelular de um animal anestesiado pelo eletrodo no corpo intermediário da cambota (LGN). Os estímulos são entregues à parte do campo visual correspondente ao neurônio. (B) Tabela de respostas condicionais de diferentes tipos de neurônios. Cada coluna mostra a resposta de um tipo de neurônio. Cada linha mostra respostas a um tipo de estímulo. Por exemplo, um neurônio que é seletivo na direção do movimento (segunda coluna) reage somente quando o estímulo se move pelo campo receptivo da esquerda para a direita. Os neurônios que possuem campos receptores padrão “centro / ambiente” são tolerantes ao tamanho e à motilidade do estímulo. Tipos não-padrão de neurônios exibem requisitos de estímulo muito mais intransigentes.
Figura 1. Medindo as propriedades dos campos receptivos. (A) A resposta de um neurônio (uma sequência de potenciais de ação ou "aderências") é controlada pelo registro extracelular de um animal anestesiado pelo eletrodo no corpo intermediário da cambota (LGN). Os estímulos são entregues à parte do campo visual correspondente ao neurônio. (B) Tabela de respostas condicionais de diferentes tipos de neurônios. Cada coluna mostra a resposta de um tipo de neurônio. Cada linha mostra respostas a um tipo de estímulo. Por exemplo, um neurônio que é seletivo na direção do movimento (segunda coluna) reage somente quando o estímulo se move pelo campo receptivo da esquerda para a direita. Os neurônios que possuem campos receptores padrão “centro / ambiente” são tolerantes ao tamanho e à motilidade do estímulo. Tipos não-padrão de neurônios exibem requisitos de estímulo muito mais intransigentes.Ambos os tipos dessas células têm um tipo de organização central / ambiente: uma estratégia de codificação supostamente universal para informações visuais. (Figura 2) O melhor estímulo para obter a resposta mais energética das células ganglionares é um ponto mais ou menos arredondado e pequeno na retina, e quanto mais intensamente se destaca contra o fundo ao redor (ponto brilhante ou escuro), mais energética é a resposta celular.
Terceiro estágio: o sinal é processado no cérebro. De um ponto de vista geralmente aceito, os principais processos de processamento do cérebro começam no córtex visual primário. Outra recodificação significativa ocorre: os neurônios não apenas respondem a pontos escuros e claros na superfície da retina, mas também se tornam seletivamente sensíveis a limites contrastantes orientados, seções orientadas de linhas e suas extremidades. Existem configurações mais complexas de estímulos, quando os neurônios respondem precisamente ao limite do contraste, independentemente da posição, se ele estiver na zona de responsabilidade da célula. Esse processamento "complexo" no córtex visual é usado como o segundo nível de abstração na percepção de uma imagem estática, em que o reconhecimento alcançou um novo nível mais geral de percepção dos limites, independentemente de sua posição. Como resultado: primeiro, a retina transmite sinais simples para o córtex cerebral; segundo, os neurônios do córtex visual primário usam esses sinais simples para detectar bordas e linhas contrastantes; e terceiro, esses blocos de construção fundamentais são usados para definir os limites de objetos inteiros e criar percepção visual.
Provavelmente ninguém assumiu que esse ponto de vista se transformaria em dogma fundamental de granito. A detecção de bordas passou a ser vista como se fosse a única maneira de os mamíferos verem como a evolução encontrou a solução perfeita para o problema da percepção efetiva da imagem. Neste ensaio, esse ponto de vista será questionado e perguntas incômodas serão feitas sobre a natureza da visão. Eles já foram criados mais de uma vez na história do estudo da visão e não sugerem respostas simples. Portanto, agora a principal tarefa é concentrar-se nessas questões, reunindo as razões para dúvidas no entendimento moderno do dispositivo de visão.
A retina de todos os mamíferos envia sinais não padronizados para o cérebro
Um estudo completo do caminho do fluxo visual dos olhos para o córtex cerebral nos primatas confirma peremptoriamente que, como em outras espécies de mamíferos, muitos canais paralelos contribuem funcionalmente para o fluxo visual dos primatas [1–4]. (Figura 2) Alguns desses canais até ignoram o córtex visual primário e imediatamente vão para os departamentos de hierarquia superior [5]. Muito disso foi mencionado em estudos clássicos da anatomia de gatos e macacos [6–10], mas foi ignorado pelos pioneiros da neurobiologia no estudo do córtex visual. O uso agressivo do princípio da navalha de Occam tornou possível dar sentido às propriedades dos neurônios corticais, pois eles desenvolvem sua função de reconhecer linhas ou bordas apenas com base em informações provenientes de células ganglionares da organização “centro / ambiente” [11]. As células ganglionares com uma organização não-padrão foram descartadas, possuindo um número relativamente baixo de primatas na retina. Qual o seu papel na percepção visual será descrito abaixo e, do ponto de vista dos profissionais de neurobiologia, é importante notar que, com a introdução arbitrária de um eletrodo no nervo óptico, a probabilidade de encontrar um axônio de uma célula ganglionar não-padrão é bastante pequena. Como as células não-padrão são raras, a maioria dos pesquisadores optou por seguir o caminho de menor resistência, criando métodos para projetar estímulos visuais na retina mais adequados para o estudo de células do centro / ambiente, que transformaram as células não-padrão em uma "explosão" estatística nos dados experimentais.
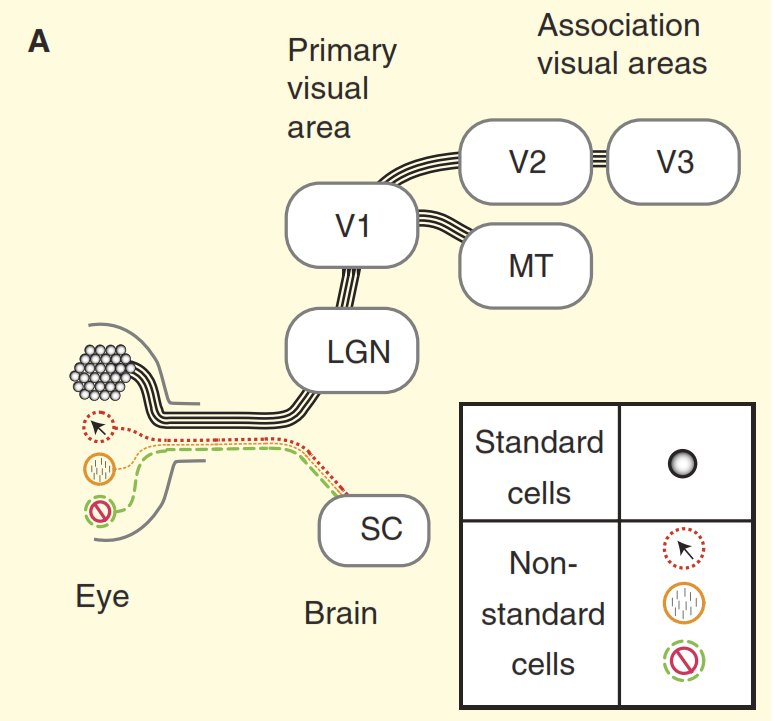
 Figura 2. Percepções do sistema visual.
Figura 2. Percepções do sistema visual.
(A) O ponto de vista dos livros didáticos sobre o design do sistema visual de primatas pelo exemplo do macaco. A retina é preenchida com um grande número de células ganglionares padrão, cujos axônios formam o nervo óptico. A retina também contém um pequeno número de células ganglionares não-padrão que respondem à luz de outras maneiras, mas é tradicionalmente assumido que elas são projetadas apenas nos centros autonômicos do mesencéfalo, ou seja, o dicolite superior (SC). As células concêntricas se projetam para o núcleo do relé no tálamo, o corpo dobrado intermediário (LGN), que por sua vez transmite sinais para o córtex visual primário (V1). E as células padrão através do corpo dobrado intermediário (LGN) transmitem um sinal ao córtex visual primário (V1) e depois às seções mais altas do córtex visual (V2, V3, MT).
(B) Uma visão mais realista do sistema visual dos primatas. Algumas células ganglionares não-padrão envenenam o sinal diretamente para o corpo dobrado intermediário (LGN) e depois para o córtex visual primário. Além disso, o diodo superior não é uma direção sem saída; a partir daí, o sinal vai para o corpo dobrado intermediário (LGN) e além. Mas isso não é tudo: começando com o corpo dobrado intermediário (LGN), o fluxo visual deixa de ser unidirecional e seu componente reverso é mais poderoso que o direto.O segundo problema é ilustrado na Figura 3. O gráfico superior da figura mostra a resposta da célula "centro / ambiente". O esquema básico de reação é muito familiar aos neurocientistas envolvidos na visão: as células ganglionares padrão do centro / ambiente mostram uma curva da linha de resposta à frequência espacial - a resposta máxima ocorre quando a banda da rede coincide exatamente em largura com a seção central do campo receptivo do centro / célula ambiente ". Mas agora considere a resposta de uma das células não-padrão no nervo óptico obtida no mesmo experimento (Figura 3 b). Desta vez, a célula pertence ao chamado tipo coniocelular de células ganglionares, um conjunto composto de tipos de células não-padrão, que geralmente é generalizado, se é que é chamado de “via azul”. Essa célula possui uma organização do tipo “supressão por contraste” [6,7,12,13]; nesse experimento, sua resposta é quase completamente oposta à resposta de uma célula padrão "centro / ambiente". Ao considerar a diferença na acuidade visual de macacos e gatos, as células ganglionares de "supressão por contraste" se comportam de forma idêntica [12,13].
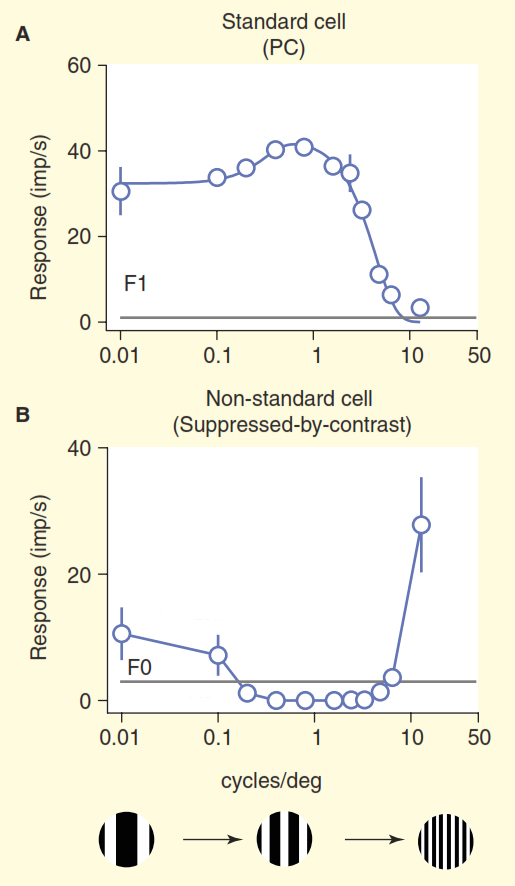 Figura 3. Comparação de campos receptivos padrão e não padrão. As células foram estimuladas por uma grade à deriva com uma frequência espacial variável (a frequência aqui é expressa como a largura total de duas bandas de preto e branco na grade por grau de ângulo de visão). A célula ganglionar padrão (centro / ambiente) (A) se comporta conforme o esperado: quando a largura da banda de treliça está próxima da largura do centro do campo receptivo, a célula fornece uma forte resposta. Uma célula não padrão com "supressão de contraste" (B) é silenciosa em vez de despertada, desde que seja capaz de distinguir entre listras pretas e brancas.
Figura 3. Comparação de campos receptivos padrão e não padrão. As células foram estimuladas por uma grade à deriva com uma frequência espacial variável (a frequência aqui é expressa como a largura total de duas bandas de preto e branco na grade por grau de ângulo de visão). A célula ganglionar padrão (centro / ambiente) (A) se comporta conforme o esperado: quando a largura da banda de treliça está próxima da largura do centro do campo receptivo, a célula fornece uma forte resposta. Uma célula não padrão com "supressão de contraste" (B) é silenciosa em vez de despertada, desde que seja capaz de distinguir entre listras pretas e brancas.Só podemos assumir que essas células reconhecem um preenchimento monótono em sua área de responsabilidade, por exemplo, um céu azul claro, pois quando a largura das barras brancas e pretas da grade diminui abaixo da resolução do olho humano, elas se fundem em cinza sólido. Um verdadeiro entendimento da codificação da informação visual para essas células não é apresentado no modelo de visão padrão.
Todos os não primatas veem bem usando células não padrão
Os defensores do modelo de visão aceito ao considerar primatas podem se referir a um número relativamente pequeno de células não-padrão, mas isso não se aplica às retinas de coelhos, gatos, ratos e camundongos [7,8,14-16]. Além disso, em números absolutos (cerca de 100.000), o número de células não padronizadas na retina de primatas é próximo ao número total de células na retina de um rato ou gato [17]. A acuidade visual em gatos, coelhos, ratos e camundongos é menor que nos primatas, mas isso não é tudo. A visão de todas essas criaturas permite que você lide com sucesso com a sobrevivência na natureza. Quem duvida disso é convidado a tentar espreitar um coelho no campo ou pegar um rato sem usar uma ratoeira (uma tarefa simples para um gato comum).
 Figura 4. Percepção visual com baixo detalhe.
Figura 4. Percepção visual com baixo detalhe.
Observadores familiarizados com as pessoas na imagem as reconhecem, apesar dos baixos detalhes. Ao desfocar uma imagem, informações visuais úteis suficientes permanecem para uma pessoa. Da esquerda para a direita: Príncipe Charles, Woody Allen, Bill Clinton, Saddam Hussein, Richard Nixon, Princesa Diana.É claro, mesmo que por razões médicas, por que os neurocientistas se concentraram na retina dos primatas. Mas essa concentração seletiva ao tentar entender a visão leva ao fato de que os pesquisadores trazem e transferem os resultados da autopercepção para a interpretação dos resultados da pesquisa. O denso acúmulo de células ganglionares de primatas é adequado para detectar frutos comestíveis em uma árvore ou para ler a última edição do The New York Times, mas não há razão específica para considerar tarefas como o summum bonum (lat .: o bem maior) da visão. No quadro evolutivo geral, essa acuidade visual extremamente alta pode ser considerada uma adaptação específica de nicho para a detecção de objetos de alto contraste a uma grande distância. A maioria dos mamíferos da retina não possui fóvea (a fossa central da retina) - uma área especializada com alta acuidade visual encontrada em primatas -, mas a visão sem um milhão de células ganglionares densamente compactadas permanece totalmente funcional. A prova é ilustrada na Figura 4: as pessoas são facilmente capazes de reconhecimento sem a acuidade visual usual [18]. Em mamíferos não primatas, a codificação de estímulos visuais foi especialmente bem estudada em coelhos [19–23]. Coelhos têm olhos grandes, e o sistema óptico é melhor do que muitos tipos de primatas, e também possuem células ganglionares centrais / ambientais na retina. No entanto, essas células padrão compõem apenas um quarto de toda a população de células ganglionares da retina, representadas por cerca de doze tipos funcionais e anatômicos [14,21]. É claro que cada um desses doze tipos de células é aprisionado pela evolução sob seus próprios estímulos visuais. Mas a importância desse fato reside no fato de que os canais das células ganglionares não padrão predominam no fluxo visual que flui para o cérebro do coelho. Esta informação não é nova: a inovação é a prova de que a retina de todos os mamíferos transmite uma variedade de canais visuais codificantes para o cérebro [4, 13, 24, 25] e que essa diversidade deve ser incluída em qualquer visão realista do dispositivo visual.
Um exemplo bem conhecido são as células que respondem seletivamente à direção do movimento do estímulo. Um tipo deles envia diretamente um sinal para os núcleos do tronco cerebral associados ao movimento dos olhos [26]. Mas outro tipo dessas células não é tão conhecido, o sinal a partir do qual vai não apenas para o mesencéfalo, mas também através dos corpos dobrados laterais até o córtex visual primário [19]. Tais células não são tão raras, mas não há menção a elas nos livros didáticos ao descrever o dispositivo de visão. O sinal de células ganglionares fora do padrão atinge inequivocamente o córtex visual, mas como ele é usado?
O segundo tipo de célula não-padrão (identificado em coelhos, gatos e camundongos) é o chamado detector de borda local. Como as células que respondem seletivamente à direção do movimento, elas também foram consideradas células ganglionares raras, mas agora sabemos que isso ocorreu devido a um erro ao usar eletrodos: elas provavelmente representam cerca de 15% de todas as células ganglionares [23]. Os sinais dessas células também atingem o córtex visual primário, mas suas respostas estão muito além das respostas visuais padrão [8,22,23]. Essas células respondem melhor a alvos pequenos e em movimento lento, como um predador ou um animal predador, movendo-se a uma distância distante. No entanto, se houver muitos objetos pequenos, como em um campo texturizado, as células param de responder. Em outras palavras, as células reagem a um pequeno objeto em movimento, mas somente quando ele está sozinho.
Aparentemente, o detector de borda local é o tipo mais numeroso de célula ganglionar da retina em um coelho, mas não foi incluído no modelo de visão padrão. Essas células podem formar um sistema de análise de movimento a distâncias remotas? Como o córtex visual processa os sinais dessas células? Como outras espécies de mamíferos percebem o mundo com células ganglionares padrão e detectores de borda locais - ou mesmo células com outra compressão de informações visuais que ainda precisam ser descobertas?
O córtex visual é mais inteligente do que os livros didáticos reconhecem
Mesmo se assumirmos que todo o fluxo visual é codificado apenas por células retinianas padrão, atualmente é sabido que o processamento no córtex visual primário não ocorre exclusivamente de acordo com o método originalmente proposto, usando neurônios "simples", "complexos" e "hiper-complexos", mas também neurônios "com inibição terminal". A discussão desse fato tem recebido muito espaço na literatura especializada [27–30].
Os problemas começam com outro fato óbvio de que quase todos os neurônios no córtex cerebral são não lineares, o que põe em dúvida a utilidade de esquemas hierárquicos com premissas lineares na interpretação de sua função [31,32].
Em segundo lugar, a idéia dos três principais tipos de células - "simples", "complexa" e "hiper-complexa" - é uma abstração grosseira da rica variedade de tipos de células do córtex visual primário identificada por métodos anatômicos [33,34]. Em terceiro lugar, os neurônios do córtex visual dependem não apenas do fluxo visual recebido, mas também de vários sinais contextuais de seus vizinhos, de modo que a reação aos mesmos estímulos que fazem parte da imagem cotidiana e criados artificialmente pelos experimentadores pode variar [27, 35].
As respostas dos neurônios do córtex visual nem sequer são fixadas no tempo: a remoção de uma pequena porção da retina, que leva ao aparecimento de um ponto cego, permite que os neurônios deixados sem trabalho alterem sua área de responsabilidade e processem informações visuais das seções de trabalho da retina mais próxima do ponto cego [36].Do ponto de vista da anatomia, nenhuma das opções acima é surpreendente. Somente até 10% da entrada de um neurônio individual vem dos canais do fluxo visual [37], o restante vem de neurônios vizinhos ou de neurônios localizados em partes superiores distantes do córtex cerebral, onde os neurônios visuais ainda são pouco compreendidos e a interpretação de suas funções é uma tarefa difícil.Assim, torna-se aparente que uma visão padrão do dispositivo de visão está presa em um pântano de dogmas. Que medidas devem ser tomadas para sair disso?Etapa 1: revise o básico
As últimas boas notícias são que as técnicas de imagem de células da retina sofreram uma revolução discreta nos últimos 5 anos, por isso agora é fácil visualizá-las em grandes números e com qualidade de resolução sem precedentes na forma de uma imagem tridimensional. O problema de encontrar sinapses e a posição relativa das células é facilmente resolvido, agora elas podem ser classificadas não apenas “a olho”, mas também usando métodos objetivos de classificação [15,16]. O grau de correspondência da tipagem morfológica com a tipificação fisiológica das células da retina mostra uma relação direta (discutida em [24]). Assim, os tipos estruturais de células ganglionares da retina determinam com precisão o número de canais funcionais no fluxo visual.Em todos os sistemas visuais de mamíferos estudados até o momento, os dados anatômicos indicam que o número de canais funcionais é de aproximadamente doze. Na retina de macacos e gatos, as funções de cerca de metade desses canais são bem compreendidas. Em um coelho, essa proporção é de cerca de um terço; a retina do rato e do rato, apesar de sua clara vantagem na pesquisa genética, permanece praticamente inexplorada.Assim, pode ser útil retornar, armado com métodos modernos, aos negócios inacabados da década de 1970 [38]. A tarefa é concluir a determinação das funções das células ganglionares, o primeiro estágio da compressão das informações visuais - livrar-se dos pontos cegos logo no início - e atualizar seus objetivos no restante do sistema visual.Incentivos para correção de etapas
Por que, após mais de meio século de pesquisa, o conhecimento da fisiologia da visão está tão atrás do conhecimento da anatomia e o que pode ser feito para melhorar a situação? Deixando de lado o problema da seletividade da pesquisa usando um eletrodo, o principal problema continua sendo a escolha de métodos para encontrar o estímulo certo.Entender por que as células ganglionares da retina e os neurônios no córtex visual primário são usados no sistema de visão - qual é o seu ajuste às características do ambiente visível - é muito mais difícil do que os pioneiros da neurociência sugeriram. A técnica de pesquisa clássica era que os experimentadores ouviam o sinal amplificado do eletrodo imerso aleatoriamente no nervo óptico ou no córtex cerebral enquanto moviam manualmente o estímulo projetado na retina em busca da área de responsabilidade da célula na qual o eletrodo tocou. Método rápido e eficaz, mas com subjetividade e falta de reprodutibilidade. Estímulos de rede simples e análise sistêmica linear são extremamente eficazes para células padrão [38,39], mas, como mencionado anteriormente,esse método é pouco adequado para o estudo de células não-padrão e neurônios não-lineares do córtex visual primário. Novas tentativas para determinar conjuntos de estímulos corretos são interessantes [40], mas ainda não há consenso.A alternativa é baseada na estratégia de correlação inversa [41–43], em que um estímulo selecionado aleatoriamente pelo pesquisador é apresentado várias vezes e a resposta celular é usada para calcular a média inversa. Assim, o experimentador pode construir uma representação do estímulo médio levando à resposta celular mais ativa. A grande vantagem desse método é que ele não implica nenhum ajuste específico da célula ao estímulo de teste. Por razões teóricas e analíticas, o estímulo de teste geralmente é escolhido como "aleatório": um tabuleiro de xadrez cintilante ou alguma outra forma de ruído visual. Essa estratégia é elegante do ponto de vista conceitual, mas está amplamente limitada à análise de células com uma organização padrão de centro / ambiente,uma vez que as células não-padrão (por definição) são ajustadas para recursos muito aleatórios da informação visual.Outra alternativa usa uma abordagem mais radical. A estratégia é buscar a correlação inversa da resposta da célula à imagem capturada em vídeo em um ambiente diário e apresentada na tela do monitor [27,44]. A idéia é que o pesquisador espere um sinal da célula quando um estímulo importante aparecer para ele. A eficiência de tal método foi comprovada experimentalmente, mas permanece a questão de quão natural uma imagem bidimensional deve ser considerada, como esse método levará em conta os efeitos da não linearidade e do contexto e, mais ainda, como interpretar os resultados.Nova teoria geral da visão?
Uma comparação inversa do mundo em torno dos sinais no cérebro pode ser vista como empirismo, levado ao extremo. Mas o que os teóricos da neurociência podem oferecer em contraste com seus colegas experimentadores? Eles têm a oportunidade de superar com sucesso o estilo atualmente popular, de um ponto de vista formal, que é apenas uma reformulação dos resultados experimentais. Apesar de um quarto de século de esforço, a maior parte do trabalho realizado não passou no teste do tempo e não pôde ser confirmada em novos fatos experimentais. Embora formulações precisas e compactas de resultados experimentais sejam importantes, elas raramente levam à síntese de novos conhecimentos, e o desejo pela conveniência da avaliação matemática dos dados pode impor restrições invisíveis aos experimentos. Um exemplo específico foi dado anteriormente:se o método experimental se limitar a apresentar grades de largura variável na forma de estímulo, uma célula ganglionar com a organização do tipo de "supressão por contraste" aparece apenas como uma "explosão" nos dados experimentais, sobre os quais o pesquisador não pode dizer mais nada.Como então os teóricos podem ajudar? Eles devem lidar com aspectos computacionalmente desconfortáveis do sistema nervoso real. Por exemplo, os fisiologistas experimentais sabem muito bem que os sistemas sensoriais são lineares apenas quando o pesquisador os obriga a fazê-lo [27,38,45]. É necessária uma ampla cobertura da teoria da visão para lidar com tarefas como entender os méritos da codificação redundante e esparsa nos sistemas visuais, a necessidade de esticar as pontes entre os estudos da visão em invertebrados e vertebrados [46,47]. A questão é se o repensar do primeiro estágio da compressão da informação visual na retina dará um resultado [46,48-50]. A variedade de canais funcionais do fluxo visual, que com toda a sua diversidade nos serve na forma de um sentimento - visão tão familiar, foi enfatizada anteriormente.Como resultado, a tarefa principal permanecerá para descobrir como simplesmente “vemos” e como, em geral, podemos entender isso?Referências1. Casagrande VA (1994). A third parallel visual pathway to primate area V1. Trends Neurosci. 17, 305–310.
2. Hendry SHC, and Reid RC (2000). The koniocellular pathway in primate vision. Ann. Rev. Neurosci. 23, 127–153.
3. White AJR, Solomon SG, and Martin PR (2001). Spatial properties of koniocellular cells in the lateral geniculate nucleus of the marmoset Callithrix jacchus. J. Physiol. 533, 519–535.
4. Dacey DM, Peterson BB, Robinson FR, and Gamlin PD (2003). Fireworks in the primate retina: in vitro photodynamics reveals diverse LGN-projecting ganglion cell types. Neuron 37, 15–27.
5. Sincich LC, Park KF, Wohlgemuth MJ, and Horton JC (2004). Bypassing V1: a direct geniculate input to area MT. Nat. Neurosci. 7, 1123–1128.
6. Rodieck RW (1967). Receptive fields in the cat retina: a new type. Science 157, 90–92.
7. Stone J. and Hoffmann K.-P. (1972). Very slow-conducting ganglion cells in the cat's retina: a major, new functional type? Brain Res. 43, 610–616.
8. Cleland BG, Levick WR, Morstyn R., and Wagner HG (1976). Lateral geniculate relay of slowly-conducting retinal afferents to cat visual cortex. J. Physiol. 255, 299–320.
9. DeMonasterio FM (1978). Properties of ganglion cells with atypical receptive-field organization in retina of macaques. J. Neurophysiol. 41, 1435–1449.
10. Yukie M., and Iwai E. (1981). Direct projection from the dorsal lateral geniculate nucleus to the prestriate cortex in macaque monkeys. J. Comp. Neurol. 201, 81–97.
11. Hubel DH, and Wiesel TN (1977). Ferrier lecture. Functional architecture of macaque monkey visual cortex. Proc. R. Soc. Lond. Ser. B Biol. Sci. 198, 1–59.
12. Troy JB, Einstein G., Schuurmans RP, Robson JG, and Enroth-Cugell CH (1989). Responses to sinusoidal gratings of two types of very nonlinear retinal ganglion cells of cat. Visual Neurosci. 3, 213–223.
13. Tailby C., Solomon SG, Dhruv NT, Majaj NJ, Sokol SH, and Lennie P. (2007). A new code for contrast in the primate visual pathway. J. Neurosci. 27, 3904–3909.
14. Rockhill RL, Daly FJ, MacNeil MA, Brown SP, and Masland RH (2002). The Diversity of ganglion cells in a mammalian retina. J. Neurosci. 22, 3831–3843.
15. Badea TC, and Nathans J. (2004). Quantitative analysis of neuronal morphologies in the mouse retina visualized by using a genetically directed reporter. J. Comp. Neurol. 480, 331–351.
16. Kong JH, Fish DR, Rockhill RL, and Masland RH (2005). Diversity of ganglion cells in the mouse retina: Unsupervised morphological classification and its limits. J. Comp. Neurol. 489, 293–310.
17. Wassle H. (2004). Parallel processing in the mammalian retina. Nat. Rev. Neurosci. 5, 747–757.
18. Sinha P. (2002). Recognizing complex patterns. Nat. Neurosci. 5 Suppl, 1093–1097.
19. Levick WR, Oyster CW, and Takahashi E. (1969). Rabbit lateral geniculate nucleus: sharpener of directional information. Science 165, 712–714.
20. DeVries SH, and Baylor DA (1997). Mosaic arrangement of ganglion cell receptive fields in rabbit retina. J. Neurophysiol. 78, 2048–2060.
21. Roska B., and Werblin F. (2001). Vertical interactions across ten parallel, stacked representations in the mammalian retina. Nature 410, 583–587.
22. Zeck GM, Xiao Q., and Masland RH (2005). The spatial filtering properties of local edge detectors and brisk-sustained retinal ganglion cells. Eur. J. Neurosci. 22, 2016–2026.
23. van Wyk M., Taylor WR, and Vaney DI (2006). Local edge detectors: a substrate for fine spatial vision at low temporal frequencies in rabbit retina. J. Neurosci. 26, 13250–13263.
24. Masland RH (2001). Neuronal diversity in the retina. Curr. Opin. Neurobiol. 11, 431–436.
25. Dacey DM, Liao HW, Peterson BB, Robinson FR, Smith VC, Pokorny J., Yau KW, and Gamlin PD (2005). Melanopsinexpressing ganglion cells in primate retina signal colour and irradiance and project to the LGN. Nature 433, 749–754.
26. Simpson JI (1984). The accessory optic system. Ann. Rev. Neurosci. 7, 13–41.
27. Carandini M., Demb JB, Mante V., Tolhurst DJ, Dan Y., Olshausen BA, Gallant JL, and Rust NC (2005). Do we know what the early visual system does? J. Neurosci. 25, 10577–10597.
28. Olshausen BA, and Field DJ (2004). Sparse coding of sensory inputs. Curr. Opin Neurobiol. 14, 481–487.
29. Simoncelli EP, and Olshausen BA (2001). Natural image statistics and neural representation. Ann. Rev. Neurosci. 24, 1193–1216.
30. Olshausen BA, and Field DJ (2005). How close are we to understanding v1? Neural. Comput. 17, 1665–1699.
31. Ferster D., and Miller KD (2000). Neural mechanisms of orientation selectivity in the visual cortex. Ann. Rev. Neurosci. 23, 441–471.
32. Anderson JS, Lampl I., Gillespie DC, and Ferster D. (2001). Membrane potential and conductance changes underlying length tuning of cells in cat primary visual cortex. J. Neurosci. 21, 2104–2112.
33. Lund JS, and Yoshioka T. (1991). Local circuit neurons of macaque monkey striate cortex: III. Neurons of laminae 4B, 4A, and 3B. J. Comp. Neurol. 311, 234–258.
34. Cauli B., Audinat E., Lambolez B., Angulo MC, Ropert N., Tsuzuki K., Hestrin S., and Rossier J. (1997). Molecular and physiological diversity of cortical nonpyramidal cells. J. Neurosci. 17, 3894–3906.
35. Zipser K., Lamme VA, and Schiller PH (1996). Contextual modulation in primary visual cortex. J. Neurosci. 16, 7376-7389.
36. Gilbert CD, Sigman M., and Crist RE (2001). The neural basis of perceptual learning. Neuron 31, 681–697.
37. Douglas RJ, and Martin KA (2004). Neuronal circuits of the neocortex. Ann. Rev. Neurosci. 27, 419–451.
38. Troy JB, and Shou T. (2002). The receptive fields of cat retinal ganglion cells in physiological and pathological states: where we are after half a century of research. Prog. Ret. Eye Res. 21, 263–302.
39. Lennie P., and Movshon JA (2005). Coding of color and form in the geniculostriate visual pathway. J. Opt. Soc. Am. 22, 2013–2033.
40. Victor JD (2005). Analyzing receptive fields, classification images and functional images: challenges with opportunities for synergy. Nat. Neurosci. 8, 1651–1656.
41. Srinivasan MV, Jin ZF, Stange G., and Ibbotson MR (1993). 'Vector white noise': a technique for mapping the motion receptive fields of direction-selective visual neurons. Biol. Cybern. 68, 199–207.
42. Meister M., and Berry MJ (1999). The neural code of the retina. Neuron 22, 435–450.
43. Kara P., Reinagel P., and Reid RC (2000). Low response variability in simultaneously recorded retinal, thalamic, and cortical neurons. Neuron 27, 635–646.
44. Ringach DL, Hawken MJ, and Shapley R. (2002). Receptive field structure of neurons in monkey primary visual cortex revealed by stimulation with natural image sequences. J. Vision 2, 12–24.
45. Schwartz O., and Simoncelli EP (2001). Natural signal statistics and sensory gain control. Nat. Neurosci. 4, 819–825.
46. Horridge A. (2000). Seven experiments on pattern vision of the honeybee, with a model. Vision Res. 40, 2589-2603.
47. Srinivasan MV (2006). Honeybee vision: in good shape for shape recognition. Curr. Biol. 16, R58–60.
48. Marr D. (1982). Vision: A Computational Investigation in the Human Representation and Processing of Visual Information (New York: WH Freeman).
49. Barlow HB (1997). The knowledge used in vision and where it comes from. Phil.Trans. Roy. Soc. Lond. B 352, 1141–1147.
50. Riesenhuber M., and Poggio T. (2000). Models of object recognition. Nat. Neurosci. 3, 1199–1204.