Monin Ilya Alekseevich, ctn
imoninpgd@gmail.com
Modelo Atom com um núcleo grande comparável ao tamanho do Atom como um todo.
Atualmente, em Física, o modelo de átomo de Rutherford-Bohr é considerado universalmente reconhecido, no qual um núcleo pequeno, pesado e carregado positivamente é cercado por invólucros de elétrons quase sem peso, enquanto o tamanho dos invólucros de elétrons é 1000 vezes maior que o tamanho do núcleo.
O modelo de átomo de Rutherford-Bohr possui muitas falhas inerentes que foram ocultadas por 100 anos desde seu início.
A única coisa que explica o modelo de átomo de Rutherford-Bohr é a experiência de espalhar o fluxo de partículas alfa em uma fina folha de ouro. A partir da qual foi tirada uma conclusão sobre o tamanho extremamente pequeno do núcleo positivo na composição de um enorme átomo preenchido com o vazio de invólucros de elétrons.
E como o modelo de Rutherford explica a existência de sólidos com densidade fixa?
E de forma alguma explica quaisquer propriedades de substâncias reais conhecidas da vida cotidiana.
Foi por esse motivo que tive que compor meu próprio modelo da estrutura do átomo.
Nenhum dos modelos existentes pode explicar tudo de uma vez.
No meu modelo, não explico a dispersão de partículas alfa no experimento de Rutherford.
Bem, o modelo de Rutherford explica apenas uma experiência de espalhar partículas alfa em uma folha de ouro, mas não pode explicar mais nada.
Mas meu modelo explica a existência de sólidos, líquidos, gases e todas as transições de fase entre eles.
No modelo de Rutherford-Bohr, é completamente incompreensível em que forças as substâncias sólidas existem, das quais todos os objetos ao nosso redor são compostos, a transição de um estado sólido para um líquido e de um estado líquido para um gasoso de uma substância também é incompreensível.
É hora de tentar repensar o modelo de estrutura Atom e criar um novo conceito que seja capaz de explicar tanto a resistência dos sólidos quanto a elasticidade dos gases rarefeitos.
Um novo modelo Atom é proposto para consideração, cujos principais recursos são as seguintes teses:
- O núcleo do átomo praticamente coincide em tamanho com o limite externo do átomo;
- O núcleo atômico não é um grupo caótico de núcleons (nêutrons e prótons), mas possui uma arquitetura-estrutura muito clara, responsável por todas as propriedades físicas e químicas de uma substância simples em particular da tabela periódica;
- Os átomos nos sólidos entram em contato diretamente com seus núcleos sólidos;
- A transição para diferentes fases (sólido-líquido-gasoso) é realizada com uma mudança na posição relativa dos núcleons individuais (ou de seus elementos) na estrutura do núcleo;
- O conceito de “Casca de átomo eletrônico” é excluído do novo modelo de átomo e todas as interações de átomos são realizadas através do contato direto de núcleons de núcleos e através dos campos eletrostáticos e magnéticos conhecidos, ligados a núcleons específicos na composição do núcleo.
- Não há partículas separadas "Elétron" neste modelo de átomo.
O núcleo do átomo praticamente coincide em tamanho com o limite externo do átomo. A coincidência do tamanho do Núcleo com as dimensões externas do átomo permite dar explicações a muitos estados de fase inexplicáveis anteriormente, ou seja, substâncias sólidas, líquidas e gasosas.
Substâncias sólidas no novo conceito são explicadas por átomos-núcleos sólidos diretamente em contato. Além disso, sua resistência à tração é determinada pela atração de átomos individuais no nível das forças magnéticas de curto alcance no núcleo atômico. Bem, a força compressiva é determinada exclusivamente pela força dos próprios núcleos atômicos densos. A resistência à compressão tende ao infinito, o que se manifesta no próprio fato da existência de objetos gigantes fortemente comprimidos pela gravidade, como estrelas e planetas.
O caso da pressão unilateral não cria as condições para uma compressão abrangente e, portanto, os átomos começam a deslizar um contra o outro sob a ação de forças de cisalhamento na direção perpendicular da força de compressão atuante. É precisamente a possibilidade de tal mudança na qual todas as tecnologias de moldagem de metal (prensagem, forjamento, estampagem) se baseiam, quando é possível enrolar um espaço em branco de metal em uma folha muito fina em um espaço estreito entre os rolos, ou é possível achatar um espaço em branco entre uma matriz e um perfurador em um produto em forma de vidro. É exatamente assim que as latas de cerveja de paredes finas são feitas a partir de pellets-blanks de alumínio por estampagem.
O núcleo de um átomo possui uma estrutura-arquitetura muito clara e única, responsável por todas as propriedades físicas e químicas de uma substância simples em particular da tabela periódica.
A transição para a consideração de "pequenos" detalhes da estrutura do núcleo nos permite passar da característica numérica não significativa existente do número de núcleons e da magnitude da carga de acordo com a tabela periódica para a característica qualitativa informativa da arquitetura da estrutura do núcleo, que deve conter todo o conjunto de propriedades químicas e físicas de uma substância simples.
A transição para diferentes estados agregados (sólido-líquido-gás) ocorre quando a posição relativa dos núcleons individuais na estrutura do núcleo muda ou os próprios núcleons mudam na nutria.
No modelo do átomo de Rutherford-Bohr, o núcleo era milhares de vezes menor que o tamanho do átomo e, portanto, o efeito de seu pequeno núcleo nas transformações de fase externa simplesmente não era considerado. Com um aumento de mil vezes no tamanho do núcleo, seu papel aumenta acentuadamente no efeito sobre todas as propriedades físicas da matéria, incluindo transições de fase para vários estados de agregação. No contato direto de grandes núcleos-átomos de múltiplos núcleos, surge um novo tipo de interação, baseado nas forças magnéticas e eletrostáticas conhecidas.
Com o contato próximo dos Núcleos, ampliado para as fronteiras externas do Átomo, começa a surgir o fenômeno anteriormente negligenciado "Interação Eletrostática e Magnética da Ordem de Curto Alcance", ou seja, a interação de Cargas Magnéticas e Elétricas Fortes de núcleons a distâncias próximas ao tamanho do Núcleo e ao tamanho dos núcleons individuais.
O modelo anterior considerava o átomo eletricamente neutro e a separação da carga negativa da camada de elétrons e do núcleo positivo não era levada em consideração.
No novo modelo, a interação dos Núcleos-Átomos pode ser considerada no nível do efeito local da convergência próxima dos polos com o mesmo nome do núcleo interno espaçado Charges-Dipoles. Essa abordagem possibilita a criação de um modelo de sólido sobre as forças de atração magnética, bem como um modelo de estados de gás estático sobre as forças de repulsão eletrostática. O estado intermediário no modelo de fase líquida possui elementos dos modelos de fase sólida e gasosa, que são opostos um ao outro em um espaço estreito entre os átomos.
Existe gás nas forças repulsivas do mesmo nome Cargas eletrostáticas nos dipolos de núcleons individuais, quando todos os dipolos elétricos do átomo são virados para fora pelo mesmo nome do pólo elétrico. Neste caso, todos os átomos de gás adjacentes são cerrados com os mesmos pólos de dipolos elétricos (no total, o átomo permanece neutro), o que cria sua repulsão mútua eletrostática local. (Fig. 1, Fig. 2, Fig. 3).
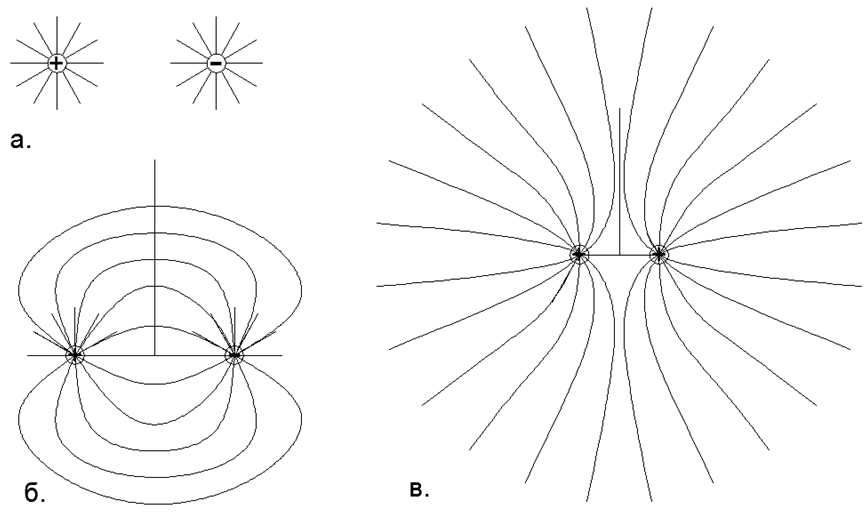 Fig. 1. A interação dos campos de cargas pontuais de acordo com o princípio de superposição: a) Duas cargas isoladas opostas com um campo elétrico regular (esférico) dirigido radialmente, onde as linhas de força são distribuídas uniformemente e se estendem radialmente ao infinito, ou seja, no modelo abstrato, seus campos não interagem; b) A forma real das linhas de força de duas cargas opostas isoladas e próximas, onde, de acordo com o princípio da superposição, as linhas de força de uma carga positiva são fechadas por uma carga negativa e, no infinito, a carga total desse sistema é percebida como zero e as linhas de força não vão de dipolo para o infinito; c) A forma real das linhas de força de duas cargas homônimas e unidimensionais, espaçadas de forma única, onde, de acordo com o princípio da superposição, as linhas de força das mesmas cargas não se cruzam, mas são deslocadas para meios espaços separados e, no infinito, a carga total desse sistema é percebida como uma carga pontual de valor duplo.
Fig. 1. A interação dos campos de cargas pontuais de acordo com o princípio de superposição: a) Duas cargas isoladas opostas com um campo elétrico regular (esférico) dirigido radialmente, onde as linhas de força são distribuídas uniformemente e se estendem radialmente ao infinito, ou seja, no modelo abstrato, seus campos não interagem; b) A forma real das linhas de força de duas cargas opostas isoladas e próximas, onde, de acordo com o princípio da superposição, as linhas de força de uma carga positiva são fechadas por uma carga negativa e, no infinito, a carga total desse sistema é percebida como zero e as linhas de força não vão de dipolo para o infinito; c) A forma real das linhas de força de duas cargas homônimas e unidimensionais, espaçadas de forma única, onde, de acordo com o princípio da superposição, as linhas de força das mesmas cargas não se cruzam, mas são deslocadas para meios espaços separados e, no infinito, a carga total desse sistema é percebida como uma carga pontual de valor duplo. Ou seja, de um macroambiente distante, os átomos neutros parecem uniformemente neutros, enquanto na ordem de curto alcance com os átomos vizinhos os gases são mantidos em um estado estável eqüidistante pelas forças do mesmo nome repulsão eletrostática.
No modelo "Interação eletrostática da ordem de curto alcance", as moléculas de gás param de se mover em velocidades tremendas, permanecendo em um estado de repouso eletricamente intenso, e sua temperatura é determinada apenas pela força do campo eletrostático na ordem de interação de curto alcance. Uma mudança suave na temperatura do gás é realizada por uma mudança síncrona suave no comprimento dos ombros dos dipolos elétricos do núcleo interno na direção radial do átomo. Quanto menor o braço dipolo, menor o comprimento das pétalas da coroa eletrostática que ele pode criar.
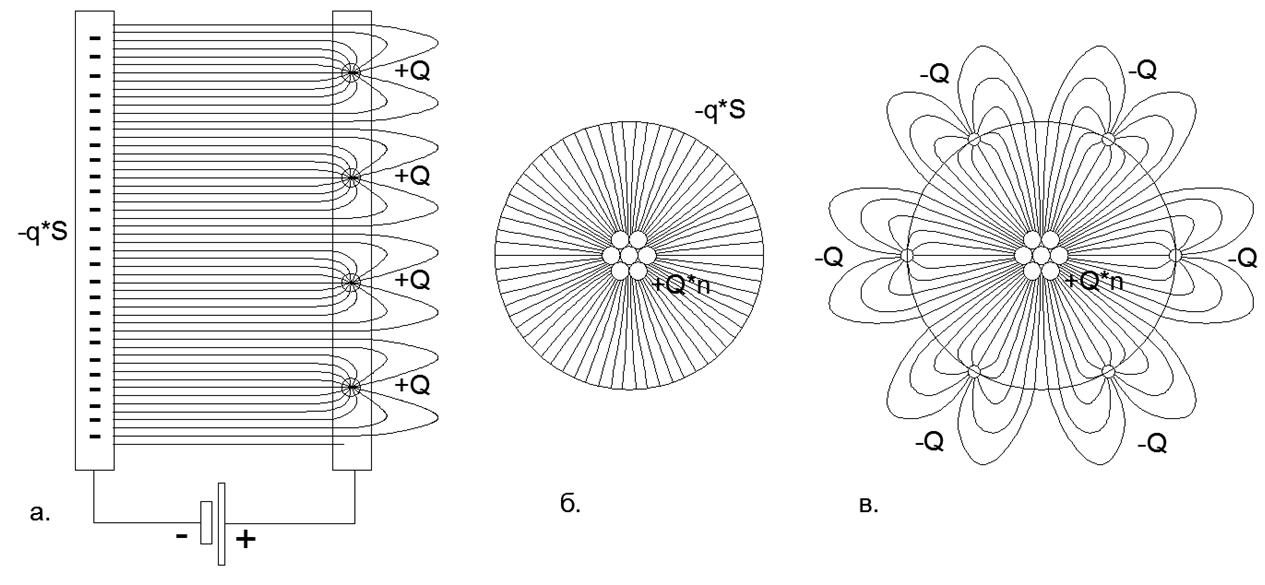 Fig. 2 Distribuição das linhas de campo eletrostático nas placas de um capacitor com cargas distribuídas e pontuais: a) Capacitor plano com uma carga distribuída das placas Minus (o campo não intercepta o campo) e cargas de ponto único na placa Plus (o campo fecha fora do intervalo entre as placas) ; b) Capacitor esférico com carga distribuída no revestimento negativo e cargas de ponto único no revestimento positivo; c) Capacitor esférico com cargas de ponto único no revestimento Plus e cargas de ponto único no revestimento Menos (o fechamento do campo por cargas externas cria pétalas de linhas de campo longas que se estendem para o espaço além do revestimento esférico externo sólido do capacitor).
Fig. 2 Distribuição das linhas de campo eletrostático nas placas de um capacitor com cargas distribuídas e pontuais: a) Capacitor plano com uma carga distribuída das placas Minus (o campo não intercepta o campo) e cargas de ponto único na placa Plus (o campo fecha fora do intervalo entre as placas) ; b) Capacitor esférico com carga distribuída no revestimento negativo e cargas de ponto único no revestimento positivo; c) Capacitor esférico com cargas de ponto único no revestimento Plus e cargas de ponto único no revestimento Menos (o fechamento do campo por cargas externas cria pétalas de linhas de campo longas que se estendem para o espaço além do revestimento esférico externo sólido do capacitor).
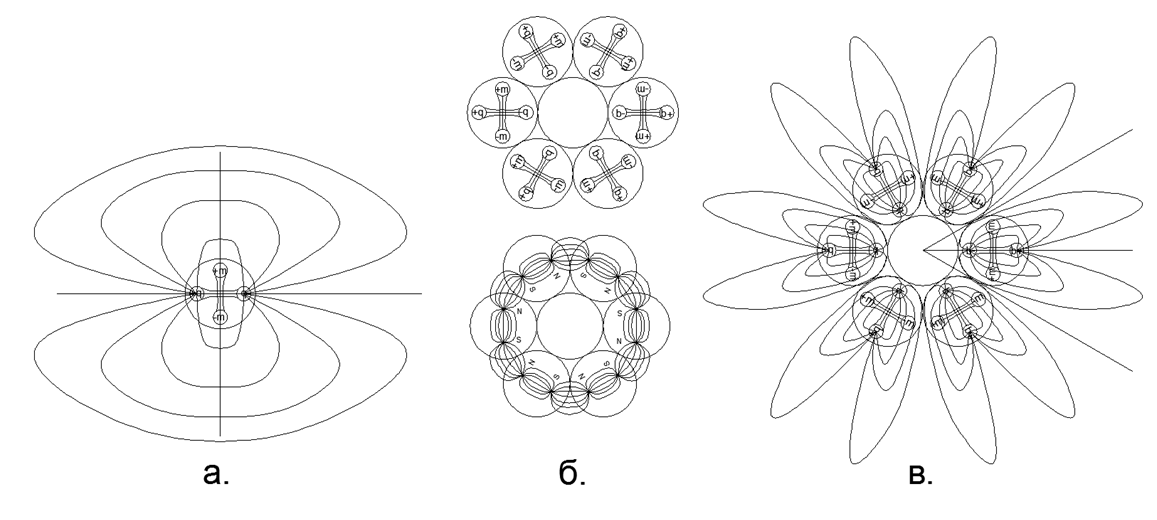 Fig. 3. a) Vista do campo elétrico do dipolo na composição de um núcleo livre; b) retenção nas forças magnéticas de uma cadeia de 6 núcleons fechados em um anel, enquanto as linhas magnéticas de força são completamente fechadas dentro do anel e não vão para o espaço sideral; c) O campo elétrico dos dipolos do anel do núcleo, formando a "coroa" eletrostática (neste caso, as pétalas das linhas de força da "coroa" elétrica vão muito além dos limites das dimensões do átomo).
Fig. 3. a) Vista do campo elétrico do dipolo na composição de um núcleo livre; b) retenção nas forças magnéticas de uma cadeia de 6 núcleons fechados em um anel, enquanto as linhas magnéticas de força são completamente fechadas dentro do anel e não vão para o espaço sideral; c) O campo elétrico dos dipolos do anel do núcleo, formando a "coroa" eletrostática (neste caso, as pétalas das linhas de força da "coroa" elétrica vão muito além dos limites das dimensões do átomo).O efeito de repulsão eletrostática de curto alcance nos gases e a atração magnética dos núcleos na fase líquida (sólida) explicam bem o processo de vaporização durante o aquecimento gradual e o estado crítico do vapor por saturação. Assim, a evaporação (saída de uma fase sólida ou líquida para um estado gasoso) ocorre quando, quando um átomo é aquecido, os dipolos eletrostáticos dos núcleons giram com os mesmos pólos, a ponto de em algum momento a repulsão eletrostática se tornar maior que a força da atração magnética dos átomos vizinhos. A condensação ocorre na ordem inversa: o resfriamento do átomo leva a uma diminuição na intensidade da repulsão eletrostática quando os dipolos elétricos são girados para uma posição neutra.
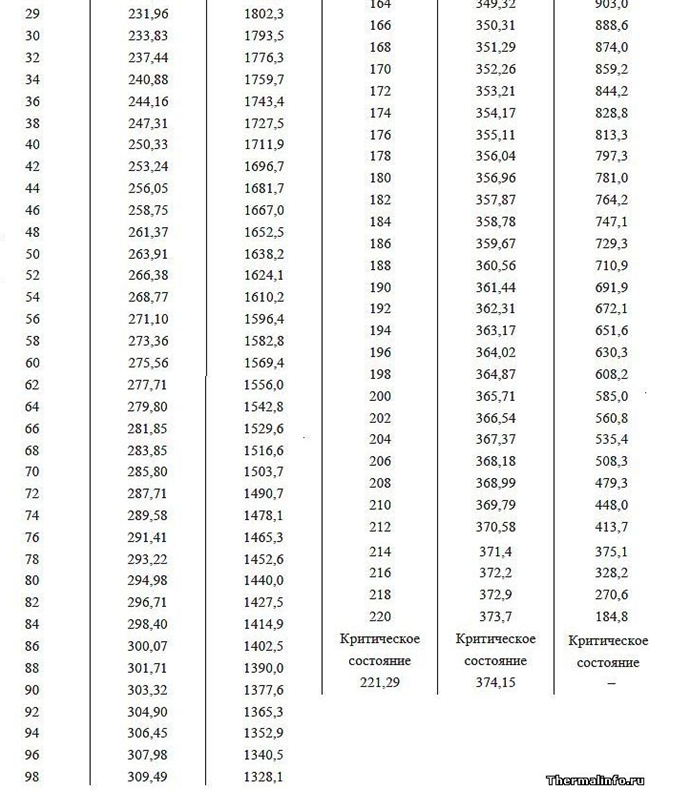
A função de trabalho (energia de vaporização) é a energia de campo adicional gasta por um átomo durante a expansão da coroa eletrostática em um espaço de gás vazio. A energia de saída (calor de vaporização) com o aumento da pressão do gás deve diminuir a uma temperatura igual do líquido e do gás acima dele, o que é confirmado pelo exemplo da dependência do valor do calor de vaporização em diferentes pressões de ar ao redor (consulte os dados da tabela para pressões abaixo de 1 atm nas montanhas altas). Além disso, com o aumento da pressão e do ponto de ebulição da água (dados tabulares do ponto de ebulição da água a diferentes pressões acima de 1 atm.), A função de trabalho diminui, o que é explicado pela redução da diferença nos tamanhos das distâncias intermoleculares nas fases líquida e gasosa, reduzindo assim o volume do campo elétrico da Corona, que absorve adicionalmente energia quando abre após deixar água densa em uma fase gasosa rarefeita.
A transição do estado de vapor para o estado de gelo em temperaturas negativas deve passar pela fase da água líquida. Ao mesmo tempo, a camada mais fina da fase líquida da água com uma temperatura acima de Zero Celsius é formada na superfície do gelo já solidificado, na qual o fluxo de calor do dobramento do campo das moléculas de água condensada é distribuído. Quanto maior a diferença na temperatura do gelo em relação a 0º, mais fina a camada de água na superfície, uma vez que uma grande diferença de temperatura aumenta a taxa de transferência de calor na camada de gelo líquido, com uma diminuição proporcional na espessura da camada de água para conduzir o fluxo de calor desejado a partir da molécula de água condensada.
A camada mais fina de água na superfície do gelo ao interagir com o suporte de uma carga externa (a sola da bota ou do trenó do corredor) cria as condições para o aparecimento de uma "hidroclina", mesmo a velocidades relativas da carga em relação ao gelo quase zero. A camada mais fina de água, com uma espessura de várias linhas moleculares, simplesmente não tem tempo para se espremer em uma brecha fina, enquanto a viscosidade da água líquida é muito baixa, o que cria a possibilidade de deslizar a sola no gelo em uma graxa de água "hidroclina".
Se a espessura da hidroclina estiver associada a uma queda de temperatura relativa a 0 ° C, o escorregadio do gelo deverá diminuir com o aumento da geada. Este é exatamente o comportamento do gelo que pode ser rastreado na prática, quando o maior deslizamento nas estradas é perceptível a temperaturas próximas de zero Celsius. Em geadas severas, ao mover-se no gelo, o contato direto é feito de sólido sólido, praticamente sem a formação de hidroclina, como se houvesse uma configuração molecular instantânea de gelo com a sola (pneu) com o congelamento do suporte ao gelo.
Segundo alguns relatos, a espessura do filme de água na superfície do gelo, igual a -5 graus 100 nm, diminui dez vezes entre -35 graus e 10 nm e, a -170 graus, geralmente consiste em uma camada de moléculas. Assim, os moradores do Ártico dizem que arrastar trenós no gelo a temperaturas muito baixas é o mesmo que arrastá-los na areia (afinal, não há lubrificação suficiente neste caso).
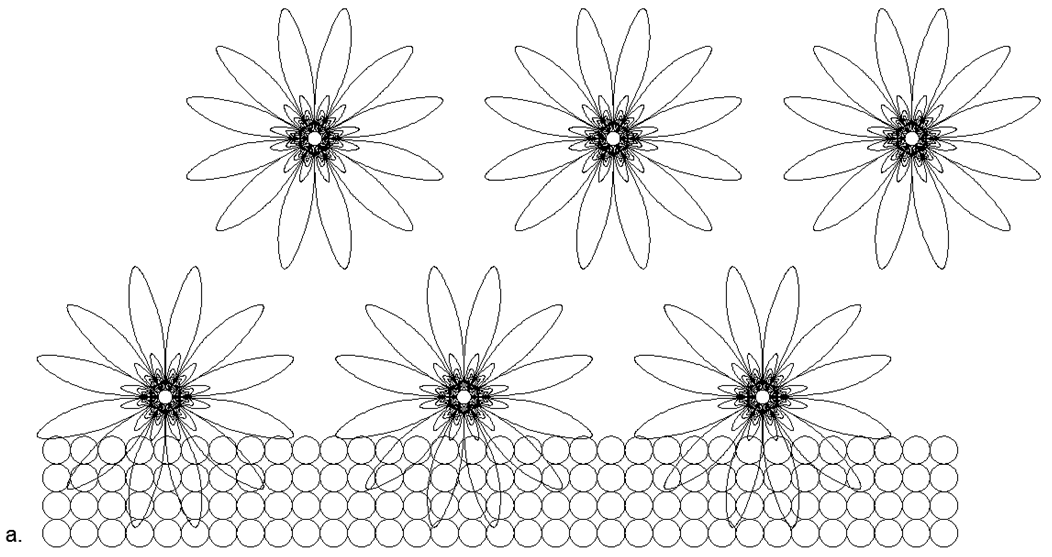
 Fig. 4 Representação esquemática da zona de fronteira de contato de diferentes fases Gás líquido (água-ar) no caso da teoria eletroestática de gás: a) Gás a uma pressão de 1 atm. acima da água líquida (a distância entre os centros das moléculas é aproximadamente 10 vezes maior que na fase líquida); b) O mesmo gás acima da água na mesma temperatura, mas a uma pressão de 10 atm., enquanto a distância entre os centros das moléculas de gás é reduzida em 10 ^ 1/3 = 2,15 vezes. Pode-se ver claramente a deformação da coroa elétrica monopolar em contato dos átomos de gás à medida que as moléculas se aproximam. As linhas de força não podem se cruzar e, portanto, são forçadas a se deformar, ocupando um volume menor, o que leva a um aumento nas forças de repulsão mútua (aumento da pressão do gás).Tab. 1. O calor da vaporização da água, dependendo da pressão e da temperatura.
Fig. 4 Representação esquemática da zona de fronteira de contato de diferentes fases Gás líquido (água-ar) no caso da teoria eletroestática de gás: a) Gás a uma pressão de 1 atm. acima da água líquida (a distância entre os centros das moléculas é aproximadamente 10 vezes maior que na fase líquida); b) O mesmo gás acima da água na mesma temperatura, mas a uma pressão de 10 atm., enquanto a distância entre os centros das moléculas de gás é reduzida em 10 ^ 1/3 = 2,15 vezes. Pode-se ver claramente a deformação da coroa elétrica monopolar em contato dos átomos de gás à medida que as moléculas se aproximam. As linhas de força não podem se cruzar e, portanto, são forçadas a se deformar, ocupando um volume menor, o que leva a um aumento nas forças de repulsão mútua (aumento da pressão do gás).Tab. 1. O calor da vaporização da água, dependendo da pressão e da temperatura.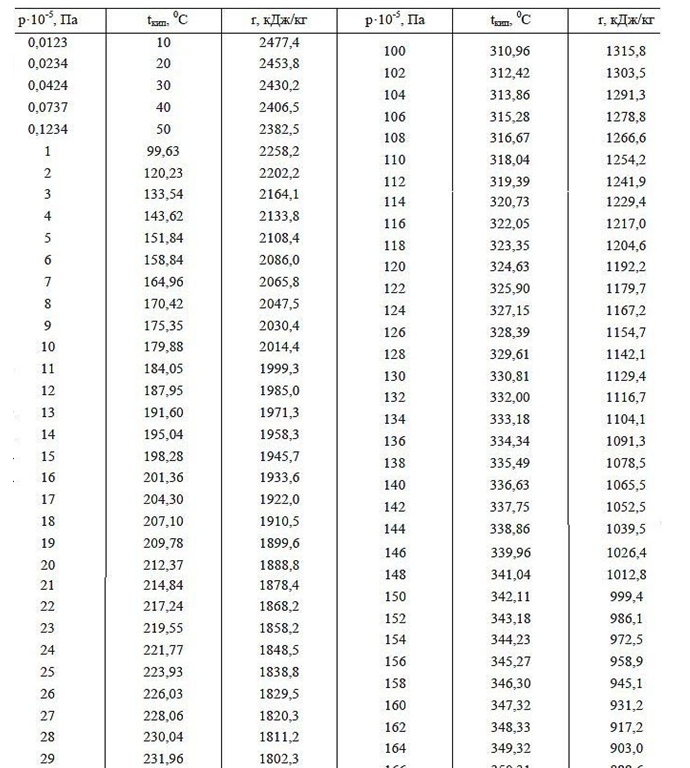
As equações de estado existentes de um gás ideal (lei de Boyle-Marriott) descrevem bem os gases a baixas pressões (condições normais) e altas temperaturas. Mas, sob altas pressões, essa lei ideal não nos permite descrever transições para o estado líquido ou mesmo para o estado sólido.
A lei de Van der Waals tenta corrigir inconsistências introduzindo fatores adicionais, ajustando a curva teórica à dependência obtida experimentalmente. Nesse caso, ocorre uma rejeição oculta do modelo de átomo de Rutherford-Bohr, já que na equação de Van der Wals o átomo é representado por uma bola sólida preenchendo todo o volume em seus limites externos.
Ao mesmo tempo, a natureza da interação das bolas atômicas não é qualitativamente explicada, deixando explicações no nível de invólucros estatísticos sem peso sobre um minúsculo nucléolo, como deveria estar de acordo com o modelo de Rutherford-Bohr.
No caso do modelo proposto, onde ocorre a repulsão de superfícies com carga semelhante, torna-se possível considerar o Modelo Estático de Entendimento, em que cada elemento do modelo tem uma modalidade física compreensível e um significado físico.
Portanto, a interação dos dipolos é expressa pela fórmula mais simples de interação direta por pares para cargas de quatro pontos coletadas em pares em dipolos mecanicamente fortes com um ombro L e uma distância R entre as extremidades próximas dos dipolos:
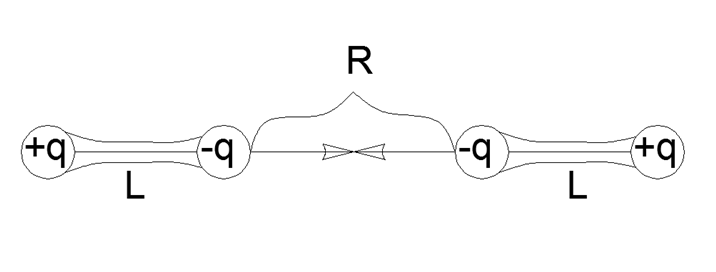
F = K q2 (1 / R2 - 2 / (R + L) 2 + 1 / (R + 2L) 2)
Levando a um denominador comum e abrindo os colchetes no numerador, obtemos uma expressão ainda mais complicada:
F = K q2 (2R2L2 + 12RL3 + 4L4) / (R2 (R + L) 2 (R + 2L) 2)
Uma característica do modelo de cálculo para dipolos é que a função de repulsão dos dipolos tende ao infinito longe do centro do átomo e, mais precisamente, na borda externa, onde o contato direto dos átomos é possível sob a influência das forças mais poderosas da atração atômica magnética. É esse contato de duas mudanças bruscas de valor e forças opostas de signos na fronteira atômica que nos permite criar um modelo equilibrado de Repulsão-Atração de átomos entre si.
Quando R >> L, a função de repulsão eletrostática de dipolos é simplificada para a forma:
F = K q2 2L2 / R4
A atração magnética tem uma propriedade de saturação e o gráfico da função não chega ao infinito mesmo com o contato direto dos átomos; portanto, a atração magnética sempre encontrará um ponto de equilíbrio com repulsão eletrostática em uma inclinação hiperbólica íngreme da característica eletrostática.Obviamente, é claro que, na realidade, não existem forças infinitamente grandes, mas há um certo limite de valores máximos (por exemplo, as forças atrativas dos átomos podem ser estimadas por medição direta da resistência à tração em um único cristal de uma substância, e a finitude das forças da interação eletrostática é determinada pela energia fixa durante a aniquilação de elétrons e pósitrons). Quando dois átomos se juntam, as forças repulsivas em algum momento também deixam de crescer rapidamente e atingem um certo valor finito fixo. Assim, dois valores não infinitamente grandes de atração e repulsão se equilibram em um certo ponto de equilíbrio mútuo, que pode ser encontrado na interseção dos gráficos dessas duas funções, ao plotar gráficos em um sistema de coordenadas. (ver gráfico 1)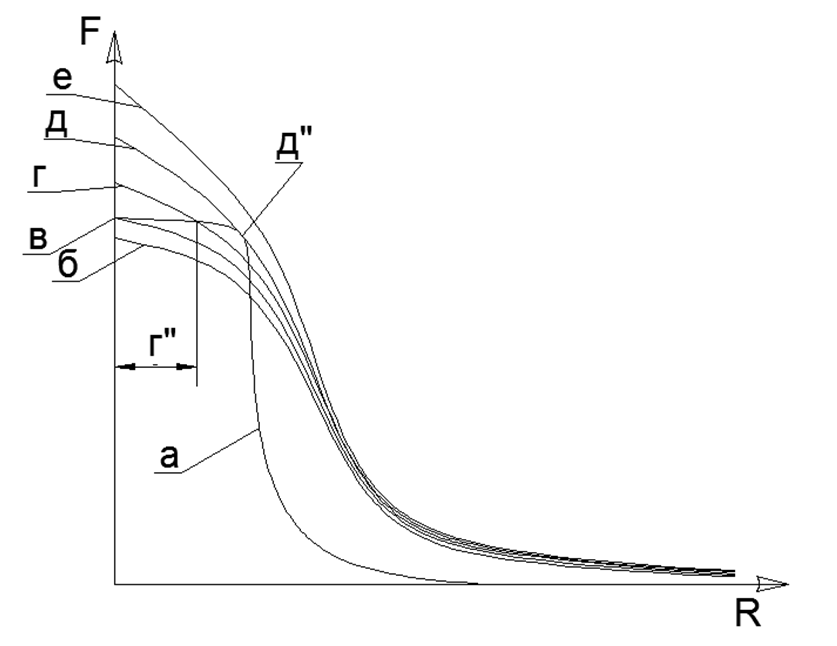 .1. () : (); (), () (''); - () (''); (). R- . (-) () , - , ( ) ( ) (R max - ). A equação de Van der Waltz desenha uma imagem muito semelhante, mas não explica o significado físico das forças de atração e repulsão, enquanto move sutilmente a zona de crescimento infinito assintótico da função para a zona inatingível do centro do átomo.O estado líquido de uma substância é o momento em que, com o aquecimento, os dipolos eletrostáticos já começaram a se repelir, mas essa repulsão ainda não é capaz de quebrar a ligação da atração magnética dos átomos. Como resultado, surge um pequeno espaço entre os átomos (g ”no gráfico do gráfico 1), o que leva a um aumento acentuado da mobilidade mútua de átomos na camada de“ lubrificante ”eletromagnético.A camada limite de gás sólido é formada sobre o contato de matéria sólida magneticamente acoplada com átomos de gás com tensão eletrostática. Os átomos de gás não podem se desprender de um sólido com coroa eletrostática não revelada de átomos e são pressionados contra uma superfície sólida. Assim, uma camada limite de átomos de gás é formada, pressionada contra a superfície de uma substância sólida. Nesse caso, a camada de gás limite ainda é capaz de repelir outros átomos de gás, uma vez que a camada de gás limite permanece estressada eletrostaticamente no grau necessário. Essa compressão da camada limite de gás (ar) em um metal sólido explica a aparência quase instantânea de óxidos metálicos na superfície. O contato adicional da camada limite do gás já é realizado com uma película protetora sólida de óxidos na superfície do metal,protege a camada subjacente de metal puro contra oxidação adicional.Modelagem de supostas arquiteturas estruturais de elementos químicos. No futuro, consideraremos os supostos modelos da estrutura dos núcleos de átomos de várias substâncias, onde a bola de metal com fortes propriedades magnéticas será o núcleo (núcleo, próton). A interação magnética dos núcleons atende ao critério da não centralidade da interação da força dos núcleons no núcleo e à saturação dessas forças quando os núcleons se aproximam, o que há muito tempo é assumido na física nuclear para fortes interações nucleares.Os ímãs modernos de terras raras têm uma força magnética muito alta, o que torna possível a construção de modelos plausíveis de estruturas atômicas, contando apenas com as forças magnéticas do Sharikov-Nuklonov segurando como parte de um único núcleo com uma arquitetura única. Nesse caso, as próprias forças magnéticas atuam como Critério-Controladores para cada modelo de núcleo, uma vez que longe de todas as combinações espaciais de esferas podem ser montadas de forma estável devido à atração e repulsão mútuas de esferas polarizadas.O modelo de cada átomo é montado a partir do número de núcleons especificado pela tabela periódica (incluindo todos os isótopos estáveis). Reconstruções de modelos são criadas a partir de esferas magnéticas de neodímio com um diâmetro de 5 mm. Atualmente, essas bolas magnéticas são vendidas como brinquedos de quebra-cabeça chamados Neocub, que incluem 216 bolas magnéticas do mesmo tamanho (peças de cubo 6x6x6).Com base nas características geométricas obtidas dos modelos de átomos de cada substância simples, tentaremos encontrar as conexões lógicas entre a forma do modelo de átomo e as propriedades da matéria real no nível macro.No estágio inicial de modelagem de estruturas nucleares, algumas regularidades foram reveladas. Assim, as bolas magnéticas tendem a se alinhar em correntes, e correntes longas o suficiente se prendem facilmente aos anéis. As estruturas magnéticas dos anéis acabam sendo muito fortes e estáveis, enquanto o campo magnético externo desses anéis diminui acentuadamente, uma vez que quase todas as linhas magnéticas de seus fluxos magnéticos separam os ímãs da esfera, que são fechados através das esferas vizinhas do anel do seu núcleo magnético (ver Fig. 5). Anéis do mesmo tamanho (número igual de esferas de núcleos) são capazes de se conectar facilmente, formando estruturas muito estáveis em forma de pilar que podem ser expandidas quase ilimitadamente ao longo do comprimento com novos anéis proporcionais (Fig. 6).Cadeias de esferas de nucleon podem ser conectadas em paralelo entre si em duas versões:
.1. () : (); (), () (''); - () (''); (). R- . (-) () , - , ( ) ( ) (R max - ). A equação de Van der Waltz desenha uma imagem muito semelhante, mas não explica o significado físico das forças de atração e repulsão, enquanto move sutilmente a zona de crescimento infinito assintótico da função para a zona inatingível do centro do átomo.O estado líquido de uma substância é o momento em que, com o aquecimento, os dipolos eletrostáticos já começaram a se repelir, mas essa repulsão ainda não é capaz de quebrar a ligação da atração magnética dos átomos. Como resultado, surge um pequeno espaço entre os átomos (g ”no gráfico do gráfico 1), o que leva a um aumento acentuado da mobilidade mútua de átomos na camada de“ lubrificante ”eletromagnético.A camada limite de gás sólido é formada sobre o contato de matéria sólida magneticamente acoplada com átomos de gás com tensão eletrostática. Os átomos de gás não podem se desprender de um sólido com coroa eletrostática não revelada de átomos e são pressionados contra uma superfície sólida. Assim, uma camada limite de átomos de gás é formada, pressionada contra a superfície de uma substância sólida. Nesse caso, a camada de gás limite ainda é capaz de repelir outros átomos de gás, uma vez que a camada de gás limite permanece estressada eletrostaticamente no grau necessário. Essa compressão da camada limite de gás (ar) em um metal sólido explica a aparência quase instantânea de óxidos metálicos na superfície. O contato adicional da camada limite do gás já é realizado com uma película protetora sólida de óxidos na superfície do metal,protege a camada subjacente de metal puro contra oxidação adicional.Modelagem de supostas arquiteturas estruturais de elementos químicos. No futuro, consideraremos os supostos modelos da estrutura dos núcleos de átomos de várias substâncias, onde a bola de metal com fortes propriedades magnéticas será o núcleo (núcleo, próton). A interação magnética dos núcleons atende ao critério da não centralidade da interação da força dos núcleons no núcleo e à saturação dessas forças quando os núcleons se aproximam, o que há muito tempo é assumido na física nuclear para fortes interações nucleares.Os ímãs modernos de terras raras têm uma força magnética muito alta, o que torna possível a construção de modelos plausíveis de estruturas atômicas, contando apenas com as forças magnéticas do Sharikov-Nuklonov segurando como parte de um único núcleo com uma arquitetura única. Nesse caso, as próprias forças magnéticas atuam como Critério-Controladores para cada modelo de núcleo, uma vez que longe de todas as combinações espaciais de esferas podem ser montadas de forma estável devido à atração e repulsão mútuas de esferas polarizadas.O modelo de cada átomo é montado a partir do número de núcleons especificado pela tabela periódica (incluindo todos os isótopos estáveis). Reconstruções de modelos são criadas a partir de esferas magnéticas de neodímio com um diâmetro de 5 mm. Atualmente, essas bolas magnéticas são vendidas como brinquedos de quebra-cabeça chamados Neocub, que incluem 216 bolas magnéticas do mesmo tamanho (peças de cubo 6x6x6).Com base nas características geométricas obtidas dos modelos de átomos de cada substância simples, tentaremos encontrar as conexões lógicas entre a forma do modelo de átomo e as propriedades da matéria real no nível macro.No estágio inicial de modelagem de estruturas nucleares, algumas regularidades foram reveladas. Assim, as bolas magnéticas tendem a se alinhar em correntes, e correntes longas o suficiente se prendem facilmente aos anéis. As estruturas magnéticas dos anéis acabam sendo muito fortes e estáveis, enquanto o campo magnético externo desses anéis diminui acentuadamente, uma vez que quase todas as linhas magnéticas de seus fluxos magnéticos separam os ímãs da esfera, que são fechados através das esferas vizinhas do anel do seu núcleo magnético (ver Fig. 5). Anéis do mesmo tamanho (número igual de esferas de núcleos) são capazes de se conectar facilmente, formando estruturas muito estáveis em forma de pilar que podem ser expandidas quase ilimitadamente ao longo do comprimento com novos anéis proporcionais (Fig. 6).Cadeias de esferas de nucleon podem ser conectadas em paralelo entre si em duas versões:- direções associadas de fluxos magnéticos
- direção contrária do fluxo magnético
A direção simultânea dos fluxos magnéticos fornece uma conexão mais durável e compacta das cadeias de esferas (as esferas estão localizadas nos vértices dos triângulos isósceles). Fluxos magnéticos opostos fazem com que as bolas se localizem no topo dos quadrados, o que proporciona um empacotamento menos denso e menos durável das esferas de nucleon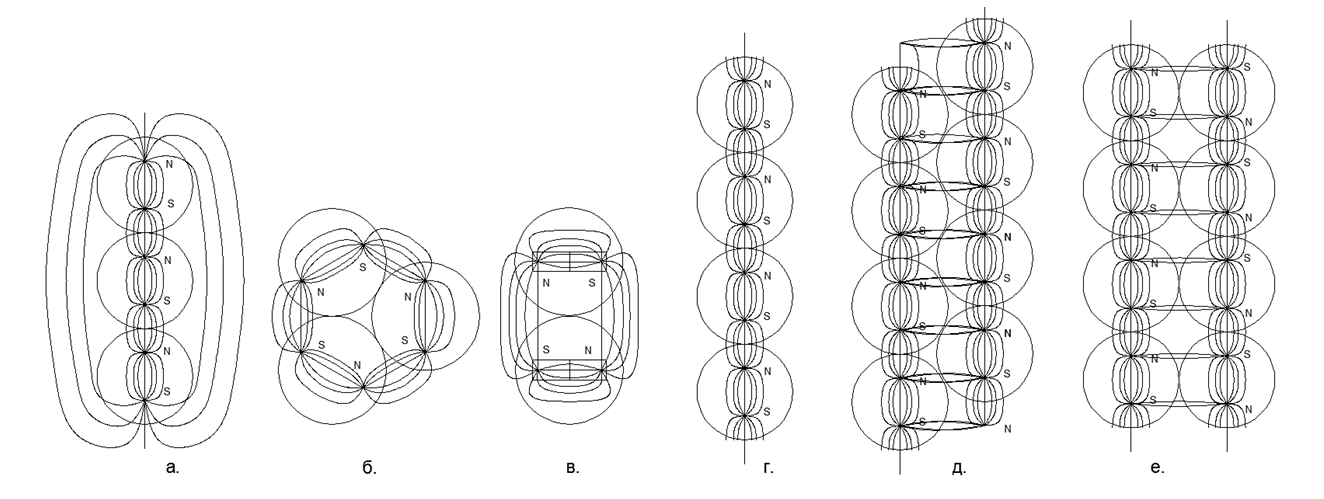 .5. :
.5. :
. 3- ();
. 3- ();
. 2- (), (.);
. - ;
. - , , ;
. - , , . .
 .6. 6- :
.6. 6- :
. ;
. .
- . 6- , .
.
Além de conectar anéis unidimensionais, é possível conectar anéis de tamanhos diferentes em várias combinações, fornecendo uma variedade de formas espaciais. É essa variedade de formas possíveis de conexão de estruturas magnéticas em anel e bolas magnéticas individuais que permite criar muitos modelos da arquitetura de núcleos com um número semelhante de núcleons, mas relacionados a diferentes substâncias com propriedades químicas e físicas radicalmente diferentes.Como você sabe, um único elemento químico pode corresponder a muitos isótopos com um número diferente de nêutrons na composição. Assim, as estruturas de átomos semelhantes a pilares de anéis com seis ou mais núcleons têm uma lacuna no centro, o que permite que núcleos adicionais sejam colocados dentro da coluna sem alterar a aparência do núcleo atômico. (Fig.6.b).Com base na versão proposta de atração magnética e repulsão eletrostática, pode-se supor que os metais incluam estruturas nucleares com um anel externo adicional de núcleons magneticamente acoplados no topo da coluna central dos anéis de núcleos unidimensionais (Fig. 7 - linha inferior). Essa suposição é baseada no fato de que o anel magnético externo não está carregado, aumentando assim o espaço entre a coluna interna eletricamente carregada ao se aproximar de outros átomos do mesmo tipo. Essa folga aumenta o ponto de ebulição e o ponto de fusão do metal e também cria uma área mais ampla para a zona de estado líquido.Substâncias que são gases sob condições normais, pelo contrário, devem ter um anel nucleon carregado no circuito externo, fornecendo repulsão eletrostática do mesmo tipo de átomos de gás, enquanto um grande número de nucleons pode ser colocado dentro do anel carregado, criando uma ampla série isotópica desse elemento.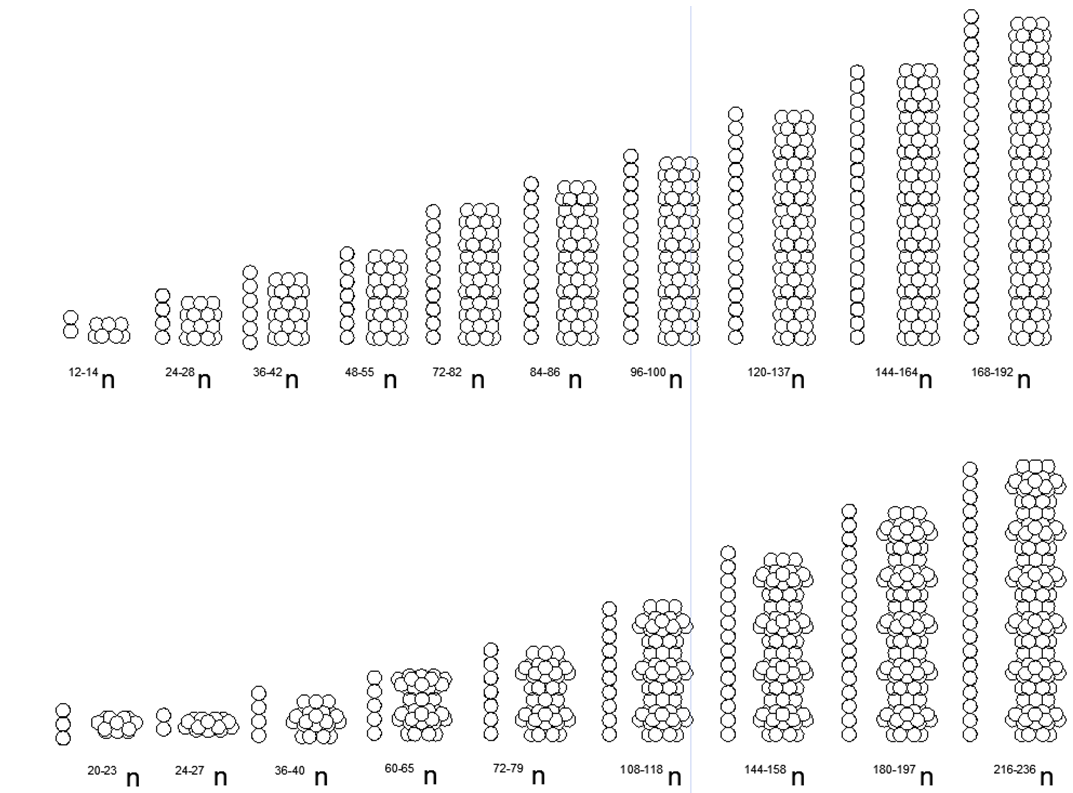 .7. - ( — ) ( - ) . , , . , , .
.7. - ( — ) ( - ) . , , . , , . 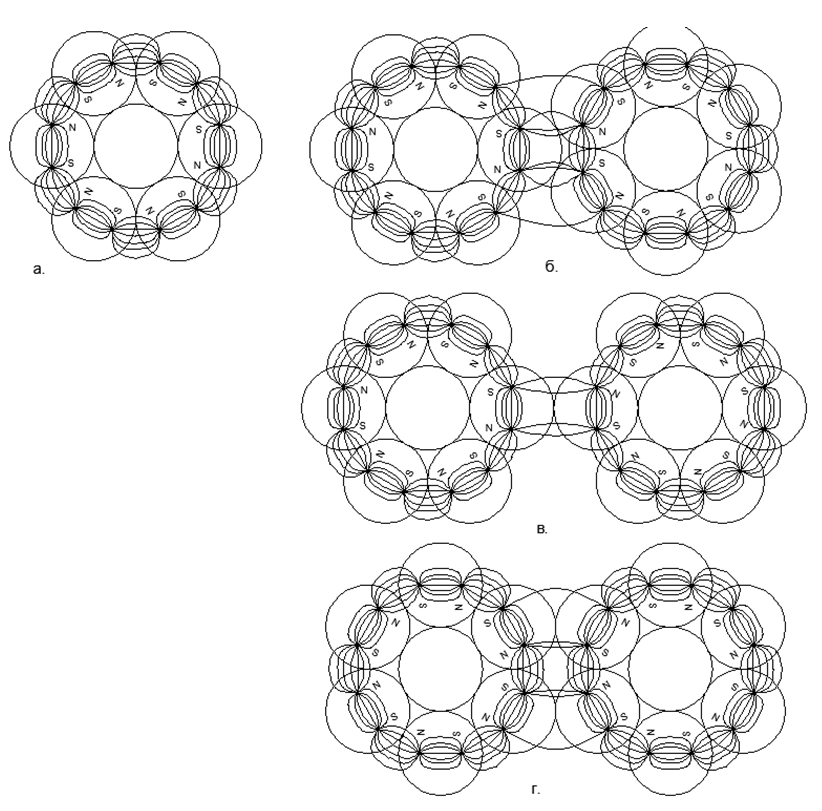 .8. «» :
.8. «» :
. 6- ;
. 6- , , ;
. 6- . , , , (.).
. 6- . , . 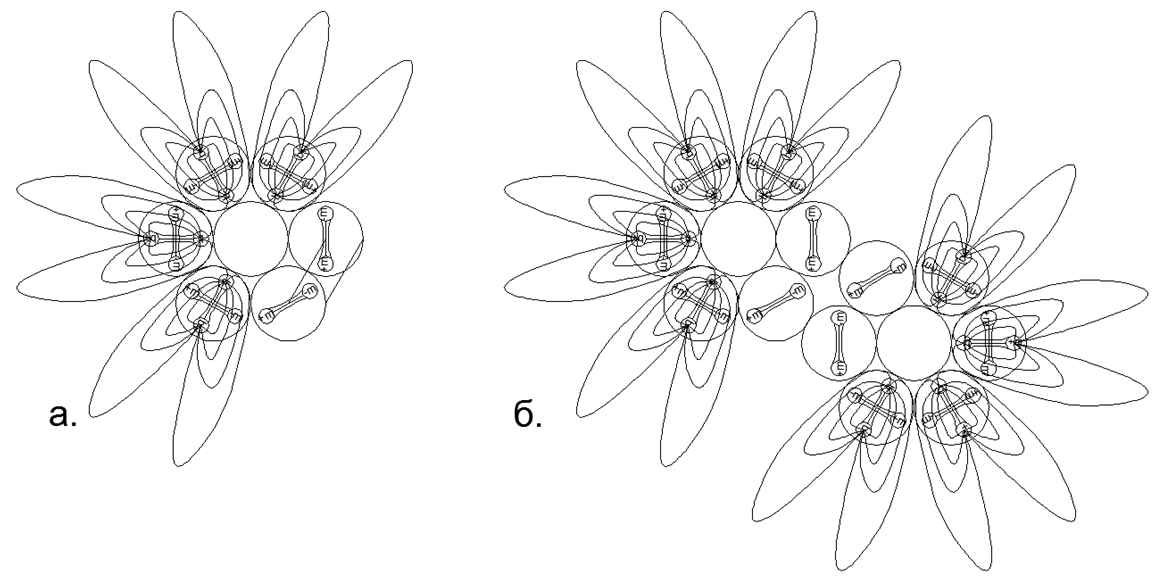 .9. ) , ( N2, 2 ..),; ) , .
.9. ) , ( N2, 2 ..),; ) , . -
A seguir, consideraremos em detalhes as estruturas de arquitetura de átomos mais prováveis de elementos individuais, com referência às peculiaridades de sua composição de núcleos e propriedades físicas conhecidas (densidade, resistência, Tplav, TPK, etc.).A seguir, é apresentada uma tabela de 1-2-3 períodos (curta) da tabela periódica, onde, em vez de um peso atômico fracionário, são indicados os pesos inteiros dos isótopos estáveis individuais encontrados na natureza (Tabela 2).Tab. 2. Pesos atômicos de isótopos estáveis de elementos químicos dos períodos 1-2-3rd da tabela periódica.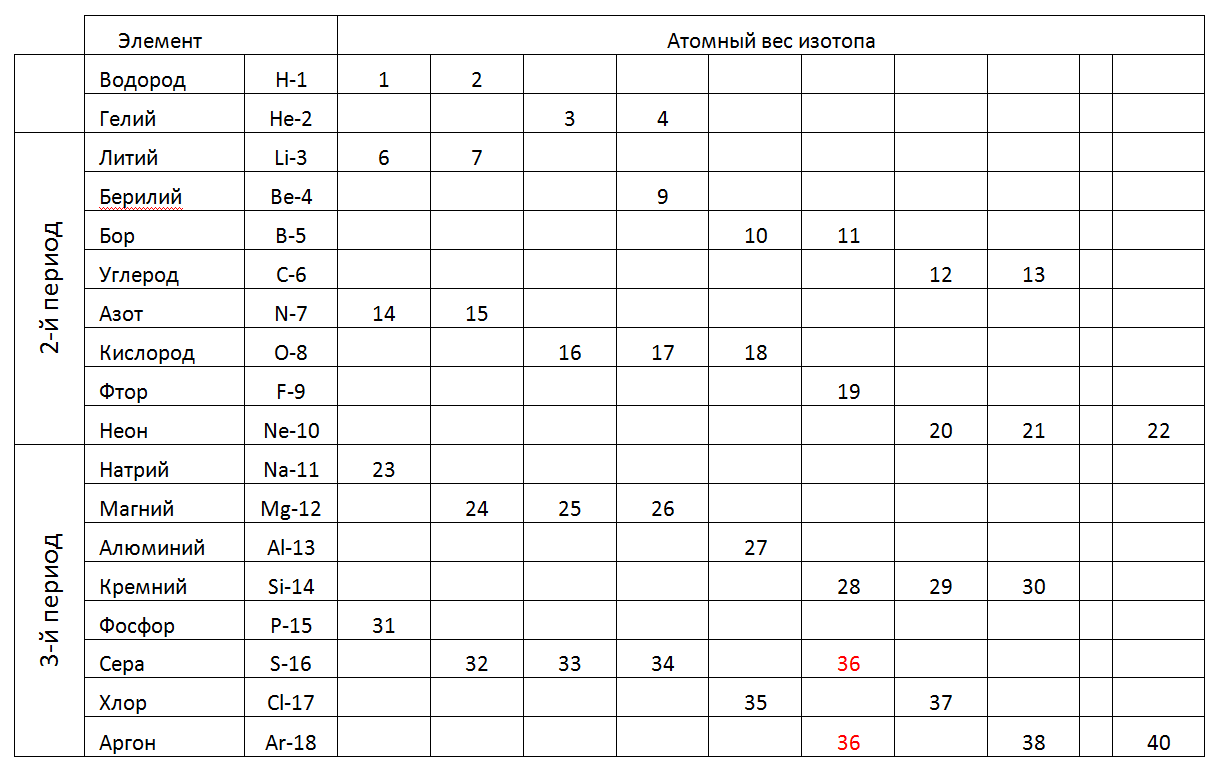 No 1º e no 2º período (a primeira linha completa da tabela), a tabela periódica contém elementos com um pequeno número de núcleons. Os átomos de tamanho pequeno desses períodos nos permitem considerar modelos espaciais que correspondem a formas únicas que podem definir a direção da construção de modelos atômicos para todos os períodos subsequentes (veja a Fig. 7). Além disso, a opção de simulação mais razoável pode ser considerada um aumento gradual no comprimento do anel Atom principal carregado, complementando-o com uma composição máxima de núcleos de núcleos externos (metálicos) e intra-anéis (não metálicos) de acordo com seu status químico e, em seguida, procure um análogo de acordo com a tabela de correspondências de núcleons de elementos químicos .
No 1º e no 2º período (a primeira linha completa da tabela), a tabela periódica contém elementos com um pequeno número de núcleons. Os átomos de tamanho pequeno desses períodos nos permitem considerar modelos espaciais que correspondem a formas únicas que podem definir a direção da construção de modelos atômicos para todos os períodos subsequentes (veja a Fig. 7). Além disso, a opção de simulação mais razoável pode ser considerada um aumento gradual no comprimento do anel Atom principal carregado, complementando-o com uma composição máxima de núcleos de núcleos externos (metálicos) e intra-anéis (não metálicos) de acordo com seu status químico e, em seguida, procure um análogo de acordo com a tabela de correspondências de núcleons de elementos químicos .1. Hidrogênio (11H) 1 próton (1p). A substância livre tem a forma H2.
Construir um átomo de hidrogênio não requer nenhum esforço, pois consiste simplesmente em uma bola de prótons. Devido ao fluxo magnético aberto, o hidrogênio monatômico é extremamente ativo, o que faz com que ele reaja com as substâncias livres mais próximas ou entre em contato com outros átomos de hidrogênio ao estado de um anel fechado estável.
Deutério (21D) 1 próton + 1 nêutron (1p + 1n) - a forma também é inequívoca na forma de duas bolas grudadas.
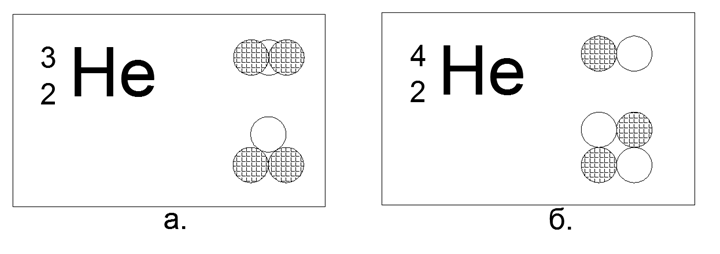
2. Hélio (42He) 2 prótons + 2 nêutrons (2p + 2n)
Para o Hélio, já é possível construir várias opções para modelos da estrutura do núcleo:
- Linear - quatro núcleons seguidos,
- Plano (quadrado) - quatro núcleons nos cantos de um quadrado plano,
- Espacial (Tetraédrico) - quatro núcleons nos cantos de um poliedro volumétrico-Tetraedro.
Nesse caso, das 4 esferas magnéticas, é possível construir apenas uma forma quadrada e plana do núcleo. A forma tetraédrica das forças magnéticas não se mantém, transformando-se imediatamente em um quadrado.
No futuro, focaremos apenas as formas espaciais de átomos, uma vez que variantes lineares em átomos mais massivos não serão capazes de fornecer nenhuma incorporação significativa.
Isótopo de hélio raro (32º) 2 prótons + 1 nêutron (2p + n)
Nesta configuração, apenas um triângulo plano é possível.
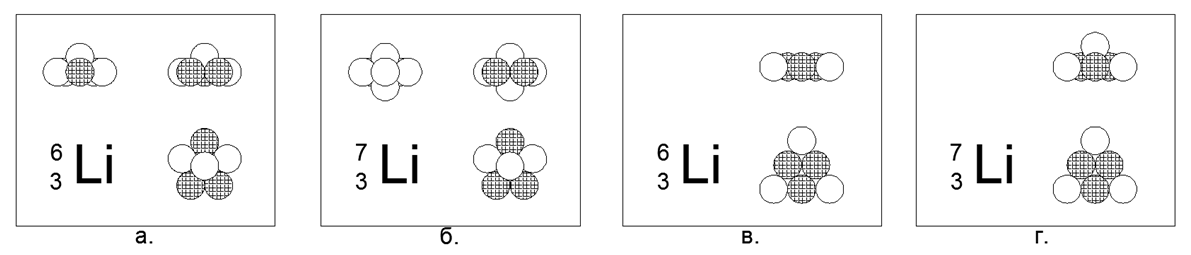
3. Núcleons de lítio (73Li) -7 (3p + 4n)
Para o lítio, é possível criar um modelo plano e tridimensional do átomo.
O modelo plano é um hexágono com um núcleo no centro. O modelo de volume é um pentágono plano com duas esferas nos pólos (os pólos são pontos nas extremidades do eixo de rotação da parte axissimétrica principal do modelo de núcleo atômico). Ambos os modelos têm simetria pronunciada em forma de estrela. Metal de lítio, muito leve (0,534g / cm3), com fusão relativamente baixa (Tm = 454K). O raro isótopo estável Núcleo de lítio (63Li) -6 (3p + 3n) pode ser modelado em ambas as formas, portanto, a escolha a favor de qualquer modelo não pode ser feita.
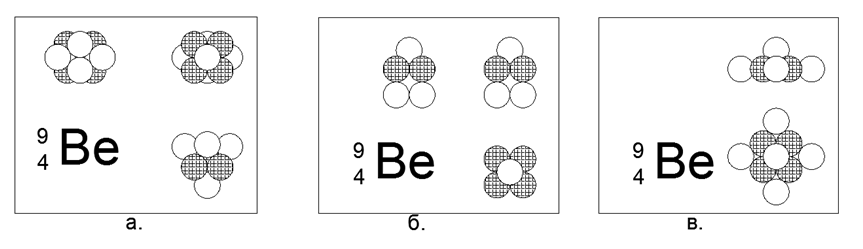
4. Berílio (94Be) - 9 núcleons (4p + 5n).
O único isótopo estável de longa duração. Existe um isótopo relativamente duradouro, Berílio (104Be) - 10 núcleons (4p + 6n) com meia-vida de 1,4 bilhão de anos. Muitas implementações são possíveis. A forma mais estável e compacta das sensações parece uma forma de estrela de dois triângulos conectados por planos em um prisma, onde uma bola é encaixada nas faces laterais do prisma triangular. O berílio é um metal leve (1,848 g / cm3), relativamente refratário (Tm = 1551K). No futuro, a forma STAR será rastreada na maioria dos metais. Quando a 10ª bola é adicionada à estrutura resultante, a própria forma é modificada para outra forma em estrela, mas assimétrica no plano. A nova forma pode ser descrita como uma estrela de seis pontas com um centro preenchido, para o plano lateral do qual um triângulo de esferas de núcleos ancorou. Ao olhar ao longo do eixo da "estrela" em ambas as formas dos isótopos de berílio, uma estrela de três pontas de um tipo é claramente visível, o que determina as propriedades externas básicas da matéria simples.
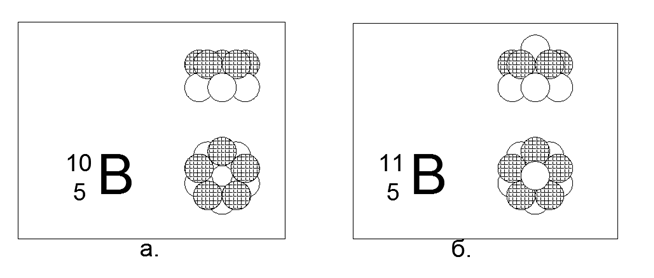
5. Boro (115Be) - 11 núcleons (5p + 6n).
Isótopos estáveis de longa duração 10B e 11B. A configuração espacial 10B consiste em dois anéis pentagonais conectados em paralelo na direção simultânea ou oposta do fluxo magnético. A configuração espacial 11B segue a estrutura de 10B, apenas um nêutron é adicionado ao longo do eixo dos anéis.
Assim, pode-se supor que o não-metal difere do metal em sua forma externa principal: o não-metal é um cilindro de anéis do mesmo tipo, o metal é uma certa forma em forma de estrela (em forma de disco).
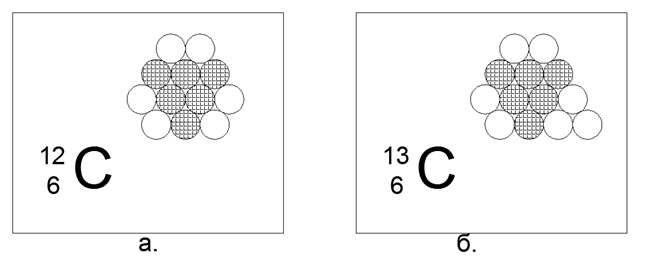
6. Carbono (126) - 12 núcleons (6p + 6n).
Isótopos estáveis de longa duração 12º (98,93%) e 13º (1,07%), bem como 14º radioativo. Um elemento extremamente interessante, que é muito difundido e possui uma variedade infinita de formas estruturais na natureza (grafite, diamante, carvão, fuligem, nanoestruturas-fulerenos, etc.) Esse conteúdo de forma requer uma estrutura de 12 esferas de algumas propriedades especiais incríveis. Tal estrutura pode vir a ser um hexágono plano não equilateral com três esferas no centro.
Os núcleons carregados estão dispostos em um triângulo, nos lados dos quais três pares de nêutrons estão ligados. O resultado é uma simetria de três feixes, onde nos eixos de simetria existem nêutrons externos, prontos para a conexão magnética de outros átomos. Camadas de grafite, ou a superfície de nanotubos e estruturas a granel de estruturas fechadas de fulerenos, são facilmente dispostas a partir desses hexágonos.
 Fig. Vista de uma camada de grafeno (grafite) composta por átomos de carbono hexagonais planares C12.
Fig. Vista de uma camada de grafeno (grafite) composta por átomos de carbono hexagonais planares C12.Entre os não metais, as substâncias que são gases em condições normais são especialmente diferenciadas. São gases monoatômicos inertes (nobres), nitrogênio e oxigênio atmosféricos diatômicos e o halogênio diatômico ativo flúor.
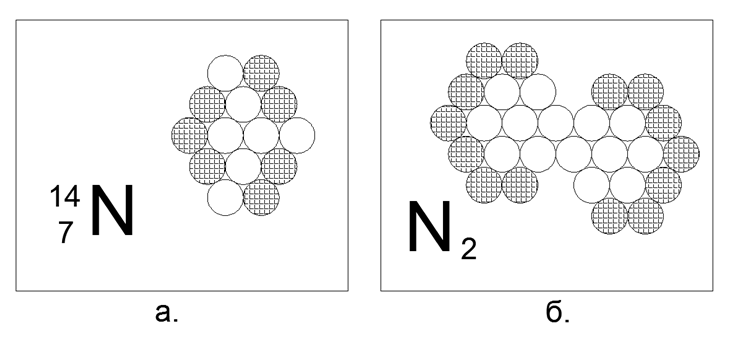
7. Nitrogênio (147N) - 14 núcleons (7p + 7n).
Isótopos estáveis de longa duração 14N e 15N. Em estado livre, em condições normais, o nitrogênio é um gás diatômico, com atividade extremamente pequena. A atmosfera do nosso planeta é 78% de nitrogênio. Possuir a propriedade de gás sob N.u. o átomo requer a presença de núcleons carregados no perímetro externo, sem quebras nos nêutrons emparelhados. Mas como o gás é apenas uma molécula diatômica, significa que na estrutura do átomo há uma região magneticamente ativa de dois ou três nêutrons seguidos no limite externo, pelo qual os átomos de nitrogênio estão ligados à molécula de N2. Essa forma de 14 átomos é facilmente montada na forma de um hexágono não equilateral, semelhante a um losango, onde o gráfico com três nêutrons seguidos no perímetro externo do átomo é realmente natural. A ligação na molécula de N2 é tão forte que o gás permanece no estado molecular, mesmo a 5000 graus C.
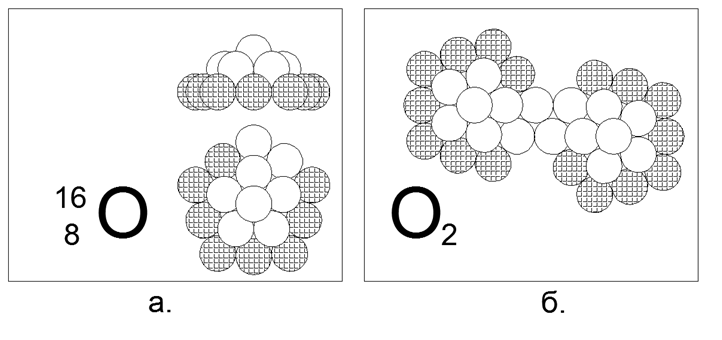
8. Oxigênio (168O) - 16 núcleons (8p + 8n).
Isótopos estáveis de longa duração 17 e 18. A forma assumida do isótopo 16 mais comum (99,7%) é um 5-gon de dez núcleons (8 carregados, 2 neutros), com um gap de contato neutro-magnético magnético pronunciado no anel externo de dez átomos. O revestimento interno consiste em um anel de 5 núcleos com um décimo sexto núcleo adicional no centro. Os anéis de 10 e 5 núcleons não podem ser unidos no plano e, portanto, criam uma forma espacial em forma de cúpula. Isótopos são criados capturando nêutrons adicionais no centro sob o "domo". A presença de um gap externo de dois núcleos no anel garante a criação de uma molécula diatômica de O2. A força de ligação dentro da molécula de O2 é muito mais fraca que a do nitrogênio e, portanto, o oxigênio é muito mais ativo e entra na reação de oxidação (combustão) a temperaturas razoavelmente baixas.
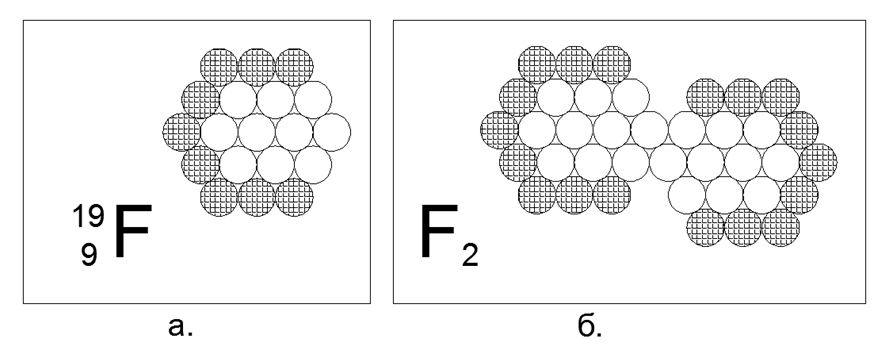
9. Flúor (199F) - 19 nucleons (9p + 10n).
Existe apenas um isótopo estável, instável ao vivo de frações de segundos a unidades de horas. A forma assumida da estrutura: um hexágono plano de anéis de 12 e 6 núcleos aninhados e um 19 de núcleo no centro. A falta de núcleons carregados no anel externo cria uma região de atração magnética de três núcleons neutros, o que possibilita a criação de uma molécula diatômica F2, após a qual a substância exibe propriedades de gás em condições normais. O gás criogênico do flúor-2, ou seja, ele se torna líquido apenas em temperaturas extremamente baixas (85K ou -188C), o que o torna semelhante às propriedades dos dois gases diatômicos anteriores.
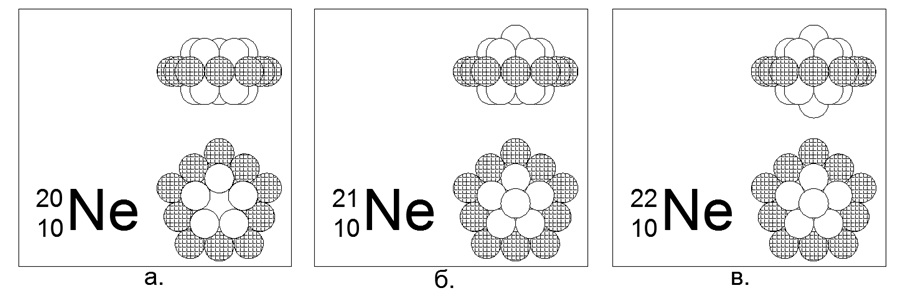
10. Neon (2010He) - conteúdo de 20 nucleons (10p + 10n) na natureza de 90,47%.
Isótopos estáveis de longa duração 21He (9,25%) e 22He (0,27%). Estrutura estimada do núcleo: anel externo carregado de 10 núcleos mais dois anéis internos de 5 núcleos aninhados.
Os isótopos 21 e 22 são criados adicionando um núcleo ao centro de um dos 5 anéis do núcleo ao longo do eixo.
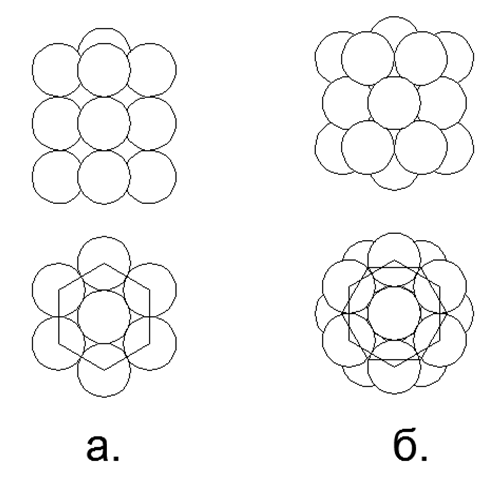
Na Tabela 1, substâncias com um único isótopo estável são de grande interesse, pois sua estrutura única não deve permitir a absorção de núcleos adicionais sem introduzir distorções na forma externa. Tais substâncias incluem metais de berílio-9 (Fig. 7) e sódio-23 (Fig. 6), alumínio-27, bem como flúor não metálico-19, fósforo-31.
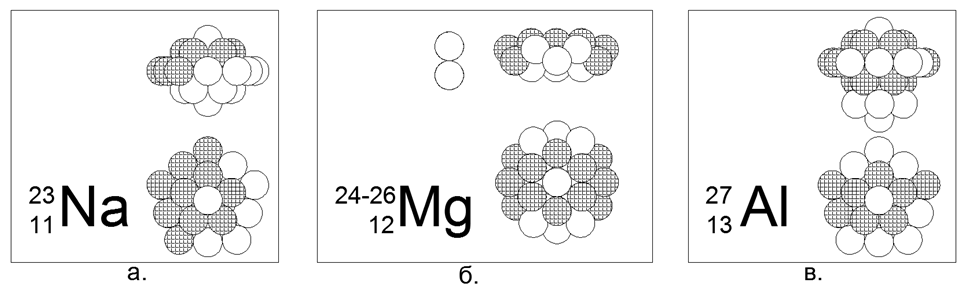
11. Sódio (2311Na) - 23 núcleons (11p + 12n) - Este é o único isótopo estável na natureza, o que nos permite escolher uma configuração única de núcleos para ele.
Das 23 bolas, foi possível criar apenas uma versão de uma estrutura magneticamente estável simétrica densa de uma forma de disco estelar. Um anel de 10 núcleons é enrolado em torno da parte central de dois anéis de 5 núcleos presos por planos. Dentro da parte central entre os dois anéis de 5 núcleos, é dirigido um 21º núcleo central. Mais um núcleo (22 e 23) está conectado aos lados da parte central ao longo do eixo central. Em geral, o núcleo se assemelha a um yule na forma de lentilhas convexas. Devido ao fato de que os anéis de 5 e 10 núcleos não podem se alinhar em um plano, a forma do anel de 10 núcleos assume uma forma em zigue-zague, enquanto os anéis internos de 5 núcleos estão ligeiramente afastados, o que permite 21 nucleon.
12. Magnésio (12Mg) - 24, 25, 26 núcleons.
Os isótopos têm uma prevalência de 78,6% - 10,1% -11,3%, respectivamente. Assim, é óbvio que a forma principal é uma estrutura em forma de disco de dois anéis de 6 núcleos na parte central e um anel de 12 núcleos enrolado. Os isótopos são criados dirigindo um ou dois nêutrons para dentro do tubo central do disco, que no anel de 6 núcleos corresponde exatamente ao tamanho da bola de núcleos.
13. Alumínio (2713Al) - 27 núcleons (13p + 14n) - Este é o único isótopo estável na natureza, que permite escolher uma configuração única de núcleos para ele.
Das 27 esferas, uma versão axissimétrica da estrutura densa magneticamente estável de uma forma de disco estelar com uma multiplicidade de anéis de 5 núcleos foi criada: um pilar central de três anéis de 5 núcleos e um anel externo de 10 núcleos e dois núcleos nas extremidades do tubo central completam o quadro. Os isótopos 28 e 29 têm meia-vida de 2 e 6 minutos, respectivamente. Isótopo 26 - tem T1 / 2 = 717 mil anos., E naturalmente decai em magnésio estável-26 por captura de elétrons (captura beta). A síntese contínua de Al-26 ocorre na atmosfera durante a colisão de prótons rápidos cósmicos com átomos de argônio.

14. Silício (14Si) - 28, 29, 30 núcleons.
Os isótopos têm uma prevalência de 92,2% - 4,7% -3,1%, respectivamente. O silício não é metal. Sob condições normais, o silício existe em várias formas, e todas são sólidas. Na forma cristalina, o silício é um semicondutor, o que o torna semelhante ao carbono do período anterior.
Para 28 núcleons, não havia formas regulares de uma linha cilíndrica, o que possibilitou a busca de um possível modelo de átomo em uma série de placas poliédricas, como carbono e nitrogênio. Assim, 28 núcleons são obtidos a partir de dois átomos de nitrogênio hexagonais planares conectados por planos.
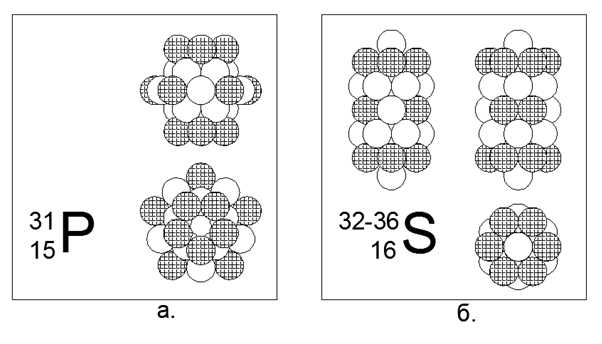
15. Fósforo (3115P) - 31 nucleões.
O único isótopo estável. Não metálico. Estrutura estimada: Quatro anéis de 5 núcleos no tubo central e um anel externo de 10 núcleos no meio do tubo central, que fornece 30 núcleos e 31 núcleons são conduzidos para o centro do anel de 10 núcleos, onde uma cavidade surge devido ao encaixe não plano 10 Anéis de 5 e 5 nucleões. As cargas estão localizadas em 5 peças nas extremidades do tubo central e mais cinco uniformemente em torno do anel externo de 10 núcleos.
16. Enxofre (16S) - possui quatro isótopos estáveis 32, 33, 34 e 36 núcleons.
Os isótopos têm uma prevalência de 95,013% - 0,75% -4,215% -0,017%, respectivamente. O enxofre não é metal. Assumimos que a forma principal é uma estrutura cilíndrica de cinco pedaços de 6 anéis de núcleos, no túnel central do qual são colocados núcleons isotópicos adicionais. Para o raro isótopo do enxofre-36, a estrutura se torna obscura, pois dois núcleons adicionais quase não cabem no interior do tubo central. O enxofre-36 não apenas preenche completamente o tubo interno do cilindro, como também se destaca com núcleons além das bordas da parte externa cilíndrica. Essa configuração fornece propriedades tipicamente não metálicas da substância, ou seja, com pontos de fusão e ebulição relativamente moderados próximos às condições normais.
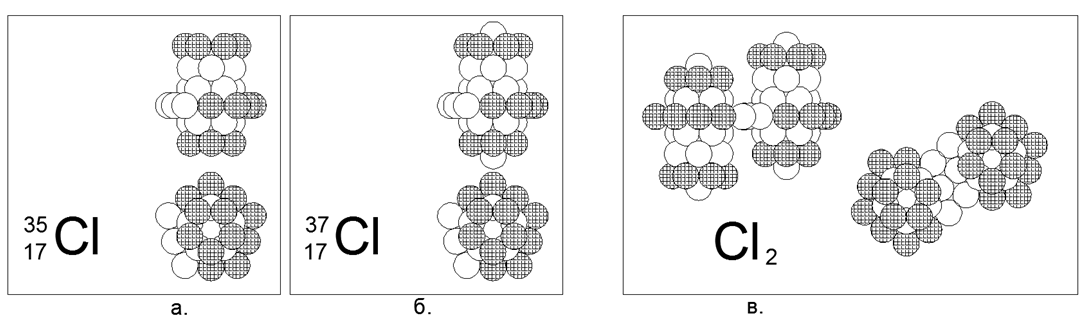
17. Cloro (17Cl) - possui dois isótopos estáveis de 35 e 37 nucleons.
Os isótopos têm uma prevalência de 75% e 25%, respectivamente. O cloro é um gás não metálico e diatômico em condições normais. Assumimos que a forma principal do gás é um anel de 10 núcleos com carga incompleta e uma estrutura cilíndrica aninhada de três anéis de 5 núcleos ao longo do eixo em que os anéis terminais do tubo estão totalmente carregados. Para o isótopo pesado Chlor-37, um nucleon é adicionalmente ligado às extremidades do cilindro principal. O cloro-36 é radioativo com T1 / 2 = 301 mil anos. O Cloro-36 Instável é possível tanto na versão com um nucleon na extremidade aberta do tubo central quanto com um anel de 10 nucleons acionado no centro. Com a proximidade dos números de massa de cloro e enxofre, que mesmo existem interseções mútuas dos números de isótopos (isobares), a estrutura do núcleo acaba sendo fundamentalmente diferente. A diferença na estrutura do núcleo também se reflete na forte diferença nas propriedades químicas e físicas.
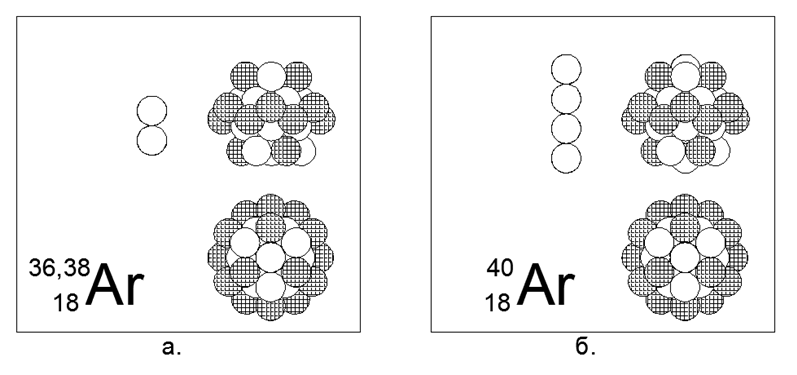
18. Argônio (18Ar) - possui três isótopos estáveis 36, 38 e 40 núcleons.
Os isótopos na Terra têm uma prevalência de 0,337% - 0,063% -99,6%, respectivamente, embora a distribuição no espaço seja completamente diferente. Na Terra, todo o argônio-40 é derivado do potássio-40 radioativo em decomposição. Argônio é um gás inerte. Pode-se presumir que a forma principal é uma estrutura cilíndrica de quatro peças de 6 anéis de núcleos, no túnel central do qual são colocados 2 ou 4 núcleons adicionais de isótopos maciços, e um anel totalmente carregado de 12 núcleos é colocado no topo do tubo central. Um anel externo totalmente carregado similar é uma característica dos gases inertes, de acordo com o modelo teórico desenvolvido do núcleo atômico.
O argônio-36 é um isobar do enxofre-36 (o segundo par na tabela periódica), mas as estruturas da forma principal são significativamente diferentes. Pode-se supor que um dos seguintes metais alcalinos, ou seja, potássio ou cálcio, ficará próximo ao argônio na estrutura do núcleo.
Totais.
O aumento gradual da massa atômica com um aumento linear no número de núcleons carregados de acordo com a tabela periódica permitiu construir uma série consistente de soluções estruturais das estruturas-arquiteturas atômicas de elementos químicos relacionados às suas propriedades físicas e químicas. Modelos de átomos-núcleos de elementos como requisito obrigatório incluem a capacidade de construir todos os isótopos estáveis sem mudanças radicais na forma do átomo.
A principal conclusão obtida nesta fase é a seguinte ideia:
Apesar da diferença nas propriedades químicas das substâncias localizadas de perto na tabela (por exemplo: Gás inerte e o metal alcalino a seguir), elas diferem estruturalmente apenas na localização dos núcleons carregados no perímetro externo do átomo ou nas fileiras internas. Assim, uma mudança periódica nas propriedades está associada a uma transição suave da concentração de núcleons carregados da zona interna do núcleo para a externa.