
De que escritório em qualquer hospital as crianças e, às vezes, os adultos gritam de vez em quando? Que pais, descaradamente nos enganando na infância, em comparação com uma picada de mosquito? Eu acho que você já adivinhou que isso é um exame de sangue. Agora, esse procedimento se tornou mais rápido e menos doloroso. Uma coisa não mudou - sua importância. O diagnóstico em medicina desempenha o papel mais importante nos estágios iniciais da luta contra uma doença. Afinal, para derrotar uma doença, ela deve primeiro ser descoberta. Tendo sobrevivido ao procedimento de amostragem de sangue para análise, você calmamente espera pelos resultados. Atualmente, nos laboratórios, pessoas que usam dispositivos complexos, volumosos e muito caros analisam seu sangue, descobrindo o que está nele e em que quantidade. É bom ter esse laboratório no hospital local, mas nem sempre é esse o caso. Mas e se houvesse um laboratório de bolso, pequeno e barato, mas ao mesmo tempo analisando amostras com a mesma precisão e eficiência de um laboratório comum? Parece ficção científica, certo? A frase "analisador de açúcar no sangue de bolso" em seu tempo também parecia futurista. Hoje conheceremos a pesquisa e implementação da tecnologia para análise quantitativa de proteínas e aminoácidos através de um novo tipo de dispositivo compacto. Em que consiste esse milagre, como funciona e qual a eficácia? Receberemos respostas para essas e outras perguntas no relatório dos cientistas. Vamos lá
Base de estudo
Vivemos na era da tecnologia digital, que está sendo implementada com sucesso em várias áreas de nossas vidas. Estudos de laboratório (diagnóstico) não são excepção. Os cientistas observam que a análise de gotejamento digital é 1000 vezes mais precisa que a tradicional e permite que milhões de análises sejam realizadas em paralelo dentro de uma única gota de uma amostra com um volume medido em femtolitros (fl, 1 fl = 10
-15 L).
O uso da análise digital é extremamente útil para detectar ácidos nucleicos e proteínas, analisar células individuais e até exossomos.
Exossomos * - vesículas extracelulares (diâmetro: 30-100 nm), que são secretadas pelas células no espaço intercelular. Os exossomos estão envolvidos no trabalho de imunidade, secreção de proteínas, etc.
No momento, os métodos de análise digital mais famosos são o dELISA (ensaio imunossorvente digital ligado a enzima / DIA) e o qPCR (reação em cadeia da polimerase digital). Essas técnicas permitem trabalhar com células individuais, obtendo resultados muito precisos que não exigem correção. Recentemente, usando esses métodos, foi realizada uma análise quantitativa bem-sucedida de proteína e mRNA em uma célula ao mesmo tempo.
Técnicas semelhantes e uma demonstração de seus talentos mostram mais uma vez que a implementação de análises paralelas em um ambiente extremamente pequeno (amostra) é bastante possível. No entanto, como qualquer outra tecnologia, esses métodos também apresentam desvantagens. São bastante triviais - dimensões, preço e complexidade de fabricação. Os pesquisadores lembram que uma instalação para um amplificador digital (Simoa da Quanterix) custa cerca de US $ 100.000. E nem toda clínica privada pode pagar tal quantia, já estou em silêncio sobre as estaduais.
É claro que o Simoa deste "animal" de Quanterix é muito poderoso, se exagerado. Ele usa comprimidos com microcélulas com 200.000 células de 40 fl cada.
 Simoa de Quanterix
Simoa de QuanterixAo mesmo tempo, este dispositivo pode processar em paralelo até 4 comprimidos ELISA de 96 células cada. Assim, um dispositivo é capaz de produzir os resultados de 66 amostras dentro de uma hora, cada uma das quais pode ser submetida a uma análise de 10 plex (isto é, uma amostra é analisada para 10 indicadores de cada vez). Os números são realmente incríveis. Mas, novamente, surge a questão do preço e das dimensões de uma tal máquina de milagre.
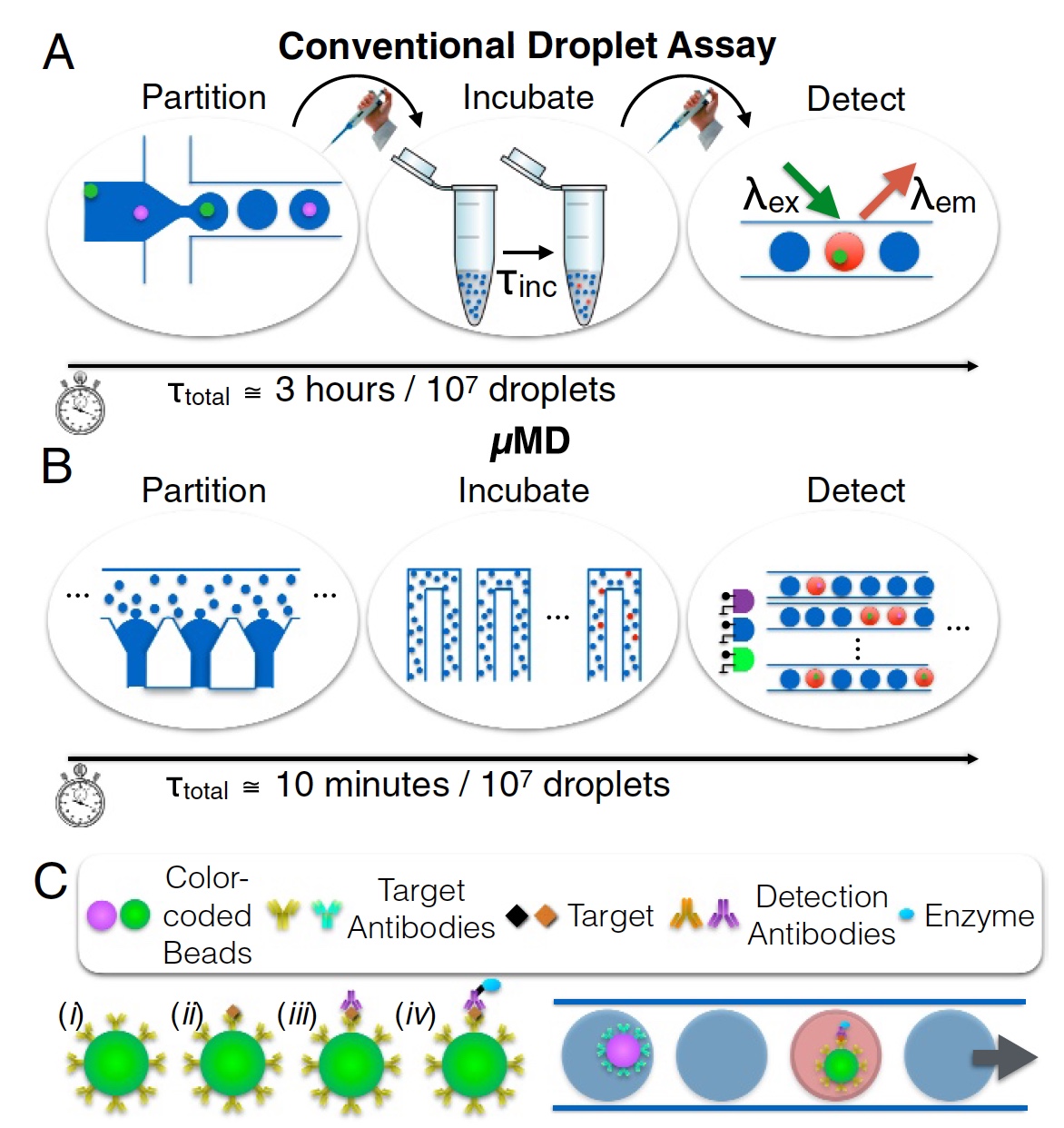 Imagem Nº 1
Imagem Nº 1E aqui, os cientistas propõem voltar os olhos para os sistemas de gotículas microfluídicas. Sistemas clássicos desse tipo não podem se orgulhar de um desempenho colossal, o Simoa da Quanterix, no entanto, eles podem servir de base para um novo dispositivo. A técnica de gotículas microfluídicas de fluxo contínuo pode teoricamente analisar até 1 milhão de células. No entanto, na prática, esses indicadores ainda não foram alcançados por várias razões. Em primeiro lugar, a taxa de transferência (menos de 104 gotas por segundo), quando as gotas são geradas seqüencialmente (não em paralelo) e são monodispersas. Em segundo lugar, a detecção da fluorescência de cada gota é realizada passando-as uma de cada vez através de um ponto de laser. Em outras palavras, tudo está alinhado, um de cada vez. Este processo é mostrado na imagem
1a (separação, incubação e determinação; 3 horas para análise de 10
7 gotas).
Os principais problemas da conversão desse método para um formato compacto são a dificuldade de paralelização óptica para detecção multicolorida de fluorescência, a complexidade de integrar o processo de preparação de amostras e a necessidade de certas ferramentas para gerar fluxos de gotículas estritamente controlados. No entanto, os cientistas não estão acostumados a desistir diante das dificuldades, por mais impressionantes que sejam.
O Detector Megascale de micro-gotas (MD, detector macro) é a criação de nossos heróis hoje. Este dispositivo não só pode ser implementado em qualquer dispositivo móvel (de bolso), mas também atende aos padrões de análise quantitativa de laboratórios comuns de tamanho normal. O processo é mostrado na imagem
1b (separação, incubação e determinação; 10 minutos para análise de 10
7 gotas).
Para isso, segundo os pesquisadores, três tarefas principais foram implementadas:
- Em vez de gerar 1 gota cada, foi usada geração paralela de gotículas microfluídicas, trabalhando 100 vezes mais rápido. E as realizações de colegas cientistas no campo da produção de gotas monodispersas ( link para este estudo ) tornaram possível livrar-se da dependência da monodispersão das gotas na vazão. Isso permite o uso de bombas peristálticas muito baratas que podem ser integradas a um dispositivo móvel (portátil).
- A leitura rápida da fluorescência das gotículas a uma velocidade superior a 105 por segundo (lembre-se do limite de 104, que mencionei acima) foi alcançada graças à visualização baseada em um telefone celular, que é 100 vezes mais rápido que a leitura convencional (quando as gotas são lidas por sua vez). Nesse caso, não há necessidade de óticas caras, e a implementação em dispositivos móveis portáteis é óbvia. A principal característica distintiva dessa inovação é a capacidade de superar as limitações da baixa taxa de quadros de uma imagem digital e fornecer detecção de fluorescência multicolorida modulando várias fontes de excitação de LEDs ou diodos laser de cores diferentes com sinais não periódicos exclusivos. O vídeo pode ser decodificado para obter dados de fluorescência de gotículas, superando os limites da taxa de quadros da câmera. Assim, é possível atingir os mesmos (mencionados anteriormente) de 1 milhão de gotas por segundo.
- E, finalmente, a integração de uma unidade de processamento de microgrânulos (ou microesferas, objetos esféricos microscópicos), um gerador de gotículas, linhas de atraso de sinal para incubação de gotículas e um detector de fluorescência. Em conjunto, isso fornece um dispositivo barato, compacto e eficiente para a entrada de soro não tratado (amostra) e a saída de dados moleculares (resultado).
Como demonstração de sua invenção, os cientistas implementaram um DIGA multiplexado usando microgrânulos de cores diferentes, obtidos a partir de corantes fluorescentes. Cada cor é o "código" de cor da proteína a que o anticorpo de microesferas é direcionado (
1c ).
Uma análise multiplex de GM-CSF e IL6 sérico no soro foi realizada usando grânulos fluorescentes ultravioleta e verde, quando as gotas continham um microgrânulo com um imunocomplexo vermelho fluorescente. O soro bovino foi utilizado como meio para a análise quantitativa, e a limitação da determinação foi de 0,004 pg / ml (picograma por mililitro, 1 pg =
10-12 g). Isso é 1000 vezes mais preciso que o ELISA padrão e corresponde ao nível de precisão do ELISA digital.
Leva apenas 10 minutos para processar 10 milhões de gotas. Nesse caso, o próprio processo inclui a geração e incubação de gotas, bem como a detecção de gotas fluorescentes para cada amostra.
Estrutura do dispositivo e processo de análise
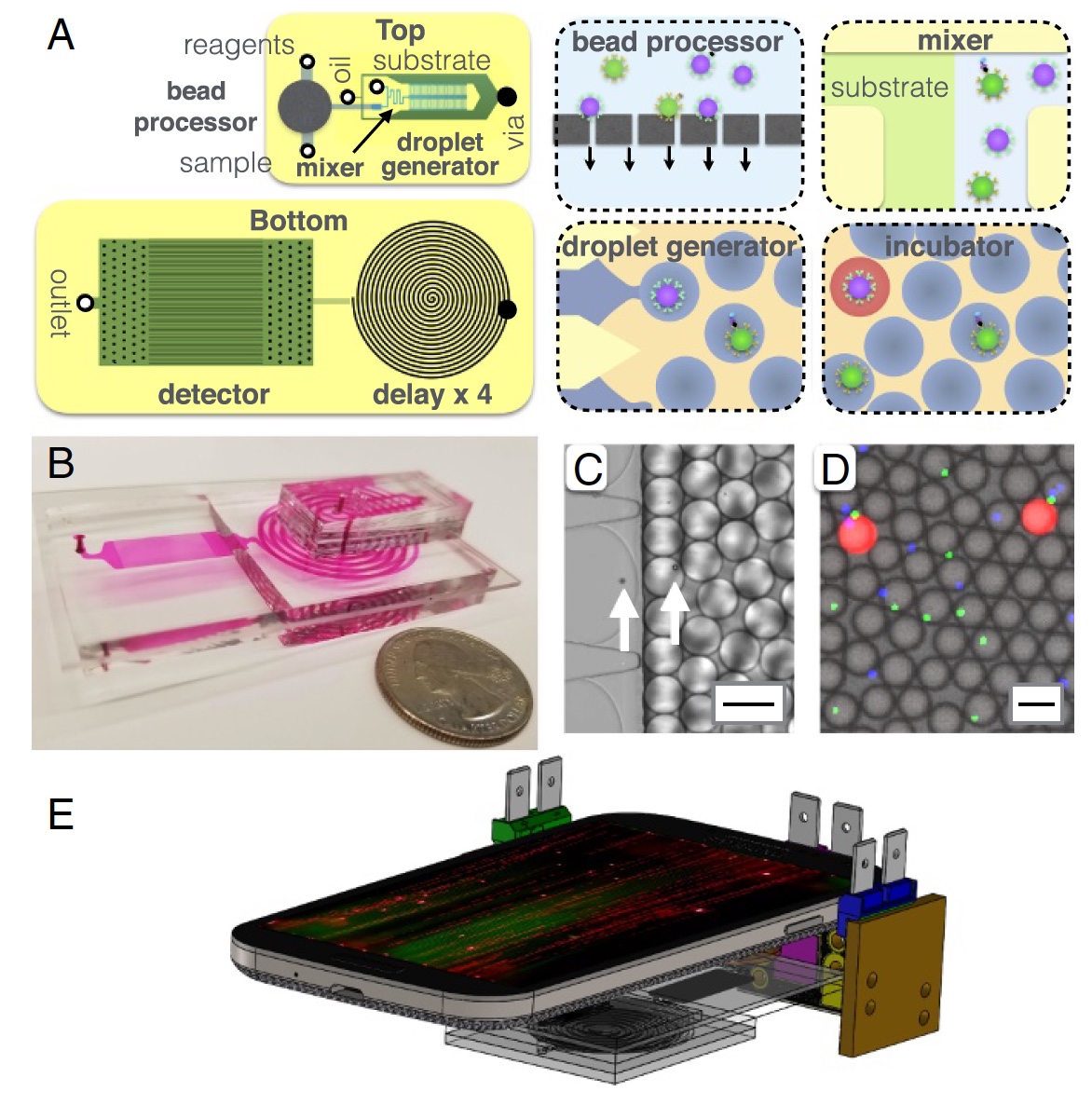 Imagem 2: estrutura do dispositivo MD.
Imagem 2: estrutura do dispositivo MD.Um pouco mais sobre a imagem acima:
2a - diagrama de chips, vista superior e inferior;
2b é uma foto de um chip MD em que todos os canais de optofluido são visíveis;
2c é uma micrografia do processo de encapsular microesferas em gotículas com um diâmetro de 40 μm;
2d é uma micrografia de fluorescência de gotas após uma linha de atraso;
2e é uma representação esquemática de uma plataforma MD (telefone celular, 3 fontes de luz e o próprio chip MD).
Os principais componentes do MD podem ser chamados de processador de microgrânulos, onde os últimos capturam proteínas-alvo do soro. Depois disso, os grânulos são marcados com imunocomplexos para posterior amplificação dentro das gotículas. Entre cada um desses processos, ocorre uma limpeza iterativa (várias vezes). Também está presente um gerador de gotículas, onde os microgrânulos são misturados com um substrato enzimático e encapsulados em gotículas de água e óleo.
Em seguida, vem um canal microfluídico através do qual as gotículas passam por 3,2 minutos. Esse canal é necessário como atraso / desaceleração do processo, o que permite amplificar enzimaticamente o sinal fluorescente. A parte final é um detector (ou scanner) baseado em um telefone celular (câmera), onde é detectada a fluorescência de gotículas.
O processador de microgrânulos consiste em uma membrana semipermeável para imobilizar os grânulos. Vários reagentes e tampões de lavagem são entregues aos grânulos imobilizados. Depois disso, os grânulos são liberados para análise posterior.
A membrana em si é feita de policarbonato. Uma trilha gravada com 300 mm
2 com poros de 3 μm de diâmetro foi gravada na membrana.
Nesta experiência, havia dois grupos de microgrânulos: (d = 5,4 μm, ex / em = 470/490 nm, CFH-5052-2), funcionalizados com anticorpo anti-GM-CSF (MAB2172) e (d = 4,5 μm, ex / em = 370/410 nm, CFP-4041-2) funcionalizado com anticorpo anti-IL6 (MAB206).
Primeiro, os microgrânulos passam pelo processo de incubação junto com a amostra por 1 hora e somente depois são capturados na membrana mencionada acima.
Nesta fase (dentro da membrana), os grânulos são lavados com 1 ml de tampão T20 a uma taxa de fluxo de 10 ml / h, incubados com 0,1 ml de anticorpo de detecção 0,7 nM em tampão T20 por 0,5 horas, lavados novamente em 1 ml de tampão T20 a 10 ml / h, e depois são liberados da membrana alterando a vazão para 6 ml / h.
Depois disso, as microesferas liberadas são misturadas com um substrato ELISA e encapsuladas em gotículas com um diâmetro de 40 μm. Para garantir uma mistura precisa de grânulos e substrato e minimizar o sinal de fundo das enzimas que geram um sinal fluorescente, é usado um canal especial com um comprimento de 14 mm.
O gerador de gotículas é projetado para que o diâmetro das gotículas seja independente da vazão. Este dispositivo possui apenas 100 desses geradores, que na saída fornecem uma taxa de transferência de 100.000 gotas por segundo.
Cada gota é encapsulada com 1 grânulo ou permanece intocada. Ao mesmo tempo, é atingida uma certa concentração - 10 gotas a mais que microgrânulos (por exemplo, 20 gotas - 10 com grânulos e 10 sem). Isso reduz a probabilidade de que em uma gota haverá dois grânulos até 0,5%.
Após os geradores de gotículas, existe uma linha de atraso semelhante a uma espiral com uma largura de canal de 1,8 mm e uma altura de 1,5 mm. A linha de atraso deve ser longa o suficiente, mas você não pode aumentar o tamanho do dispositivo. Portanto, quatro espirais foram feitas uma a uma, para passar completamente, a uma taxa de fluxo de 67 ml / h, as gotas levariam 3,2 minutos.
Para introduzir esse dispositivo em uma plataforma móvel, foi necessário resolver determinadas tarefas relacionadas à câmera do telefone. O uso de uma excitação de luz constante e constante no tempo leva ao fato de que gotículas que se movem no campo de visão da câmera são visualizadas como bandas. O comprimento dessa faixa define a distância mínima entre as gotas e, portanto, limita seriamente a taxa de transferência.
Se usarmos a excitação da luz com uma sequência pseudo-aleatória (no tempo), isso nos permitirá “ver” gotas individuais. A velocidade de modulação da luz é 10 vezes o tempo de exposição da câmera. Devido a essa diferença, as gotículas formam tiras, a distância entre as quais (três diâmetros de gotículas) é suficiente para sua determinação individual. Nesse caso, você pode pular 120 canais de gotejamento paralelos na frente da câmera.
Outro ponto importante na detecção e digitalização é a fluorescência. Para realizar o ELISA multiplex, são necessários vários sinais fluorescentes diferentes, para isso foram utilizadas três fontes de luz de uma só vez, cada uma com o comprimento de onda necessário para excitar um certo corante fluorescente. Este sistema triplo consiste em dois lasers de diodo (azul, verde) e um LED (UV).
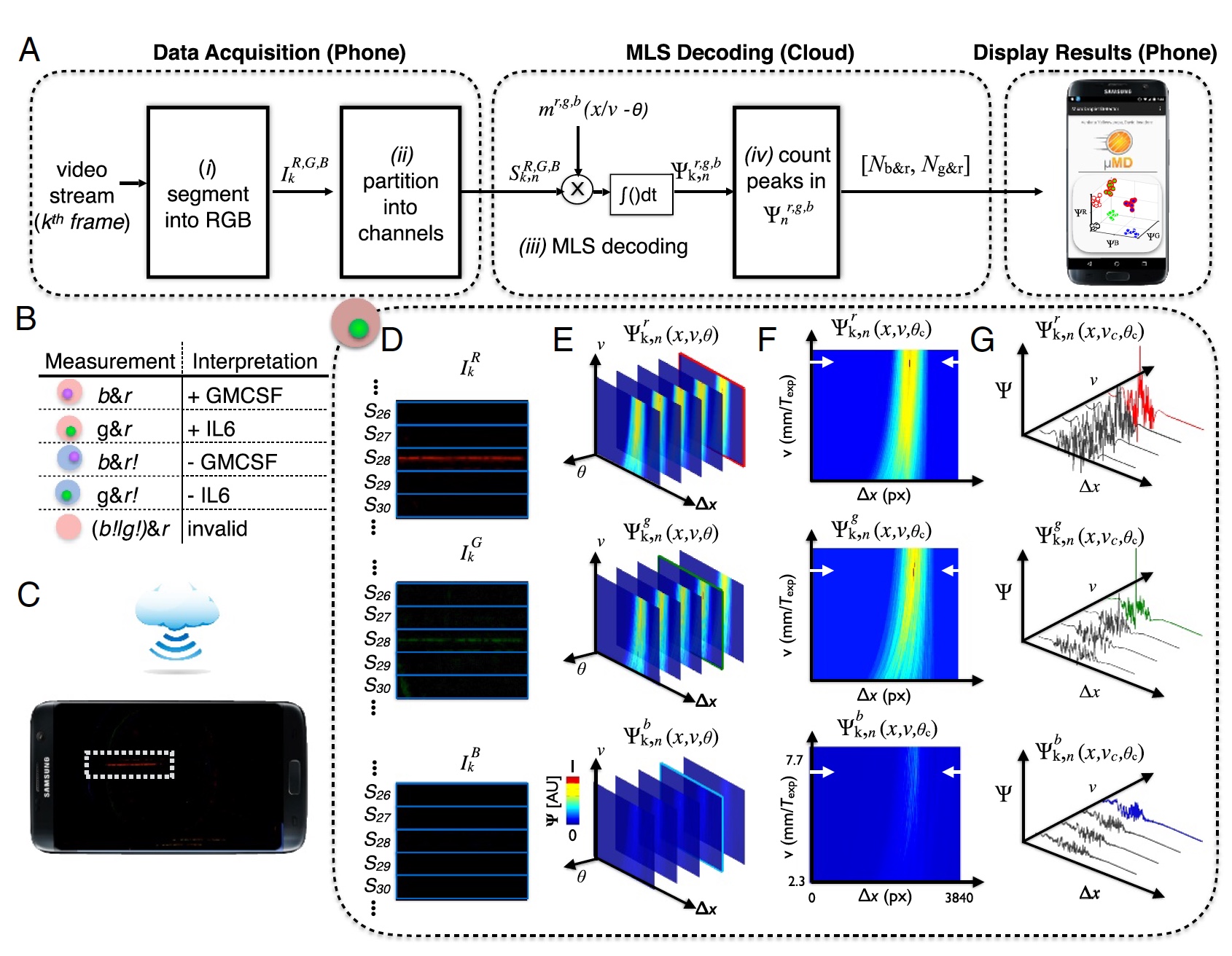 Imagem nº 3: processo "resultado da amostra" (decodificação de dados da câmera do telefone).
Imagem nº 3: processo "resultado da amostra" (decodificação de dados da câmera do telefone).Para decodificação precisa do vídeo da câmera do telefone, foi necessário realizar a detecção de correlação para os três padrões de modulação esperados (
m ), que correspondem a cada uma das três fontes de luz.
O resultado foi um vetor de correlação (
3a ), onde:
k - frames;
n = 1: 120 canais no dispositivo;
R ,
G ,
B - canais de cores da câmera digital;
r ,
g ,
b - excitação de cores.
O padrão de gota foi criado através de uma sequência de comprimento máximo (MLS) com | m | = 63 bits. Além disso, cada bit possui 10 pixels em uma imagem digital, ou seja, um total de 63 bits possui 630 pixels (1/3 de um quadro em 1920).
Uma varredura de fluorescência é necessária para determinar se uma gota contém um microgrânulo, se houver, para determinar a cor (UV ou proteína verde, molécula alvo vermelha). Após receber esses dados, eles devem ser extraídos. Para fazer isso, o quadro de vídeo é dividido em componentes vermelho, verde e azul de acordo com os sensores da câmera (
3d ).
Este dispositivo usou a tecnologia em nuvem. Isso foi feito para reduzir a carga no ferro (ou seja, no próprio telefone). Em vez de controlar a velocidade ou fase das gotículas, a computação em nuvem foi realizada para determinar gotículas com uma fase ou velocidade desconhecida (
3s ). Após determinar as fases ideais e a velocidade da gota, é possível determinar com precisão os picos no espaço de correlação Ψ
r, g, b k, n (x, u
c , θ
c ) (
3f e
3g ).
Os dados coletados são carregados em um aplicativo especial (até agora apenas no sistema operacional Android), que os envia para a nuvem para processamento usando o MATLAB em um servidor remoto. Depois disso, os dados já processados são retornados ao smartphone e exibidos na tela.
Depois de todo o trabalho preparatório e de teste, os cientistas decidiram realizar uma "disputa" com a participação de sua criação e o dispositivo comercial em tamanho real Simoa.
No duelo teste, foram utilizadas três versões do meio de trabalho: PBS - tampão fosfato de sódio, FBS - soro fetal bovino e soro sangüíneo humano. O indicador mais importante foi o limite de detecção (LOD), ou seja, o conteúdo mínimo do analito na amostra.
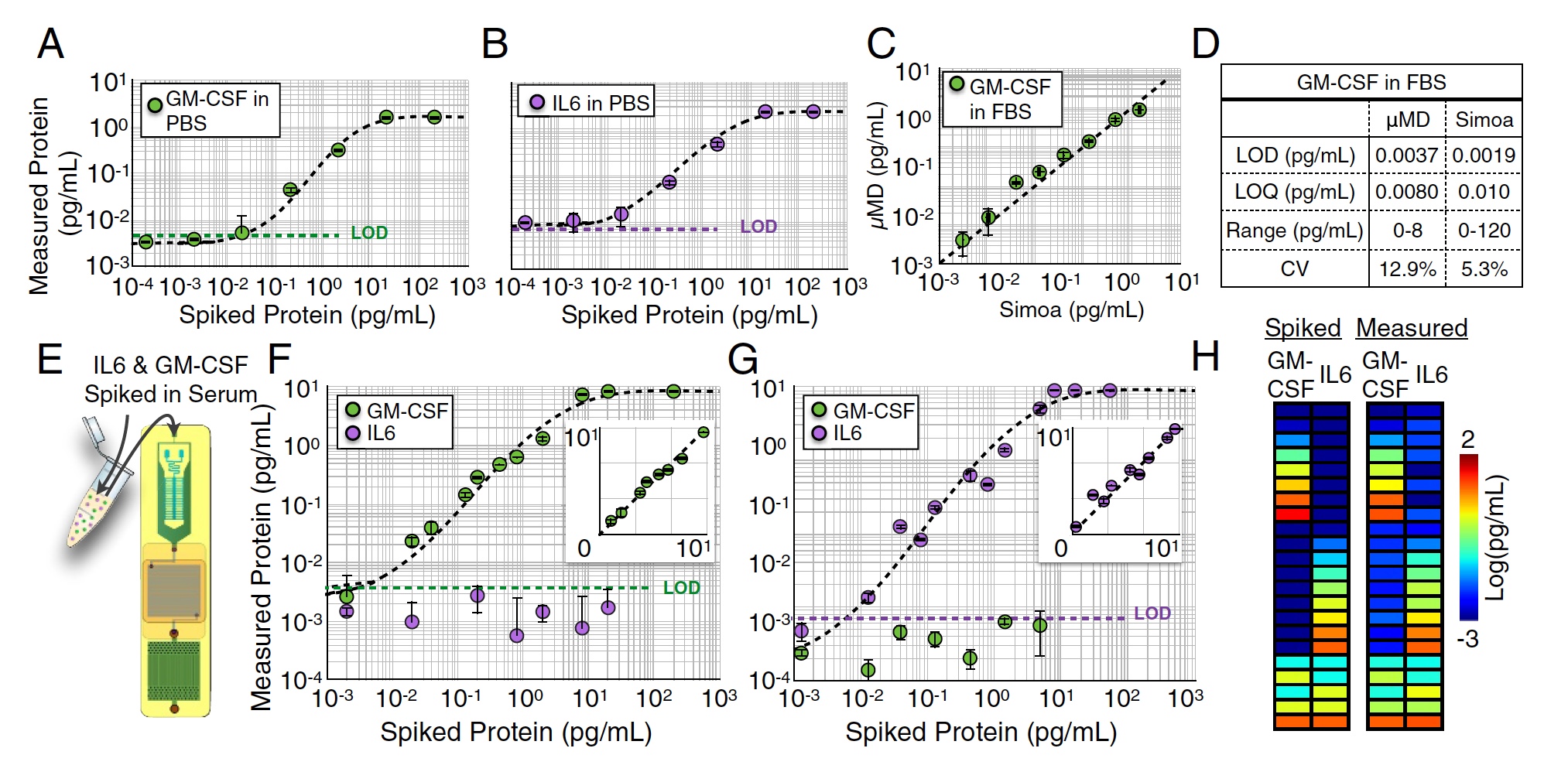
Resultados do teste de chip MD.
Várias medições de M-CSF em
um único canal (Imagem
A acima) e IL6 (Imagem
B ) foram realizadas em meio PBS medindo diluições seriadas de 104 a 102 pg / ml. Neste teste, foram obtidos limites de detecção muito bons: LOD = 0,0045 pg / ml para GM-CSF e LOD = 0,0070 pg / ml para IL6.
Medidas semelhantes também foram realizadas na solução de FBS (1: 4). Nesta fase, a amostra para análise foi dividida ao meio entre o dispositivo em estudo e o Simoa "pesado" comercial. Como resultado, a criação de cientistas mostrou excelentes resultados, que praticamente não eram inferiores aos do Simoa (R2 = 0,95, imagem
C acima).
Mas foi uma análise de um plex, ou seja, uma análise de um indicador. Agora era necessário verificar como o chip MD lidaria com a análise paralela de várias proteínas, ou seja, com a análise dúplex de GM-CSF e IL6 simultaneamente. Para começar, uma certa quantidade de GM-CSF foi adicionada ao FBS e a concentração de IL6 foi zero (imagens
F e
G ). O oposto foi feito: concentração zero de GM-CSF e alguma IL6.
Nos dois casos, o limite de detecção não diferiu muito dos resultados da análise one-plex realizada anteriormente (p> 0,88 para GM-CSF ep> 0,90 para IL6).
Depois disso, uma certa quantidade de GM-CSF e IL6 (imagem h) foi adicionada à amostra. A precisão da detecção foi excelente - R2> 0:99 para GM-CSF e R2> 0:99 para IL6.
O teste mais significativo foi a análise do soro humano. Amostras de sangue foram coletadas de 14 indivíduos. Os pesquisadores quantificaram o GM-CSF e IL6 dessas amostras usando um chip MD e Simoa.
 Resultados quantitativos do soro humano GM-CSF e IL6 usando MD e Simoa.
Resultados quantitativos do soro humano GM-CSF e IL6 usando MD e Simoa.Os resultados da análise usando o chip MD mostraram-se muito próximos dos resultados do Simoa (R2 = 0: 96), que atualmente é o analisador mais preciso.
Demonstração do dispositivo.Para um conhecimento mais detalhado das nuances e detalhes do estudo, recomendo que você analise o
relatório do grupo de pesquisa e
os materiais adicionais a ele.
Epílogo
A velocidade desempenha um papel enorme na medicina. Quanto mais rápido for o diagnóstico preciso, mais rápido você poderá iniciar o tratamento. Às vezes, não são apenas dias, mas minutos que não podem ser desperdiçados. , - . , , .
, MD, , . , , , . 500 . - 5.
, . .
, , .
Obrigado por ficar conosco. Você gosta dos nossos artigos? Deseja ver materiais mais interessantes? Ajude-nos fazendo um pedido ou recomendando a seus amigos, um
desconto de 30% para os usuários da Habr em um análogo exclusivo de servidores básicos que inventamos para você: Toda a verdade sobre o VPS (KVM) E5-2650 v4 (6 núcleos) 10GB DDR4 240GB SSD 1Gbps da US $ 20 ou como dividir o servidor? (as opções estão disponíveis com RAID1 e RAID10, até 24 núcleos e até 40GB DDR4).
VPS (KVM) E5-2650 v4 (6 núcleos) 10GB DDR4 240GB SSD de 1Gbps até o verão de graça quando pagar por um período de seis meses, você pode fazer o pedido
aqui .
Dell R730xd 2 vezes mais barato? 2 Intel Dodeca-Core Xeon E5-2650v4 128GB DDR4 6x480GB SSD 1Gbps 100 $249 ! Leia sobre
Como criar um prédio de infraestrutura. classe usando servidores Dell R730xd E5-2650 v4 custando 9.000 euros por um centavo?