A publicação anterior recebeu uma avaliação negativa com a expressão "por que postar coisas tão elementares aqui". Portanto, aviso imediatamente que esse material é destinado principalmente a crianças em idade escolar que começam a estudar química. E também para aqueles que não entenderam esse assunto nos anos escolares. Eu publicaria um artigo sobre um recurso especializado popular para crianças em idade escolar, se ele existisse.
E sim, eu estou ciente da existência de um modelo atômico no qual o elétron é uma onda de probabilidade localizada perto do núcleo. Mas, como regra, é difícil para um aluno imaginar como a probabilidade pode combinar átomos em moléculas. Portanto, afirmo "nos dedos".
A conexão de átomos em moléculasNosso mundo não existe na forma de átomos separados, eles de alguma forma se conectam. Qual?
Pegue dois átomos de hidrogênio. Cada um deles contém um próton e um elétron, então a carga total de cada um desses átomos é zero.
Lei do pendente
F = k * q1 * q2 / r ^ 2nos diz que corpos neutros não devem ser atraídos um pelo outro
(q1 = 0, q2 = 0) .
Portanto, o hidrogênio (e qualquer outro elemento químico) deve existir apenas na forma de átomos e nunca se combinar em moléculas. De fato, os átomos de hidrogênio sempre se combinam em pares. Porque
Vamos pegar dois pedaços de metal e organizá-los em paralelo a uma pequena distância um do outro.

Ambos os segmentos contêm o mesmo número de prótons e elétrons; portanto, a carga total de cada um deles é igual a zero. Portanto, eles não têm motivos para atração mútua.
Sabemos que nos metais uma parte dos elétrons externos deixa seus átomos e caminha livremente entre os íons (átomos abandonados) da estrutura cristalina do metal. E esses elétrons são distribuídos, em média, uniformemente.
Imagine que de alguma maneira conseguimos mover parte desses elétrons livres para o lado esquerdo do segmento inferior do metal. Além disso, no lado direito, haverá um déficit de elétrons.

Temos o chamado dipolo: o lado esquerdo do segmento é carregado negativamente, o direito é positivo. Ótimo. E o que vai acontecer no segmento superior? Sabemos que as mesmas acusações se repelem, enquanto as opostas se atraem. Consequentemente, os elétrons do segmento superior, começando pelos campos elétricos dos elétrons do segmento inferior, irão para o lado direito. Ou seja, a imagem da distribuição de elétrons nesses dois segmentos de metais se tornará espelho:
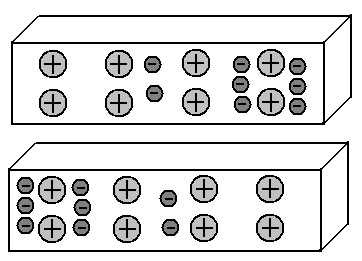
Esse efeito de objetos carregados em objetos vizinhos, levando a uma redistribuição de cargas neles, é chamado indução eletrostática.
Agora, o mais interessante: os núcleos atômicos carregados positivamente no lado esquerdo do segmento superior eram elétrons opostos coletados no lado esquerdo do segmento inferior. E as cargas opostas são atraídas. Assim, as partes esquerdas dos segmentos começarão a se atrair!
O mesmo acontecerá no lado direito dos segmentos - apenas espelhado. E as extremidades direitas dos segmentos também serão atraídas uma pela outra. Maravilhoso, não é? A redistribuição de cargas dentro de um dos segmentos dos condutores levou à atração mútua desses dois segmentos!
Mas o que acontece se agora movermos os elétrons livres do segmento inferior para a extremidade direita? Então os elétrons livres do segmento superior se moverão para a extremidade esquerda. Ou seja, movendo elétrons para frente e para trás em um dos segmentos, fazemos os elétrons do segmento vizinho se moverem, o que não está conectado de forma alguma ao primeiro! Tal efeito do movimento de elétrons em um condutor no movimento de elétrons em um condutor adjacente é chamado indução eletrodinâmica.
Embora isso não se aplique ao nosso tópico, observamos que estudamos de forma um pouco simplificada como a antena e o receptor funcionam durante a transmissão de rádio.
Podemos organizar esses dois pedaços de metal de maneira diferente - com as extremidades voltadas uma para a outra:

Se pudermos mover os elétrons, por exemplo, para o lado direito do segmento esquerdo, os elétrons do segmento direito, a partir deles, também se moverão para o lado direito do segmento direito:

E, neste caso, esses dois pedaços de metal começarão a se atrair, pois suas extremidades proximais têm a carga oposta. Deve-se notar especialmente que na segunda variante do arranjo dos segmentos, a força de sua atração mútua será mais fraca, pois apenas as extremidades opostas são atraídas, enquanto na primeira variante do arranjo dos segmentos, esquerda e direita são atraídas uma pela outra os fins.
Mas como isso se relaciona com a ligação de átomos? Vamos olhar para o átomo de hidrogênio. Tem um elétron se movendo ao redor do núcleo. E se o segundo átomo de hidrogênio estiver próximo, esse elétron fará com que o elétron do vizinho se mova da mesma maneira que se movia em nossos segmentos de metal - enquanto o elétron de um dos átomos está do lado do núcleo do átomo, o vizinho será forçado a ficar do lado oposto do átomo.
Aqui, é claro, a influência não é unilateral, mas mútua - tanto o primeiro elétron afeta o segundo quanto o segundo afeta o primeiro. Mas o mais importante é que esses dois átomos serão atraídos da mesma maneira que dois pedaços de metal foram atraídos na segunda variante de seu arranjo mútuo (com as extremidades voltadas uma para a outra).
A essência é a mesma: os elétrons são mantidos afastados um do outro, permitindo que cargas opostas sejam atraídas um pelo outro. Imagine que o elétron de um dos átomos estava entre os núcleos de dois átomos vizinhos, enquanto o elétron do átomo vizinho estava no ponto remoto oposto da órbita:

Agora temos um elétron com carga negativa localizado entre dois núcleos atômicos com carga positiva. Os núcleos de ambos os átomos são atraídos para esse elétron. Assim, um elétron atualmente liga dois átomos.
A distância entre os núcleos dos átomos é maior que a distância de cada um dos núcleos ao elétron localizado entre eles. E lembramos que a força de interação das cargas é inversamente proporcional ao quadrado da distância entre elas. Portanto, no momento, a força de atração dos núcleos ao elétron é maior que a repulsão mútua dos núcleos.
Mas os elétrons estão em constante movimento e, portanto, depois de um tempo, o primeiro elétron deixa o espaço entre os núcleos, mas o segundo elétron se move para lá. Neste momento, o papel do aglutinante passa para o elétron do segundo átomo (momento 3 na figura abaixo).

Observe que nos momentos mostrados nas Figuras 2 e 4, não há elétrons entre os núcleos dos átomos. Nesses momentos, os núcleos se repelem. Por esse motivo, a distância entre os átomos varia - ela muda constantemente durante a rotação dos elétrons ao redor dos núcleos, mas seu comprimento médio, chamado comprimento da ligação, é preservado. O comprimento da ligação - a distância entre os núcleos dos átomos - é individual para cada par de tipos de átomos combinados em uma molécula.
Os elétrons desses dois átomos na molécula de hidrogênio formada tentam estar o mais afastados possível, exatamente como fizeram nos segmentos metálicos. Devido a isso, a sincronização ocorre - a localização entre si em cada revolução ao redor dos núcleos é aproximadamente a mesma.
Isso lembra o desempenho coletivo de uma valsa, quando os pares giram na mesma velocidade, de modo que nem as senhoras nem os senhores estejam sempre próximos um do outro, mas sempre alternados:

Este artigo é um trecho do livro
"Clear Chemistry" .
Santa Incerteza e Santa ProbabilidadeA teoria quântica afirma que é impossível determinar simultaneamente o local exato de um elétron no espaço e seu momento (direção e velocidade de seu movimento). Portanto, acredita-se que ao redor do núcleo de um átomo haja certos lugares (áreas) em que a probabilidade de detectar um elétron é alta. Essas áreas são chamadas orbitais de elétrons.
Essa teoria não é difícil de explicar em um exemplo doméstico. Suponha que você mora em um apartamento no qual há um quarto, uma cozinha e um banheiro. Se você passa 90% do tempo no quarto, 8% na cozinha e 2% no banheiro, seu orbital pode ser considerado o quarto e a cozinha, pois a probabilidade de encontrá-lo no banheiro é muito baixa. Após 100 observações suas em momentos diferentes, é provável que o observador o encontre em 90 casos no quarto e em 8 na cozinha. E por estes números chegará a uma conclusão sobre a área do seu habitat.
Agora, sobre por que é impossível determinar simultaneamente o lugar de um elétron no espaço e sua velocidade e a direção do movimento. É ainda mais fácil. O fato é que a velocidade pode ser medida apenas em um determinado
segmento da distância percorrida. Dividindo a duração desse segmento pelo tempo em que ele passou, podemos descobrir a velocidade do movimento. Mas não podemos considerar um segmento do espaço como a localização do corpo. A localização é a coordenada exata do corpo.
Imagine uma mosca voando em um quarto escuro. Ao iluminar a sala com um flash de luz muito curto, podemos ver o local onde a mosca está atualmente localizada. Mas, para entender onde e com que velocidade ele voa, teremos que acender a luz por mais tempo. Então veremos uma mudança na posição da mosca ao longo do tempo e poderemos estimar a velocidade dessa mudança. Mas, neste caso, não podemos mais indicar o
local exato onde a mosca estava durante a medição de sua velocidade, pois durante esse tempo ela se moveu a uma certa distância. Esse é o objetivo do princípio da incerteza.
Os elétrons que se movem ao redor dos núcleos atômicos alteram muito rapidamente a velocidade e a direção do movimento, por isso é impossível dizer exatamente onde eles estão em um determinado momento e para onde estão se movendo.
E no modelo discutido acima, os elétrons se movem como setas em um relógio. E isso não pode deixar de causar a ira justa dos adeptos da Santa Incerteza e da Santa Probabilidade.
No entanto, o fato de não podermos dizer exatamente onde esse ou aquele elétron está localizado e a qual átomo ele “pertence” não altera o mecanismo eletrostático de ligação dos átomos. É impossível ligar dois prótons senão colocando um elétron entre eles. Nenhuma probabilidade ou incerteza pode conectar átomos a uma molécula. E demonstra perfeitamente o íon de hidrogênio molecular H2 +. Neste íon não existe um dupleto de elétrons, nem compensação dos giros dos elétrons emparelhados, nem sobreposição de nuvens de elétrons; no entanto, esse íon existe e é estável.
Além disso, não esqueça que este é apenas um modelo, e seus recursos "explicativos" são limitados, assim como os recursos de qualquer outro modelo. Por exemplo, (ao que parece) não explica por que os átomos de hidrogênio não podem se juntar a cadeias longas como H3, H4, etc.
No entanto, podemos supor que, devido ao fato de os orbitais eletrônicos nas moléculas de hidrogênio serem deslocados para o centro da molécula, eles não "se projetam" de suas extremidades e, portanto, as moléculas de hidrogênio vizinhas não são capazes de se agarrar umas às outras usando o mecanismo de sincronização eletrônica.