Atualmente, o envelhecimento humano é definido como uma diminuição fisiológica das funções biológicas do corpo, com constante adaptação a danos internos e externos. O sistema endócrino desempenha um papel importante na organização das interações celulares, metabolismo, crescimento e envelhecimento. Vários estudos, de worms a mishas, demonstraram que suprimir a atividade da via hormônio do crescimento / fator de crescimento semelhante à insulina-1 / insulina (GH / IGF-1 / insulina) pode ser útil para prolongar a vida humana, enquanto os resultados em seres humanos são contraditórios. Nesta revisão, discutimos o papel potencial do sistema IGF-1 na modulação da longevidade, levantando a hipótese de que a adaptação endócrina e metabólica observada em centenários e mamíferos com restrição calórica pode ser uma estratégia fisiológica para aumentar a expectativa de vida devido ao crescimento celular mais lento / metabolismo, melhor uso das reservas fisiológicas, mudança do metabolismo celular da proliferação celular para ações regenerativas e diminuição do acúmulo de células em envelhecimento.
Entrada.O envelhecimento é definido como uma diminuição fisiológica das funções biológicas do corpo, com uma diminuição ou perda progressiva da adaptação a danos internos e externos. Nos seres humanos, o fenótipo do envelhecimento é extremamente heterogêneo e pode ser descrito como um mosaico complexo resultante da interação de vários eventos aleatórios e ambientais, alterações genéticas e epigenéticas acumuladas ao longo da vida. Apesar de sua enorme complexidade, a base molecular do envelhecimento é limitada pelos poucos mecanismos biológicos altamente evolutivamente conservadores responsáveis pela manutenção e restauração do corpo (1).
Nas últimas três décadas, um dos tópicos mais discutidos em gerontologia tem sido o papel do hormônio do crescimento (GH) / fator de crescimento semelhante à insulina-1 (IGF-1) / sistema de insulina na regulação da longevidade. Dados acumulados indicam que essa via desempenha um papel importante na patogênese de várias doenças relacionadas à idade, incluindo câncer, demência, doenças cardiovasculares e metabólicas (2 - 4).
Em modelos animais, a inibição do sistema GH / IGF-1 / insulina demonstrou aumentar significativamente a vida útil. No entanto, em humanos, os dados são contraditórios (5, 6).
Esta revisão descreve os mais recentes avanços no estudo do sistema IGF-1 e modulação da longevidade, a hipótese de que a adaptação endócrina e metabólica observada em centenários e mamíferos durante a restrição calórica pode ser uma estratégia fisiológica para aumentar a expectativa de vida devido a uma menor crescimento / metabolismo celular, melhor controle na transmissão de sinal e capacidades de reserva fisiológica e acúmulo reduzido de células envelhecidas.
Sistema IGF-1 e durabilidade em modelos animais
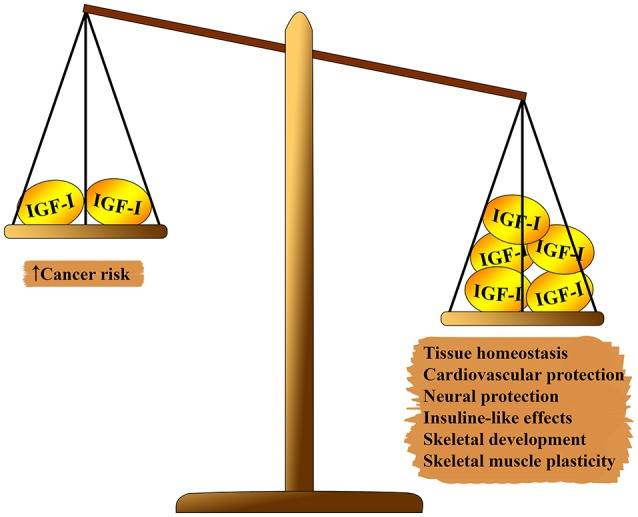 Fig. 1 Efeito pleiotrópico do IGF-1 no corpo. De um lado da balança, que supera: homeostase tecidual, efeitos cardioprotetores e neuroprotetores, efeitos semelhantes à insulina, participação na formação do esqueleto e regeneração muscular. No segundo lado da balança: o risco de carcinogênese.
Fig. 1 Efeito pleiotrópico do IGF-1 no corpo. De um lado da balança, que supera: homeostase tecidual, efeitos cardioprotetores e neuroprotetores, efeitos semelhantes à insulina, participação na formação do esqueleto e regeneração muscular. No segundo lado da balança: o risco de carcinogênese.O sistema IGF-1 tem vários efeitos pleiotrópicos no envelhecimento biológico (ver figura 1). O IGF-1 desempenha um papel importante no desenvolvimento fetal, seu crescimento na infância e adolescência e na homeostase do tecido adulto. Além disso, o IGF-1, aparentemente, tem um efeito ateroprotetor, um efeito neural protetor e semelhante à insulina (em altas concentrações) e regula o metabolismo ósseo e a regeneração muscular. No entanto, o IGF-1 é um fator de risco importante no desenvolvimento de vários tipos de tumores devido à sua forte atividade proliferativa, principalmente devido à modulação do ciclo celular, apoptose e sobrevivência celular (7 - 9). A maioria desses efeitos é mediada pela interação com o substrato do receptor de insulina (IRS) -1 e-2 e pela modulação da via alvo PI3K / AKT / rapamicina de mamífero (mTOR) (ver Fig. 2)
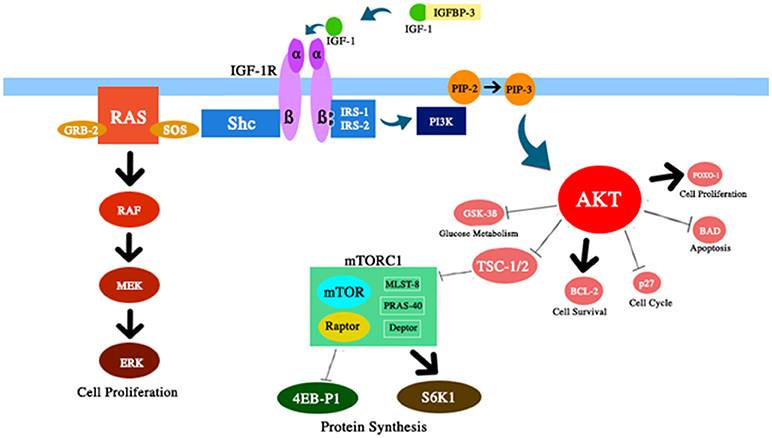 Figura 2 Representação esquemática de vários componentes do caminho IGF-1 / PI3K / AKT / mTOR discutidos nesta revisão. O IGF-1 aumenta a atividade da AKT com efeitos correspondentes na sobrevivência e proliferação celular, metabolismo da glicose e síntese de proteínas.
Figura 2 Representação esquemática de vários componentes do caminho IGF-1 / PI3K / AKT / mTOR discutidos nesta revisão. O IGF-1 aumenta a atividade da AKT com efeitos correspondentes na sobrevivência e proliferação celular, metabolismo da glicose e síntese de proteínas.
Vários estudos pré-clínicos relataram que mutações nos genes que controlam a via de sinalização GH / IGF-1 / insulina podem aumentar significativamente a vida útil nos modelos de animais invertebrados e vertebrados (5, 6).
Modelos de invertebrados.Nos invertebrados, a cascata de insulina / tipo IGF é regulada por vários peptídeos capazes de interagir com um receptor comum de insulina / tipo IGF-1.
No nematóide Caenorhabditis elegans, a via semelhante à insulina / IGF consiste em várias proteínas codificadas pelos genes daf-2, idade 1 (codificando a subunidade catalítica PI3K), akt-1, akt-2, pdk-1, sgk-1 (serina-treonina quinases ), daf-16, skn-1 e daf-18 (PTEN, fosfatase envolvida na inibição da via de sinalização da AKT). Foi demonstrado que a atividade reduzida dos genes daf-2, idade-1, akt-1, akt-2, pdk-1, sgk-1 suprime essa via, e os animais com essas mutações foram relatados com idade mais lenta e vida útil prolongada até 300%. Por outro lado, a estimulação da via semelhante à insulina / IGF diminui a vida útil do nematóide (10, 11).
No Drosophila melanogaster da mosca da fruta, a sinalização do tipo insulina / IGF consiste em dINR (proteína semelhante ao receptor de insulina / IGF-1), substrato do receptor de insulina CHICO, alvo PI3K Dp110 / p60 e PI3K PK3. Foi relatado que as moscas com uma mutação nesses genes aumentaram significativamente a expectativa de vida (12, 13).
Surpreendentemente, os mesmos mecanismos moleculares em diferentes tecidos não afetam o envelhecimento da mesma maneira. Vários estudos de nematóides e moscas da fruta mostraram que uma diminuição da sinalização semelhante à insulina / IGF nos tecidos nervoso e adiposo desempenha um papel importante na regulação da longevidade (14, 15). Embora tenha sido demonstrado em modelos de invertebrados que essa cascata é importante para modular a vida útil, os efeitos da sinalização do tipo insulina / IGF na vida útil são muito mais complexos em vertebrados porque possuem moléculas de insulina e IGF funcionalmente específicas, proteínas de ligação a IGF (IGFBPs ), IGFBP, proteases de GH, múltiplos receptores e vários mecanismos de transmissão de sinal intracelular com diferentes expressões específicas de tecidos (16).
Modelos de vertebradosVários camundongos GH / IGF-1 mutantes foram projetados com diferentes alvos. Os modelos mais atuais são descritos abaixo.
Ratos Snell e Ames.Os camundongos Snell e Ames são duas linhagens de camundongos com mutações nos genes PIT-1 e PROP-1, respectivamente (17, 18). Como as proteínas PIT-1 e PROP-1 são necessárias para a diferenciação das células hipofisárias que produzem GH, prolactina e hormônio estimulador da tireóide, ambos os tipos de camundongos mutantes homozigotos não possuem os três hormônios (18). Esses modelos mostraram um aumento significativo na expectativa de vida (42-70% a mais do que em camundongos do tipo selvagem), aumento da sensibilidade à insulina e menor frequência do tumor (19, 20). Quando os ratos Ames foram restringidos em calorias, sua vida útil aumentou ainda mais (21). Embora esses animais não possuam três hormônios, foi demonstrado que o aumento da longevidade depende principalmente da deficiência de GH (22).
Mouse aceso / acesoCamundongos lit / lit têm deficiência de GH e uma mutação no gene que codifica o receptor do hormônio liberador de GH (GHRHR). Esses animais eram anões, aumentaram o tecido adiposo, diminuíram as taxas de tumor e a expectativa de vida aumentou de 23 a 25% (19).
Camundongo com liberação de hormônio liberador de GH (GHRH-KO).Camundongos knockout O hormônio liberador de GH (GHRH-KO) vive 43% (nas fêmeas) e 51% (nos machos) mais que os animais do tipo selvagem e tem muitas características fenotípicas dos camundongos Ames, como aumento da sensibilidade a insulina, diminuição dos triglicerídeos plasmáticos e dos níveis de colesterol, aumento do tecido adiposo, elevação dos níveis plasmáticos de leptina e adiponectina (23).
Camundongos knockout para receptor GH (GHR-KO)Os camundongos knockout para receptores GH (GHR-KO) apresentam níveis séricos elevados de GH e níveis muito baixos de IGF-1. Também foi relatado que essa linhagem de camundongos viveu 38 a 55% a mais que o tipo selvagem (24) e mostrou uma diminuição no estresse oxidativo, bem como um início mais baixo e tardio de tumores fatais (25). Resultados semelhantes foram observados em camundongos df / KO, cruzaram duas cadeias de misha, os anões GHR-KO e Ames, que careciam de receptor GH e GH e continuaram a aumentar a expectativa de vida (26). Ao contrário dos irmãos Ames selvagens e camundongos anões, a restrição calórica não aumentou a vida útil dos camundongos GHR-KO, sugerindo que o eixo GH / IGF-1 e a restrição calórica podem ter mecanismos semelhantes ou parcialmente sobrepostos para prolongar a vida útil (27) .
Antagonismo do Receptor GH (GHA)Nem todos os modelos animais com supressão do sistema GH / IGF-1 mostram um aumento na expectativa de vida. A cepa de ratos GHA é um desses exemplos. O GHA, gerado pela substituição de um aminoácido, é capaz de ligar o receptor GH com a mesma afinidade que o GH, mas não causa sinalização intracelular. A expectativa de vida de camundongos GHA não aumentou significativamente (28).
IGF-1R +/– RatosEnquanto a maioria dos camundongos com um receptor IGF-1 inativo (IGF-1R - / -) morre ao nascer, os animais heterozigotos para o alelo mutante do receptor IGF-1 (IGF-1R ±) apresentaram níveis muito baixos de IGF-1 sérico , cerca de 10% menor e 33% maior de expectativa de vida em mulheres e 16% em homens. No entanto, neste estudo, os controles do tipo selvagem sobreviveram a 19 meses, o que prejudicou a interpretação dos resultados (29). Estudos mais recentes que avaliaram a expectativa de vida em outra linha de IGF-1R ± mostraram um leve aumento na expectativa de vida em 5 a 10%, mas apenas em mulheres (30, 31). Além disso, a principal tensão de fundo parece afetar o grau de extensão da vida em vários modelos de camundongos (32).
Um IGF1-R +/− específico do cérebroUm camundongo mutante IGF1-R +/− específico do cérebro viveu 9% mais que o tipo selvagem, o que enfatiza o papel correspondente do sistema nervoso na modulação da longevidade (33).
Camundongos com ruptura de IGF-1 específicos para o fígado (LI-IGF-1 - / -).Os ratinhos com produção de IGF-1 diminuída (LI-IGF-1 - / -) têm níveis séricos muito baixos de IGF-1 e altos níveis séricos de GH devido à inativação do gene IGF-1. Os camundongos LI-IGF-1 - / - reduziram acentuadamente a obesidade e, como resultado, o peso foi 25% menor do que nos camundongos do tipo selvagem. Apenas camundongos fêmeas LI-IGF-1 - / - apresentaram um aumento na expectativa de vida de 16% em comparação aos camundongos controle (34).
Ratinhos Pappa - / -.Os camundongos Pappa - / - têm um nocaute no gene da proteína plasmática A associada à gravidez, PAPP-A, PAPPA, uma protease específica para proteínas de ligação ao IGF. A vida útil média dessa cepa de camundongo foi 38% maior em comparação aos controles do tipo selvagem. Os camundongos Pappa - / - eram anões, mas seus níveis séricos de glicose, insulina, IGF-1 e GH não diferiam daqueles dos controles do tipo selvagem, sugerindo que o PAPPA age principalmente no nível autócrino ou parácrino. Além de aumentar a expectativa de vida, os camundongos Pappa - / - apresentaram menor incidência de tumores, além de lesões degenerativas relacionadas à idade (35, 36).
Mouse IRS interrompido (IRS1 - / -).IRS-1 e -2 são importantes mediadores da insulina e da sinalização de IGF-1. Os camundongos IRS1 - / - eram resistentes à insulina, com um defeito na transmissão de sinais de insulina principalmente no tecido muscular, cerca de 30% mais curto que o tipo selvagem, e apenas as fêmeas tinham uma expectativa de vida 18% mais longa em comparação aos animais do tipo selvagem (37 ) )
Os camundongos IRS2 - / - também eram resistentes à insulina, mas, diferentemente dos camundongos IRS1 - / -, eles apresentaram defeitos de sinalização de insulina em mais tecidos, incluindo fígado, tecido adiposo e músculo esquelético. Esses camundongos desenvolveram diabetes e sua vida útil foi muito menor do que a de camundongos selvagens e IRS2 ±. Os ratos IRS2 +/− melhoraram a sensibilidade à insulina e aumentaram a expectativa de vida (+ 18%) em comparação com os ratos do tipo selvagem. Além disso, os camundongos específicos para o cérebro IRS2 ± e IRS2 - / - foram relatados como resistentes à insulina e viveram 18 e 14% mais que os controles do tipo selvagem, respectivamente (38).
Ratos modificados pelo KLOTHO.A proteína KLOTHO inibe a sinalização de insulina e IGF-1, possivelmente interrompendo a interação receptor / ligante. Os camundongos com superexpressão KLOTHO foram relatados como de tamanho normal, e a resistência à insulina se desenvolveu em homens, e a expectativa de vida em homens e mulheres aumentou significativamente (+18 e + 30%, respectivamente) (39, 40).
P66shc Mouse interrompido (P66shc - / -).P66shc é uma proteína que medeia a sinalização de IGF-1 após o receptor, ativando a via MAPK. Os ratos P66shc - / - tinham um fenótipo normal, mas viveram 28% mais que os controles do tipo selvagem (41). No entanto, esses dados não foram confirmados em um estudo recente (42).
O papel da sinalização de GH / IGF-1 / insulina no envelhecimento e na longevidade foi profundamente estudado em todos esses modelos animais. Enquanto invertebrados, o efeito da supressão da via IGF-1 / insulina na expectativa de vida era óbvio e significativo, em modelos de camundongos esse efeito foi enfraquecido e não reproduzível em alguns casos, como nas linhas IGF-1R ± e P66shc - / - camundongos. No entanto, a maioria desses modelos mostrou algumas características comuns entre os ratos de vida longa, como níveis reduzidos de IGF-1 e insulina circulantes e aumento da sensibilidade à insulina, que provavelmente reduzem a incidência de câncer, melhoram a resistência ao estresse e prolongam a vida. . Alterações genéticas que podem perturbar o sistema IGF-1 podem manter os animais saudáveis por períodos mais longos e podem atrasar ou aliviar algumas doenças relacionadas à idade. Nesse processo, os tecidos nervoso e adiposo desempenham um papel importante.
Além disso, são necessários dados adicionais para determinar o melhor momento no tempo durante a vida útil para intervir na supressão do sistema IGF-1 para obter um efeito positivo na vida útil. Em camundongos igf f / f C57B l / 6, uma deficiência de IGF-1 circulante, a partir dos 5 meses de idade ou mais cedo, aumentou a expectativa de vida em 15% apenas em mulheres com uma diminuição no número de órgãos com patologia no final da vida em comparação com o grupo controle . Além disso, a deficiência tardia de IGF-1 (15 meses) reduziu o risco de câncer, mas não teve um efeito positivo na expectativa de vida (43). Esses dados sublinham a importância da deficiência de IGF-1 em idade precoce para aumentar a expectativa de vida. Por outro lado, Mao et al. (44) relataram recentemente que a administração tardia de anticorpo monoclonal direcionado contra o receptor IGF-1 em camundongos CB6F1 de 18 meses prolongou a expectativa de vida feminina em 9% e melhorou alguns aspectos da saúde.
Sistema IGF-1 em pessoas de vida longa
Os centenários do centenário são considerados o melhor modelo humano para o estudo dos determinantes biológicos da longevidade, que atingiram os valores mais extremos da expectativa de vida humana (45).
Vários estudos compararam os níveis circulantes de insulina e IGF-1 em fígados longos com aqueles em controles mais jovens (46).
A remodelação metabólica relacionada à idade é um processo fisiológico que ocorre em toda a população. O envelhecimento está frequentemente associado a uma diminuição da tolerância à glicose, que está associada ao aumento da resistência à insulina (47), mas as pessoas de longa vida têm uma exceção. Verificou-se (48) que a resistência à insulina aumenta com a idade e diminui em pessoas com mais de 90 anos que vivem no sul da Itália. De fato, indivíduos de longa duração apresentaram maior sensibilidade à insulina e melhor função das células beta do que indivíduos mais jovens. Essa diferença também não dependeu dos principais fatores antropométricos e metabólicos. Nos pacientes com 100 anos de idade, a concentração plasmática de glicose por 2 horas foi menor do que nos idosos (idade média de 78 anos). Nos fígados longos, a ingestão de glicose mediada por insulina foi maior do que nos controles idosos durante a captação euglicêmica da glicose, que manteve a tolerância à glicose preservada e a ação da insulina nesse grupo de vida longa (49, 50). Resultados semelhantes confirmando a melhor sensibilidade à insulina foram observados em outras populações de fígados longos (51, 52).
Além disso, os fígados longos mostraram o efeito preservado da insulina não apenas no metabolismo da glicose, mas também no tecido adiposo. De fato, a infusão de insulina geralmente está associada à inibição da lipólise e, portanto, a uma diminuição significativa na concentração de ácidos graxos livres e triglicerídeos no plasma. Em fígados longos, a atividade inibitória da insulina durante a lipólise foi maior do que nos participantes do controle (idade média de 78 anos) (50). Deve-se notar que os centenários também têm um tônus simpático menor em comparação aos controles adultos, o que pode estar associado a uma melhor ação da insulina e, portanto, a um baixo nível de insulina plasmática em jejum (53, 54).
Os dados do sistema IGF-1 sobre expectativa de vida ainda são contraditórios em indivíduos de longa duração (46). Paolisso et al. (55) descreveram um aumento da proporção plasmática de IGF-1 / IGFBP-3 em fígados longos saudáveis em comparação com idosos. Eles sugeriram que essa proporção aumentada indica uma maior biodisponibilidade do IGF-1, o que contribui para uma melhora na ação da insulina em fígados longos. Bonafè et al. (56) relataram que indivíduos com pelo menos o alelo A do gene do receptor IGF-1 (G / A, códon 1013) apresentavam baixos níveis plasmáticos de IGF-1 livre e eram mais prevalentes em pessoas longevas. Arai et al. (57) descreveram níveis relativamente baixos de IGF-1 sérico na população japonesa de fígado longo. Nesta população, as menores taxas de IGF-1 e IGFBP-3 foram associadas ao aumento da mortalidade (58).Esses resultados conflitantes provavelmente refletem a complexidade do sistema IGF e as diferenças étnicas na população registrada. Além disso, os centenários eram frequentemente comparados com um grupo controle de indivíduos mais jovens. Assim, na maioria desses estudos, era impossível concluir se as diferenças entre o IGF-1 nos dois grupos estavam associadas a diferentes expectativas de vida ou refletiam uma diminuição fisiologicamente dependente da idade no IGF-1. De fato, existem várias limitações para o estudo de fígados longos: (1) baixa prevalência (1 centenário por 5 a 10.000 habitantes), (2) fraqueza devido à idade extrema (quase 95% dos fígados longos têm pelo menos 1 critério de astenia), (3) ) a ausência de um grupo controle da mesma idade (45, 59). Devido a essas limitações, este modelo humano não é adequado para o estudo de variáveis relacionadas à idade,que podem estar envolvidos na modulação da expectativa de vida.Os descendentes de centenários são outro modelo interessante para determinar os fatores relevantes associados à longevidade humana e ao envelhecimento saudável. Um conjunto consistente de observações em diferentes países sugere que os descendentes de fígados longos são mais saudáveis que os representantes dos mesmos grupos demográficos (51, 60, 61) e biologicamente (epigeneticamente) mais jovens do que a idade cronológica (62). Em geral, esses estudos mostram que parentes de centenários têm maior probabilidade de viver mais e ter boa saúde (60, 63). Além disso, o estudo da prole de fígados longos tem a vantagem de ter um grupo de controle demograficamente selecionado, constituído por uma progênie de idade comparável, na qual ambos os pais nasceram na mesma coorte de centenários, mas morreram antes da idade limite.após o qual as pessoas são classificadas como "centenárias". Essa estratégia é crítica para evitar efeitos de coorte. Assim, o modelo de filhos de fígados longos pode superar algumas das limitações encontradas no estudo de fígados longos (raridade, fraqueza e falta de controle adequado) (60).Em vários estudos, o sistema IGF-1 / insulina foi caracterizado em descendentes de fígados longos e no grupo controle correspondente.Avaliamos a bioatividade circulante do IGF-1, medida usando um inovador teste de ativação do receptor de quinase (KIRA) realizado em fígados longos, descendentes de fígados longos e descendentes de controle comparáveis. Os filhos de fígados longos e fígados longos apresentaram uma atividade biológica circulante relativamente menor do IGF-1 em comparação com o grupo controle. Curiosamente, a atividade biológica do IGF-1 em descendentes de fígados longos foi inversamente relacionada à sensibilidade à insulina (51).Suh et al. (64) avaliaram os níveis séricos de IGF-1 em descendentes de centenários judeus de Ashkenazi e em controles comparáveis à idade. Nas crianças do sexo feminino, o IGF-1 sérico foi 35% maior do que nos participantes do controle. Esta diferença pode representar uma resposta compensatória a uma diminuição na sinalização do receptor de IGF-1. Além disso, a presença judaica de centenários de Ashkenazi descreveu a presença excessiva de mutações heterozigotas no gene do receptor IGF-1, juntamente com níveis séricos relativamente altos de IGF-1 e diminuição da atividade do receptor IGF-1 em comparação ao grupo controle sem longevidade familiar.Para estudar a longevidade, outros autores examinaram irmãos e irmãs de noventa anos e seus descendentes. No estudo de longevidade de Leyden, 421 famílias foram selecionadas, consistindo em pelo menos dois repórteres, irmãos e irmãs, seus descendentes e parceiros de descendentes como controle. Nessas populações, glicose sérica, insulina e triglicerídeos foram os melhores biomarcadores para o envelhecimento saudável (baixos níveis de glicose e insulina foram considerados saudáveis) (65). Centenários de nove anos de idade na menor proporção de IGF-1 / IGFBP-3 na corrente sanguínea foram associados a uma melhor sobrevida (66). Descendentes de crianças de nove anos apresentaram melhor sensibilidade à insulina em comparação com seus parceiros, enquanto níveis semelhantes de soro de jejum IGF-1 e IGFBP-3 foram observados em ambos os grupos de jejum (67). Interessantea secreção total de GH em 24 horas foi 28% menor na prole em comparação com o controle (68).Outra abordagem adotada para estudar a longevidade em seres humanos é selecionar componentes familiares para uma longevidade excepcional e um envelhecimento saudável com base em critérios rigorosos, como o Long Life Family Study, uma medida do tempo de vida da família. Essas famílias, selecionadas para uma expectativa de vida excepcional, foram comparadas com um grupo controle sem histórico familiar de longevidade (69). Nesta população, os níveis circulantes de IGF-1 provaram ser um biomarcador confiável relacionado à idade (70).Em apoio ao potencial papel do sistema GH / IGF-1 / insulina na longevidade humana, existem muitos estudos genéticos. De fato, verificou-se que vários loci genéticos estão associados aos níveis circulantes de IGF-1 e IGFBP-3 e são potencialmente capazes de afetar o envelhecimento (71). Uma análise em todo o genoma das associações realizadas em noventa anos de idade e populações de pacientes com idade <60 anos mostrou uma ligação clara entre a variação genética dos genes envolvidos na via da insulina / IGF-1 e a vida útil humana (72). Em um estudo prospectivo de idosos, mulheres com perfil genético, indicando uma diminuição na atividade de sinalização de insulina / IGF-1, apresentaram expectativa de vida mais longa (73).Em quatro coortes independentes de indivíduos de vida longa, recentemente foi descrito um aumento linear na prevalência da homozigose exógena do receptor GH 3 (G3R) com a idade. A presença do genótipo d3 / d3 aumentou a expectativa de vida em cerca de 10 anos (74).IGF-1
Uma das observações mais convincentes na biologia do envelhecimento é a capacidade de limitar calorias para prevenir ou retardar algumas doenças relacionadas à idade e aumentar a expectativa de vida dos mamíferos (75 - 78). Os mecanismos biológicos desse fenômeno não são totalmente claros, mas sugeriu-se o envolvimento potencial de alterações correspondentes no metabolismo energético, no sistema endócrino e no dano oxidativo.
A restrição calórica causa inúmeras alterações hormonais. Em roedores, a restrição calórica sem fome suprimiu os níveis circulantes de IGF-1 e insulina na proporção do nível de restrição, aumentou a sensibilidade à insulina e a resistência ao estresse e à toxicidade, além de reduzir o risco de câncer (79, 80). Curiosamente, a maioria dessas características observadas em camundongos do tipo selvagem durante a restrição calórica se assemelha às relatadas em camundongos que têm vida longa devido ao comprometimento genético da sinalização de GH / IGF-1 / insulina, como descrito anteriormente.
Ensaios clínicos randomizados em humanos mostraram que a restrição calórica não reduz o IGF-1 sérico, a menos que a ingestão de proteínas seja reduzida (81, 82). No entanto, uma recente metanálise que avaliou o efeito da restrição nutricional nos biomarcadores reconhecidos de envelhecimento saudável mostrou uma diminuição nos níveis de IGF-1 no sangue humano (83).
Outras alterações hormonais, como diminuição dos níveis de insulina, hormônios tireoidianos e leptina, bem como aumento da sensibilidade à adiponectina e à insulina, foram observadas durante a restrição da dieta (85, 86).
Essa adaptação hormonal pode desempenhar um papel importante no prolongamento da vida através de vários mecanismos:
1) Diminuição da taxa metabólica, proliferação celular e estresse oxidativo. De fato, o IGF-1 é um fator de crescimento potente e o hormônio tireoidiano é um estimulante potente da taxa metabólica básica e do metabolismo oxidativo. Além disso, os padrões de transcrição sugerem que a restrição calórica moderada crônica em adultos retarda o processo de envelhecimento, mudando o metabolismo celular do crescimento para a manutenção e recuperação (84).
2) Reduzir o acúmulo de células envelhecidas. O envelhecimento celular demonstrou ser um mediador chave do envelhecimento (87). Com o tempo, a homeostase das proteínas diminui e os danos se acumulam. Curiosamente, algumas doenças relacionadas à idade podem ser retardadas pelo enfraquecimento do acúmulo de células envelhecidas (88, 89). Normalmente, a via mTOR é ativada por vários sinais, incluindo nutrientes, IGF-1 e insulina (Fig. 2). A desregulação dessa via, relatada após a restrição calórica, aumentou a vida útil de alguns organismos. Aparentemente, esse efeito é secundário a um aumento da autofagia, um processo de digestão citoprotetora. De fato, a autofagia é um processo de processamento celular que pode remover componentes celulares antigos ou danificados, impedindo o acúmulo de células envelhecidas (90, 91).
3) Combater a inflamação. A intervenção alimentar em animais e humanos pode retardar o processo de envelhecimento, enfraquecendo o estado inflamatório em um grau fraco (83, 92). Os mecanismos subjacentes à atividade anti-inflamatória da restrição nutricional não estão claramente definidos. Acredita-se que esse efeito se deva a uma diminuição da massa gorda e adipocinas pró-inflamatórias, bem como a uma melhora na integridade da barreira intestinal observada durante a intervenção dietética (93, 94).
É interessante notar que o perfil bioquímico endócrino observado em indivíduos durante a restrição calórica é comparável ao dos centenários, o que confirma o papel potencial do sistema endócrino na modulação da expectativa de vida. Além de aumentar a sensibilidade à insulina e diminuir os níveis séricos de IGF-1 no plasma / soro, vários estudos demonstraram níveis aumentados de adiponectina circulante e níveis reduzidos de leptina e hormônios tireoidianos circulantes em pessoas com vida longa em comparação com indivíduos mais jovens.
O tecido adiposo é um órgão endócrino que produz várias citocinas envolvidas em processos relevantes, como metabolismo energético, homeostase de lipídios e glicose e modulação da resposta inflamatória. O tecido adiposo visceral desempenha um papel importante no desenvolvimento de doenças metabólicas (95). O envelhecimento está associado ao aumento da massa gorda e à redistribuição do tecido adiposo, caracterizada por uma perda de gordura subcutânea periférica e um acúmulo de gordura visceral. Em idosos, alterações na secreção, síntese e função das adipocinas foram descritas, provavelmente devido a um desequilíbrio na função, proliferação, tamanho e número de células adiposas (86). A adiponectina é uma citocina sensibilizante à insulina, anti-inflamatória e antiaterogênica. A adiponectina circula no sangue de várias formas: trímero, hexâmero, multímero de alto peso molecular (HMW) e adiponectina globular (forma proteoliticamente clivada). Acredita-se que o multímetro HMW seja uma forma mais ativa de adiponectina para proteção contra resistência à insulina e diabetes (96). A adiponectina em circulação está independentemente e negativamente associada a aspectos da síndrome metabólica, incluindo resistência à insulina, peso corporal, pressão arterial e lipídios séricos. A leptina é produzida principalmente no subcutâneo e, em menor grau, no tecido adiposo branco visceral. Essa citocina regula a ingestão de alimentos, gasto de energia e aterogênese. A leptina promove a perda de peso, reduzindo o apetite e estimulando o metabolismo e possui propriedades pró-inflamatórias (97).
Vários estudos relataram que os fígados longos têm níveis mais altos de adiponectina no plasma e menores concentrações de leptina do que os controles mais jovens (53, 98 - 102). Todas as formas de adiponectina aumentaram significativamente em fígados longos, mas o HMW multímero foi significativamente maior (99). Em fígados longos, altas concentrações de adiponectina se mostraram independentes do IMC, da função renal ou cardiovascular e foram associadas a um fenótipo metabólico favorável (níveis mais altos de HDL-C, menor hemoglobina glicada, insulina, HOMA-IR e triglicerídeos) (98, 99). Níveis elevados de adiponectina também foram encontrados na prole de indivíduos com vida longa (acima de 95 anos) (103).
Uma diminuição no nível de hormônios da tireóide é aparentemente característica dos fígados longos. Mariotti et al. (104) relataram que centenários saudáveis apresentaram níveis séricos mais baixos de TSH e FT3 e níveis mais altos de rT3 sérico em comparação aos observados em outros grupos controle. Em outra população italiana de fígados longos, os valores totais de T4 estavam abaixo da faixa normal em 60% dos examinados (105). Baranovskaya et al. relataram que os níveis séricos de T3 em centenários eram inferiores aos de idosos e mulheres jovens (52). Recentemente, caracterizamos o perfil da função tireoidiana em uma coorte italiana de 672 pacientes (52 a 113 anos). Observou-se uma diminuição relacionada à idade no nível de FT3 e nas relações FT3 / FT4, enquanto FT4 e TSH aumentam com a idade (106). Nas famílias de centenários chineses, uma diminuição da função tireoidiana (TSH alto e baixa concentração de FT3) parece estar relacionada à idade, e esse fenótipo é hereditário (107).
Corsonello et al. (108) encontraram parentes concomitantes (descendentes ou sobrinhos / sobrinhos) com doenças concomitantes mais baixas, níveis de FT3, FT4 e TSH do que controles pareados por idade que não eram parentes de fígados longos. Em outra população italiana, um nível mais baixo de FT4 plasmático foi observado em descendentes de fígados longos em comparação com um grupo controle da mesma idade (60).
Em geral, os fígados longos são magros (109) e aderem a hábitos alimentares saudáveis (110). Semelhante aos indivíduos durante a restrição calórica, os fígados longos observaram crescimento / metabolismo celular mais lento, melhor controle da transmissão do sinal e aumento da autofagia. Através da análise da metilação do DNA em todo o genoma em centenários e seus descendentes, identificamos genes e caminhos epigeneticamente modulados que estão potencialmente envolvidos no envelhecimento e na longevidade. Nossos resultados indicam que essas populações foram caracterizadas por uma melhor conservação do status de metilação do DNA, crescimento / metabolismo celular mais lento e melhor controle da transmissão do sinal através de mecanismos epigenéticos (111). Os fígados longos mantêm sua função bioenergética devido à hipertrofia mitocondrial, que pode compensar defeitos funcionais (112). Além disso, os fígados longos saudáveis apresentam altos níveis de autofagia, como evidenciado pelos níveis séricos de beclin-1 séricos em comparação com pacientes jovens com infarto do miocárdio e controles saudáveis (113). Também foi observado aumento da atividade autofágica em indivíduos pertencentes a famílias com longevidade excepcional (114).
O fenômeno correspondente surge em relação ao estado inflamatório, que enfraquece nos indivíduos após a restrição calórica (115, 116) e é alto nos fígados longos (117 - 119). Com o envelhecimento, há um estado de patologia inflamatória leve e crônica (inflamação relacionada à idade) e uma prevalência aumentada de várias doenças, como doenças cardiovasculares, aterosclerose, tumores, comprometimento cognitivo, osteoartrite e diabetes (120, 121). Portanto, o enfraquecimento do estado inflamatório crônico após a restrição calórica é um efeito benéfico. Centenários do centenário mostram sinais de inflamação, mas ao mesmo tempo, ao que parece, poupou seus efeitos nocivos. Esse paradoxo óbvio pode ser explicado pelo fato de que os fígados longos têm um equilíbrio complexo e peculiar entre fatores pró-inflamatórios e anti-inflamatórios, o que leva a um desenvolvimento mais lento, mais limitado e equilibrado da inflamação em comparação com pessoas mais velhas, caracterizadas por uma resposta ineficaz para combater a inflamação crônica (120). 121).
Esses dados sugerem os mecanismos gerais para aumentar a longevidade e retardar as doenças relacionadas à idade encontradas em fígados e mamíferos durante uma dieta restrita em calorias.
Opinião dos autores.Os modelos pré-clínicos forneceram uma visão mais profunda do processo de envelhecimento usando dados consistentes que levam em consideração o papel do sistema GH / IGF-1 / insulina na modulação da expectativa de vida. Embora seja sabido que o aumento da sensibilidade à insulina e os baixos níveis de insulina estão associados à melhora da sobrevida, há algumas evidências mostrando que um enfraquecimento do eixo GH / IGF-1 pode ter um efeito benéfico no aumento da expectativa de vida em humanos. No entanto, ainda não se sabe quais são os níveis ideais de IGF-1 ao longo da vida para viver mais e ser mais saudável. Além disso, a sensibilidade do receptor IGF-1 e a ativação da via pós-receptor não foram avaliadas na maioria dos estudos envolvendo indivíduos de longa duração. Portanto, não é possível determinar o estado real da ativação da sinalização do receptor de IGF-1 por uma dose simples dos níveis circulantes de IGF-1. Isso dificulta a identificação de estratégias farmacológicas ou ambientais direcionadas a esse sistema para aumentar a longevidade e promover o envelhecimento saudável. Uma compreensão abrangente desses aspectos continua sendo o principal problema para identificar intervenções destinadas a retardar o envelhecimento humano e para uso em medicina de reabilitação. Estudos futuros devem avaliar o estado funcional da sinalização do receptor de IGF-1, inclusive através de perfis de transcrição e análise de redes funcionais em relação aos genes regulados por IGF-1 em indivíduos de longa duração.
ConclusõesSemelhanças marcantes foram descritas com relação ao perfil endócrino entre fígados longos e indivíduos após uma dieta restrita em calorias. A adaptação endócrina e metabólica observada em ambos os modelos pode ser uma estratégia fisiológica para aumentar a expectativa de vida devido ao crescimento / metabolismo celular mais lento, perda mais lenta da reserva fisiológica natural, transição do metabolismo celular da proliferação celular para atividade regenerativa e redução do acúmulo de células em envelhecimento. Aparentemente, esses mecanismos, pelo menos parcialmente, são mediados pela modulação do sistema GH / IGF-1 / insulina.
Referências- Franceschi C, Valensin S, Bonafè M, Paolisso G, Yashin AI, Monti D, et al .. A rede e as teorias de remodelação do envelhecimento: antecedentes históricos e novas perspectivas. Exp Gerontol. (2000) 35: 879-96. 10.1016 / S0531-5565 (00) 00172-8.
- Bartke A, Darcy J. GH e envelhecimento: armadilhas e novas idéias. Best Pract Res Clin Endocrinol Metab. (2017) 31: 113–25. 10.1016 / j.beem.2017.02.005
- Vitale G, Salvioli S, Franceschi C. Estresse oxidativo e envelhecimento do sistema endócrino. Nat Rev Endocrinol. (2013) 9: 228–40. 10.1038 / nrendo.2013.29
- Vitale G, Cesari M, Mari D. Envelhecimento do sistema endócrino e seu potencial impacto na sarcopenia. Eur J Intern Med. (2016) 35: 10-15. 10.1016 / j.ejim.2016.07.017
- Reddy SSK, Chaiban JT. A endocrinologia do envelhecimento: uma chave para a longevidade “grandes expectativas”. Endocr Pract. (2017) 23: 1107–16. 10.4158 / EP171793.RA
- Junnila RK, lista EO, Berryman DE, Murrey JW, Kopchick JJ. O eixo GH / IGF-1 em envelhecimento e longevidade. Nat Rev Endocrinol. (2013) 9: 366–76. 10.1038 / nrendo.2013.67
- Yakar S, Adamo ML. Fisiologia do fator de crescimento 1 semelhante à insulina: lições dos modelos de camundongos. Endocrinol Metab Clin North Am. (2012) 41: 231–47. 10.1016 / j.ecl.2012.04.008 [artigo livre do PMC] [PubMed] [CrossRef] [Google Scholar]
- Higashi Y, Sukhanov S, Anwar A, Shai SY, Delafontaine P. IGF-1, estresse oxidativo e ateroproteção. Tendências Endocrinol Metab. (2010) 21: 245-54. 10.1016 / j.tem.2009.12.005 [artigo livre do PMC] [PubMed] [CrossRef] [Google Scholar]
- Belfiore A, Malaguarnera R, Vella V, Lawrence MC, Sciacca L, Frasca F, et al .. Isoformas de receptores de insulina em fisiologia e doença: uma visão atualizada. Endocr rev. (2017) 38: 379-431. 10.1210 / er.2017-00073 [artigo livre do PMC] [PubMed] [CrossRef] [Google Scholar]
- Kenyon C, Chang J, Gensch E, Rudner A, Tabtiang RAC ... mutante elegans que vive duas vezes mais que o tipo selvagem. Nature (1993) 366: 461-4. 10.1038 / 366461a0 [PubMed] [CrossRef] [Google Scholar]
- Kimura KD, Tissenbaum HA, Liu Y, Ruvkun G. Daf-2, um gene semelhante ao receptor de insulina que regula a longevidade e a diapausa em Caenorhabditis elegans. Science (1997) 277: 942-6. 10.1126 / science.277.5328.942 [PubMed] [CrossRef] [Google Scholar]
- Tatar M, Kopelman A, Epstein D, Tu MP, Yin CM, Garofalo RS, et al .. Um homólogo mutante do receptor de insulina Drosophila que prolonga a vida útil e prejudica a função neuroendócrina. Science (2001) 292: 107-10. 10.1126 / science.1057987 [PubMed] [CrossRef] [Google Scholar]
- Clancy DJ, Gems D, Harshman LG, Oldham S, Stocker H, Hafen E, et al .. Extensão do tempo de vida pela perda de CHICO, uma proteína substrato do receptor de insulina de Drosophila. Science (2001) 292: 104-6. 10.1126 / science.1057991 [PubMed] [CrossRef] [Google Scholar]
- Libina N, Berman JR, Kenyon C. Atividades específicas de tecidos de C. elegans DAF-16 na regulação da vida útil. Cell (2003) 115: 489-502. 10.1016 / S0092-8674 (03) 00889-4 [PubMed] [CrossRef] [Google Scholar]
- Broughton S, Partridge L. Sinalização tipo insulina / IGF, sistema nervoso central e envelhecimento. Biochem J. (2009) 418: 1-12. 10.1042 / BJ20082102 [PubMed] [CrossRef] [Google Scholar]
- Reindl KM, Sheridan, MA. Regulação periférica do sistema de fator de crescimento semelhante ao hormônio do crescimento insulina em peixes e outros vertebrados. Comp Biochem Physiol Mol Mol Physiol. (2012) 163: 231–45. 10.1016 / j.cbpa.2012 / 08 / 08.003 [PubMed] [CrossRef] [Google Scholar]
- Snell GD. Anão, um novo personagem mendeliano recessivo do rato doméstico. Proc Natl Acad Sci USA. (1929) 15: 733-4. 10.1073 / pnas.15.9.733 [artigo livre do PMC] [PubMed] [CrossRef] [Google Scholar]
- Berryman D, Christiansen JS, Johannsson G, Thorner MO, Kopchick JJ. Papel do eixo GH / IGF-1 na vida útil e na saúde: lições de modelos animais. Horm de crescimento IGF Res. (2008) 18: 455–71. 10.1016 / j.ghir.2008.05.005 [artigo livre do PMC] [PubMed] [CrossRef] [Google Scholar]
- Flurkey K, Papaconstantinou J, Miller RA, Harrison DE. Extensão da vida útil e envelhecimento retardado do sistema imunológico e do colágeno em camundongos mutantes com defeitos na produção do hormônio do crescimento. Proc Natl Acad Sci USA. (2001) 98: 6736-41. 10.1073 / pnas.111158898 [artigo livre do PMC] [PubMed] [CrossRef] [Google Scholar]
- Brown-Borg HM, Borg KE, Meliska CJ, Bartke A. Camundongos anões e o processo de envelhecimento. Nature (1996) 384: 33. 10.1038 / 384033a0 [PubMed] [CrossRef] [Google Scholar]
- Bartke A, Wright JC, Mattison JA, Ingram DK, Miller RA, Roth GS. Prolongando a vida útil dos ratos de longa duração. Nature (2001) 414: 412. 10.1038 / 35106646 [PubMed] [CrossRef] [Google Scholar]
- Panici JA, Harper JM, Miller RA, Bartke A, Spong A, Masternak MM. O tratamento com hormônio de crescimento precoce reduz a longevidade e diminui a resistência ao estresse celular em camundongos mutantes de vida longa. FASEB J. (2010) 24: 5073–9. 10.1096 / fj.10-163253 [artigo livre do PMC] [PubMed] [CrossRef] [Google Scholar]
- Sun LY, Spong A, Swindell WR, Fang Y, Hill C, Huber JA, et al .. A interrupção do hormônio liberador do hormônio do crescimento prolonga a vida útil e regula a resposta à restrição calórica em camundongos. Elife (2013) 2: e01098. 10.7554 / eLife.01098 [artigo livre do PMC] [PubMed] [CrossRef] [Google Scholar]
- Coschigano KT, Clemmons D, Bellush LL, Kopchick JJ. Avaliação de parâmetros de crescimento e tempo de vida de camundongos com interrupção do gene GHR / BP. Endocrinology (2000) 141: 2608-13. 10.1210 / endo.141.7.7586 [PubMed] [CrossRef] [Google Scholar]
- Ikeno Y, Hubbard GB, Lee S, Cortez LA, Lew CM, Webb CR, et al. Incidência reduzida e ocorrência tardia de doenças neoplásicas fatais em camundongos knockout para receptores de hormônio do crescimento / proteínas de ligação. J Gerontol A Biol Sei Med Sei. (2009) 64: 522-9. 10.1093 / gerona / glp017 [Artigo livre de PMC] [PubMed] [CrossRef] [Google Scholar]
- Gesing A, Wiesenborn D, Do A, Menon V, Schneider A, Victoria B, et al .. Um camundongo de longa duração sem hormônio de crescimento e receptor de hormônio de crescimento: um novo modelo animal para estudos de envelhecimento. J Gerontol A Biol Sei Med Sei. (2017) 72: 1054–61. 10.1093 / gerona / glw193 [Artigo livre de PMC] [PubMed] [CrossRef] [Google Scholar]
- Bonkowski MS, Rocha JS, Masternak MM, Al Regaiey KA, Bartke A. A interrupção direcionada do receptor do hormônio do crescimento interfere nas ações benéficas da restrição calórica. Proc Natl Acad Sci USA. (2006) 103: 7901-5. 10.1073 / pnas.0600161103 [artigo livre do PMC] [PubMed] [CrossRef] [Google Scholar]
- Coschigano KT, Holanda AN, Riders ME, Lista EO, Flyvbjerg A, Kopchick JJ. A eliminação, mas não o antagonismo, do receptor da hormona de crescimento do rato resulta em pesos corporais severamente reduzidos, insulina e níveis de fator de crescimento tipo insulina I e aumento da vida útil. Endocrinology (2003) 144: 3799-810. 10.1210 / en.2003-0374 [PubMed] [CrossRef] [Google Scholar]
- Holzenberger M, Dupont J, Ducos B, Leneuve P, Géloën A, Even PC, et al. O receptor IGF-1 regula a vida útil e a resistência ao estresse oxidativo em camundongos. Nature (2003) 421: 182–7. 10.1038 / nature01298 [PubMed] [CrossRef] [Google Scholar]
- Bokov AF, Garg N, Ikeno Y, Thakur S, Musi N, DeFronzo RA, et al .. A redução da sinalização de IGF-1R em camundongos Igf1r +/− altera o envelhecimento? Plos ONE (2011) 6: e26891. 10.1371 / journal.pone.0026891 [Artigo livre do PMC] [PubMed] [CrossRef] [Google Scholar]
- Xu J, Gontier G, Chaker Z, Lacube P, Dupont J, Holzenberger M. O efeito da longevidade da mutação IGF-1R +/− depende da ativação do receptor genético específico do fundo. Aging Cell (2014) 13: 19–28. 10.1111 / acel.12145 [Artigo livre do PMC] [PubMed] [CrossRef] [Google Scholar]
- Mulvey L, Sinclair A, Selman C. Modulação do tempo de vida em camundongos e os efeitos confusos do fundo genético. J Genet Genomics (2014) 41: 497-503. 10.1016 / j.jgg.2014.06.002 [artigo livre do PMC] [PubMed] [CrossRef] [Google Scholar]
- Kappeler L, De Magalhães Filho C, Dupont J, Leneuve P, Cervera P, Périn L, et al .. Os receptores IGF-1 cerebrais controlam o crescimento e a vida útil dos mamíferos através de um mecanismo neuroendócrino. PLOS Biol. (2008) 6: e254. 10.1371 / journal.pbio.0060254tt [artigo livre do PMC] [PubMed] [CrossRef] [Google Scholar]
- Svensson J, Sjögren K, Fäldt J, Andersson N, Isaksson O, Jansson JO, et al. O IGF-1 derivado do fígado regula o tempo médio de vida em ratos. PLoS ONE (2011) 6: e22640 10.1371 / journal.pone.0022640 [Artigo livre do PMC] [PubMed] [CrossRef] [Google Scholar]
- Conover CA, Bale LK. A perda de proteína A plasmática associada à gravidez prolonga a vida útil dos ratos. Aging Cell (2007) 6: 727–9. 10.1111 / j.1474-9726.2007.00328.x [PubMed] [CrossRef] [Google Scholar]
- Conover CA. Role of PAPP-A in aging and age-related disease. Exp Gerontol. (2013) 48:612–3. 10.1016/j.exger.2012.06.017 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Selman C, Lingard S, Choudhury AI, Batterham RL, Claret M, Clements M, et al.. Evidence for lifespan extension and delayed age-related biomarkers in insulin receptor substrate 1 null mice. FASEB J. (2008) 22:807–18. 10.1096/fj.07-9261com [PubMed] [CrossRef] [Google Scholar]
- Taguchi A, Wartschow LM, White MF. Brain IRS2 signaling coordinates life span and nutrient homeostasis. Science (2000) 317:369–72. 10.1126/science.1142179 [PubMed] [CrossRef] [Google Scholar]
- Kuro M, Matsumura Y, Aizawa H, Kawaguchi H, Suga T, Utsugu T, et al. Mutation of the mouse Klotho gene leads to a syndrome resembling ageing. Nature (1997) 390:45–51. 10.1038/36285 [PubMed] [CrossRef] [Google Scholar]
- Kurosu H, Yamamoto M, Clark JD, Pastor JV, Nandi A, Gurnani P, et al.. Suppression of aging in mice by the hormone Klotho. Science (2005) 309:1829–33. 10.1126/science.1112766 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Migliaccio E, Giorgio M, Mele S, Pelicci G, Reboldi P, Pandolfi PP, et al. The p66 Shc adaptor protein controls oxidative stress response and life span in mammals. Nature (1999) 402:309–13. 10.1038/46311 [PubMed] [CrossRef] [Google Scholar]
- Ramsey JJ, Tran D, Giorgio M, Griffey SM, Koehne A, Laing ST, et al.. The influence of Shc proteins on life span in mice. J Gerontol A Biol Sci Med Sci. (2014) 69:1177–85. 10.1093/gerona/glt198 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ashpole NM, Logan S, Yabluchanskiy A, Mitschelen MC, Yan H, Farley JA, et al.. IGF-1 has sexually dimorphic, pleiotropic, and time-dependent effects on healthspan, pathology, and lifespan. Geroscience (2017) 39:129–45. 10.1007/s11357-017-9971-0 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mao K, Quipildor GF, Tabrizian T, Novaj A, Guan F, Walters RO, et al.. Late-life targeting of the IGF-1 receptor improves healthspan and lifespan in female mice. Nat Commun. (2018) 9:2394. 10.1038/s41467-018-04805-5 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Passarino G, Mari D, Monti D. Centenarians as a 21st century healthy aging model: a legacy of humanity and the need for a world-wide consortium (WWC100+). Mech Ageing Dev. (2017) 165(Pt. B):55–8. 10.1016/j.mad.2017.06.002 [PubMed] [CrossRef] [Google Scholar]
- Vitale G, Barbieri M, Kamenetskaya M, Paolisso G. GH/IGF-I/insulin system in centenarians. Mech Ageing Dev. (2017) 165:107–114. 10.1016/j.mad.2016.12.001 [PubMed] [CrossRef] [Google Scholar]
- Ferrannini E, Vichi S, Beck-Nielsen H, Laasko M, Paolisso G, Smith U. For European Group for the Study of Insulin Resistance (EGIR). Insulin action and age. Diabetes (1996) 45:947–53. 10.2337/diab.45.7.947 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Barbieri M, Rizzo MR, Carella C, Rotondi M, Bonafè M, et al. Low insulin resistance and preserved beta-cell function contribute to human longevity but are not associated with TH-INS genes. Exp Gerontol. (2001) 37:149–56. 10.1016/S0531-5565(01)00148-6 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Gambardella A, Ammendola S, D'Amore A, Balbi V, Varricchio M, et al.. Glucose tolerance and insulin action in healty centenarians. Am J Physiol. (1996) 270:E890–4. 10.1152/ajpendo.1996.270.5.E890 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Gambardella A, Ammendola S, Tagliamonte MR, Rizzo MR, Capurso A, et al.. Preserved antilipolytic insulin action is associated with a less atherogenic plasma lipid profile in healthy centenarians. J Am Geriatr Soc. (1997) 45:1504–9. 10.1111/j.1532-5415.1997.tb03203.x [PubMed] [CrossRef] [Google Scholar]
- Vitale G, Brugts M, Ogliari G, Castaldi D, Fatti L, Varewijck A, et al.. Low circulating IGF-I bioactivity is associated with human longevity: findings in centenarians' offspring. Aging (2012) 4:580–89. 10.18632/aging.100484 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Baranowska B, Wolinska-Witort E, Bik W, Baranowska-Bik A, Martynska L, Broczek K, et al.. Evaluation of neuroendocrine status in longevity. Neurobiol Aging (2007) 28:774–83. 10.1016/j.neurobiolaging.2006.03.014 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Manzella D, Barbieri M, Rizzo MR, Gambardella A, Varricchio M. Baseline heart rate variability in healthy centenarians: differences vs. aged subject. Clin. Sci. (1999) 97:579–84. 10.1042/cs0970579 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Tagliamonte MR, Rizzo MR, Carella C, Gambardella A, Barbieri M, et al. Low plasma Insulin like growth factor-1 concentrations predict worsening of insulin mediated glucose uptake in the elderly. J. Am. Geriatr. Soc. (1999) 47:1312–8. 10.1111/j.1532-5415.1999.tb07431.x [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Ammendola S, Del Buono A, Gambardella A, Riondino M, Tagliamonte MR, et al.. Serum levels of insulin-like growth factor-I (IGF-I) and IGF-binding protein-3 in healthy centenarians: relationship with plasma leptin and lipid concentrations, insulin action, and cognitive function. J Clin Endocrinol Metab. (1997) 82:2204–9. 10.1210/jcem.82.7.4087 [PubMed] [CrossRef] [Google Scholar]
- Bonafè M, Barbieri M, Marchegiani F, Olivieri F, Ragno E, Giampieri C, et al.. Polymorphic variants of insulin-like growth factor I (IGF-I) receptor and phosphoinositide 3-kinase genes affect IGF-I plasma levels and human longevity: cues for an evolutionarily conserved mechanism of life span control. J Clin Endocrinol Metab. (2003) 88:3299–304. 10.1210/jc.2002-021810 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Hirose N, Yamamura K, Shimizu K, Takayama M, Ebihara Y, et al.. Serum insulin-like growth factor-1 in centenarians: implications of IGF-1 as a rapid turnover protein. J Gerontol A Biol Sci Med Sci. (2001) 56:M79–82. 10.1093/gerona/56.2.M79 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Takayama M, Gondo Y, Inagaki H, Yamamura K, Nakazawa S, et al.. Adipose endocrine function, insulin-like growth factor-1 axis, and exceptional survival beyond 100 years of age. J Gerontol A Biol Sci Med Sci. (2008) 63:1209–18. 10.1093/gerona/63.11.1209 [PubMed] [CrossRef] [Google Scholar]
- Herr M, Jeune B, Fors S, Andersen-Ranberg K, Ankri J, Arai Y, et al.. Frailty and associated factors among centenarians in the 5-COOP countries. Gerontology (2018) 64:521–31. 10.1159/000489955 [PubMed] [CrossRef] [Google Scholar]
- Bucci L, Ostan R, Cevenini E, Pini E, Scurti M, Vitale G, et al.. Centenarians' offspring as a model of healthy aging: a reappraisal of the data on Italian subjects and a comprehensive overview. Aging (Albany. NY). (2016) 8:1–11. 10.18632/aging.100912 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Gueresi P, Miglio R, Monti D, Mari D, Sansoni P, Caruso C, et al.. Does the longevity of one or both parents influence the health status of their offspring? Exp Gerontol. (2013) 48:395–400. 10.1016/j.exger.2013.02.004 [PubMed] [CrossRef] [Google Scholar]
- Horvath S, Pirazzini C, Bacalini MG, Gentilini D, Di Blasio AM, Delledonne M, et al.. Decreased epigenetic age of PBMCs from Italian semi-supercentenarians and their offspring. Aging (2015) 7:1159–70. 10.18632/aging.100861 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Caselli G, Pozzi L, Vaupel JW, Deiana L, Pes G, Carru C, et al.. Family clustering in Sardinian longevity: a genealogical approach. Exp Gerontol. (2006) 41:727–36. 10.1016/j.exger.2006.05.009 [PubMed] [CrossRef] [Google Scholar]
- Suh Y, Atzmon G, Cho MO, Hwang D, Liu B, Leahy DJ, et al.. Functionally significant insulin-like growth factor I receptor mutations in centenarians. Proc Natl Acad Sci USA. (2008) 105:3438–42. 10.1073/pnas.0705467105 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Deelen J, van den Akker EB, Trompet S, van Heemst D, Mooijaart SP, Slagboom PE, Beekman M. Employing biomarkers of healthy ageing for leveraging genetic studies into human longevity. Exp Gerontol. (2016) 82:166–74. 10.1016/j.exger.2016.06.013 [PubMed] [CrossRef] [Google Scholar]
- van der Spoel E, Rozing MP, Houwing-Duistermaat JJ, Slagboom PE, Beekman M, de Craen AJ, et al.. Association analysis of insulin-like growth factor-1 axis parameters with survival and functional status in nonagenarians of the Leiden Longevity Study. Aging (2015) 7:956–63. 10.18632/aging.100841 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Rozing MP, Westendorp RG, Frölich M, de Craen AJ, Beekman M, Heijmans BT, et al.. Human insulin/IGF-1 and familial longevity at middle age. Aging (2009) 1:714–22. 10.18632/aging.100071 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- van der Spoel E, Jansen SW, Akintola AA, Ballieux BE, Cobbaert CM, Slagboom PE, et al.. Growth hormone secretion is diminished and tightly controlled in humans enriched for familial longevity. Aging Cell (2016) 15:1126–31. 10.1111/acel.12519 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sebastiani P, Sun FX, Andersen SL, Lee JH, Wojczynski MK, Sanders JL, et al.. Families enriched for exceptional longevity also have increased health-span: findings from the long life family study. Front Public Health (2013) 1:38. 10.3389/fpubh.2013.00038 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sebastiani P, Thyagarajan B, Sun F, Honig LS, Schupf N, Cosentino S, et al.. Age and sex distributions of age-related biomarker values in healthy older adults from the long life family study. J Am Geriatr Soc. (2016) 64:e189–94. 10.1111/jgs.14522 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Teumer A, Qi Q, Nethander M, Aschard H, Bandinelli S, Beekman M, et al.. Genomewide meta-analysis identifies loci associated with IGF-I and IGFBP-3 levels with impact on age-related traits. Aging Cell (2016) 15:811–24. 10.1111/acel.12490 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Deelen J, Uh HW, Monajemi R, van Heemst D, Thijssen PE, Böhringer S, et al.. Gene set analysis of GWAS data for human longevity highlights the relevance of the insulin/IGF-1 signaling and telomere maintenance pathways. Age (2013) 35:235–49. 10.1007/s11357-011-9340-3 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- van Heemst D, Beekman M, Mooijaart SP, Heijmans BT, Brandt BW, Zwaan BJ, et al.. Reduced insulin/IGF-1 signalling and human longevity. Aging Cell (2005) 4:79–85. 10.1111/j.1474-9728.2005.00148.x [PubMed] [CrossRef] [Google Scholar]
- Ben-Avraham D, Govindaraju DR, Budagov T, Fradin D, Durda P, Liu B, et al.. The GH receptor exon 3 deletion is a marker of male-specific exceptional longevity associated with increased GH sensitivity and taller stature. Sci Adv. (2017) 3:e1602025. 10.1126/sciadv.1602025 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- McKiernan SH, Colman RJ, Lopez M, Beasley TM, Aiken JM, Anderson RM, et al.. Caloric restriction delays aging-induced cellular phenotypes in rhesus monkey skeletal muscle. Exp Gerontol. (2011) 46:23–9. 10.1016/j.exger.2010.09.011 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Colman RJ, Anderson RM, Johnson SC, Kastman EK, Kosmatka KJ, Beasley TM, et al. Calorie restriction delays disease onset and mortality in rhesus monkeys. Science (2009) 325:201–4. 10.1126/science.1173635 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Willcox DC, Willcox BJ, Todoriki H, Curb JD, Suzuki M. Caloric restriction and human longevity: what can we learn from the Okinawans? Biogerontology (2006) 7:173–7. 10.1007/s10522-006-9008-z [PubMed] [CrossRef] [Google Scholar]
- Mattison JA, Roth GS, Beasley TM, Tilmont EM, Handy AM, Herbert RL, et al.. Impact of caloric restriction on health and survival in rhesus monkeys from the NIA study. Nature (2012) 489:318–21. 10.1038/nature11432 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Dunn SE, Kari FW, French J, Leininger JR, Travlos G, Wilson R, et al.. Dietary restriction reduces insulin-like growth factor I levels, which modulates apoptosis, cell proliferation, and tumor progression in p53-deficient mice. Cancer Res. (1997) 57:4667–72. [PubMed] [Google Scholar]
- Berrigan D, Perkins SN, Haines DC, Hursting SD. Adult-onset calorie restriction and fasting delay spontaneous tumorigenesis in p53-deficient mice. Carcinogenesis (2002) 23:817–22. 10.1093/carcin/23.5.817 [PubMed] [CrossRef] [Google Scholar]
- Redman LM, Veldhuis JD, Rood J, Smith SR, Williamson D, Ravussin E, et al.. The effect of caloric restriction interventions on growth hormone secretion in nonobese men and women. Aging Cell (2010) 9:32–9. 10.1111/j.1474-9726.2009.00530.x [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Fontana L, Villareal DT, Das SK, Smith SR, Meydani SN, Pittas AG, et al.. Effects of 2-year calorie restriction on circulating levels of IGF-1, IGF-binding proteins and cortisol in nonobese men and women: a randomized clinical trial. Aging Cell (2016) 15:22–7. 10.1111/acel.12400 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Lettieri-Barbato D, Giovannetti E, Aquilano K. Effects of dietary restriction on adipose mass and biomarkers of healthy aging in human. Aging (2016) 8:3341–55. 10.18632/aging.101122 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mercken EM, Crosby SD, Lamming DW, JeBailey L, Krzysik-Walker S, Villareal DT, et al.. Calorie restriction in humans inhibits the PI3K/AKT pathway and induces a younger transcription profile. Aging Cell (2013) 12:645–51. 10.1111/acel.12088 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Kojima T, Takayama M, Hirose N. The metabolic syndrome, IGF-1, and insulin action. Mol Cell Endocrinol. (2009) 299:124–8. 10.1016/j.mce.2008.07.002 [PubMed] [CrossRef] [Google Scholar]
- Redman LM, Ravussin E. Endocrine alterations in response to calorie restriction in humans. Mol Cell Endocrinol. (2009) 299:129–36. 10.1016/j.mce.2008.10.014 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Garagnani P, Vitale G, Capri M, Salvioli S. Inflammaging and 'Garb-aging'. Trends Endocrinol Metab. (2017) 28:199–212. 10.1016/j.tem.2016.09.005 [PubMed] [CrossRef] [Google Scholar]
- Qian M, Liu B. Pharmaceutical Intervention of Aging. Adv Exp Med Biol. (2018) 1086:235–54. 10.1007/978-981-13-1117-8_15 [PubMed] [CrossRef] [Google Scholar]
- Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, et al.. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature (2011) 479:232–6. 10.1038/nature10600 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Derous D, Mitchell SE, Wang L, Green CL, Wang Y, Chen L, et al.. The effects of graded levels of calorie restriction: XI. Evaluation of the main hypotheses underpinning the life extension effects of CR using the hepatic transcriptome. Aging (2017) 9:1770–824. 10.18632/aging.101269 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Madeo F, Tavernarakis N, Kroemer G. Can autophagy promote longevity? Nat Cell Biol. (2010) 12:842–6. 10.1038/ncb0910-842 [PubMed] [CrossRef] [Google Scholar]
- Cevenini E, Monti D, Franceschi C. Inflamm-ageing. Curr Opin Clin Nutr Metab Care. (2013) 16:14–20. 10.1097/MCO.0b013e32835ada13 [PubMed] [CrossRef] [Google Scholar]
- Meydani SN, Das SK, Pieper CF, Lewis MR, Klein S, Dixit VD, et al.. Long-term moderate calorie restriction inhibits inflammation without impairing cell-mediated immunity: a randomized controlled trial in non-obese humans. Aging (2016) 8:1416–31. 10.18632/aging.100994 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ott B, Skurk T, Hastreiter L, Lagkouvardos I, Fischer S, Büttner J, et al.. Effect of caloric restriction on gut permeability, inflammation markers, and fecal microbiota in obese women. Sci Rep. (2017) 7:11955. 10.1038/s41598-017-12109-9 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Unamuno X, Gómez-Ambrosi J, Rodríguez A, Becerril S, Frühbeck G, Catalán V. Adipokine dysregulation and adipose tissue inflammation in human obesity. Eur J Clin Invest. (2018) 48:e12997. 10.1111/eci.12997 [PubMed] [CrossRef] [Google Scholar]
- Liu M, Liu F. Regulation of adiponectin multimerization, signaling and function. Best Pract Res Clin Endocrinol Metab. (2014) 28:25–31. 10.1016/j.beem.2013.06.003 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Balaskó M, Soós S, Székely M, Pétervári E. Leptin and aging: Review and questions with particular emphasis on its role in the central regulation of energy balance. J Chem Neuroanat. (2014) 61–62:248–55. 10.1016/j.jchemneu.2014.08.006 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Nakazawa S, Kojima T, Takayama M, Abihara Y, Shimizu K, et al. High adiponectin concentration and its role for longevity in female centenarians. Geriatr Gerontol Int. (2006) 6:32–9. 10.1111/j.1447-0594.2006.00304.x [CrossRef] [Google Scholar]
- Bik W, Baranowska-Bik A, Wolinska-Witort E, Kalisz M, Broczek K, Mossakowska M, et al.. Assessment of adiponectin and its isoforms in Polish centenarians. Exp Gerontol. (2013) 48:401–7. 10.1016/j.exger.2013.01.015 [PubMed] [CrossRef] [Google Scholar]
- Meazza C, Vitale G, Pagani S, Castaldi D, Ogliari G, Mari D, et al.. Common adipokine features of neonates and centenarians. J Pediatr Endocrinol Metab. (2011) 24:953–7. 10.1515/JPEM.2011.373 [PubMed] [CrossRef] [Google Scholar]
- Baranowska B, Bik W, Baranowska-Bik A, Wolinska-Witort E, Szybinska A, Martynska L, et al.. Neuroendocrine control of metabolic homeostasis in Polish centenarians. J Physiol Pharmacol. (2006) 57 (Suppl. 6):55–61. [PubMed] [Google Scholar]
- Miura Y, Hashii N, Tsumoto H, Takakura D, Ohta Y, Abe Y, et al.. Change in N-glycosylation of plasma proteins in Japanese semisupercentenarians. PLoS ONE (2015) 10:e0142645. 10.1371/journal.pone.0142645 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Atzmon G, Pollin TI, Crandall J, Tanner K, Schechter CB, Scherer PE, et al.. Adiponectin levels and genotype: a potential regulator of life span in humans. J Gerontol A Biol Sci Med Sci. (2008) 63:447–53. 10.1093/gerona/63.5.447 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mariotti S, Barbesino G, Caturegli P, Bartalena L, Sansoni P, Fagnoni F, et al.. Complex alteration of thyroid function in healthy centenarians. J Clin. Endocrinol Metab. (1993) 77:1130–4. 10.1210/jcem.77.5.8077303 [PubMed] [CrossRef] [Google Scholar]
- Maugeri D, Russo MS, Di Stefano F, Receputo G, Rosso D, Rapisarda R, et al.. Thyroid function in healthy centenarians. Arch Gerontol Geriatr. (1997) 25:211–7. 10.1016/S0167-4943(97)00012-5 [PubMed] [CrossRef] [Google Scholar]
- Ostan R, Monti D, Mari D, Arosio B, Gentilini D, Ferri E, et al.. Heterogeneity of thyroid function and impact of peripheral thyroxine deiodination in centenarians and semi-supercentenarians: association with functional status and mortality. J Gerontol A Biol Sci Med Sci. (2018). 10.1093/gerona/gly194. [Epub ahead of print]. [PubMed] [CrossRef] [Google Scholar]
- He Y, Chen X, Yan D, Xiao F, Liu Y, Lin R, et al.. Thyroid function decreases with age and may contribute to longevity in chinese centenarians' families. JAGS (2015) 63:1474–6. 10.1111/jgs.13553 [PubMed] [CrossRef] [Google Scholar]
- Corsonello A, Montesanto A, Berardelli M, De Rango F, Dato S, Mari V, et al.. A cross-section analysis of FT3 age-related changes in a group of old and oldest-old subjects, including centenarians' relatives, shows that a down-regulated thyroid function has a familial component and is related to longevity. Age Ageing (2010) 39:723–7. 10.1093/ageing/afq116 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Pereira da Silva A, Matos A, Valente A, Gil Â, Alonso I, Ribeiro R, et al.. Body composition assessment and nutritional status evaluation in men and women portuguese centenarians. J Nutr Health Aging (2016) 20:256–66. 10.1007/s12603-015-0566-0 [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Ostan R, Santoro A. Nutrition and inflammation: are centenarians similar to individuals on calorie-restricted diets? Annu Rev Nutr. (2018) 38:329–56. 10.1146/annurev-nutr-082117-051637 [PubMed] [CrossRef] [Google Scholar]
- Gentilini D, Mari D, Castaldi D, Remondini D, Ogliari G, Ostan R, et al.. Role of epigenetics in human aging and longevity: genome-wide DNA methylation profile in centenarians and centenarians' offspring. Age (2013) 35:1961–73. 10.1007/s11357-012-9463-1 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sgarbi G, Matarrese P, Pinti M, Lanzarini C, Ascione B, Gibellini L, et al.. Mitochondria hyperfusion and elevated autophagic activity are key mechanisms for cellular bioenergetic preservation in centenarians. Aging (2014) 6:296–310. 10.18632/aging.100654 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Emanuele E, Minoretti P, Sanchis-Gomar F, Pareja-Galeano H, Yilmaz Y, Garatachea N, et al.. Can enhanced autophagy be associated with human longevity? Serum levels of the autophagy biomarker beclin-1 are increased in healthy centenarians. Rejuvenation Res. (2014) 17:518–24. 10.1089/rej.2014.1607 [PubMed] [CrossRef] [Google Scholar]
- Raz Y, Guerrero-Ros I, Maier A, Slagboom PE, Atzmon G, Barzilai N, et al.. Activation-induced autophagy is preserved in CD4+ T-cells in familial longevity. J Gerontol A Biol Sci Med Sci. (2017) 72:1201–6. 10.1093/gerona/glx020 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Fontana L, Villareal DT, Weiss EP, Racette SB, Steger-May K, et al. Calorie restriction or exercise: effects on coronary heart disease risk factors. A randomized, controlled trial. Am J Physiol Endocrinol Metab. (2007) 293:E197–202. 10.1152/ajpendo.00102.2007 [PubMed] [CrossRef] [Google Scholar]
- Ravussin E, Redman LM, Rochon J, Das SK, Fontana L, et al.. A 2-year randomized controlled trial of human caloric restriction: feasibility and effects on predictors of health span and longevity. J Gerontol A Biol Sci Med Sci. (2015) 70:1097–104. 10.1093/gerona/glv057 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Bruunsgaard H, Andersen-Ranberg K, Jeune B, Pedersen AN, Skinhoj P, Pedersen BK. A high plasma concentration of TNF-α is associated with dementia in centenarians. J Gerontol A Biol Sci Med Sci. (1999) 54:M357–64. 10.1093/gerona/54.7.M357 [PubMed] [CrossRef] [Google Scholar]
- Gangemi S, Basile G, Merendino RA, Minciullo PL, Novick D, et al.. Increased circulating interleukin-18 levels in centenarians with no signs of vascular disease: another paradox of longevity? Exp Gerontol. (2003) 38:669–72. 10.1016/S0531-5565(03)00061-5 [PubMed] [CrossRef] [Google Scholar]
- Gerli R, Monti D, Bistoni O, Mazzone AM, Peri G, et al.. Chemokines, sTNF-Rs and sCD30 serum levels in healthy aged people and centenarians. Mech. Ageing Dev. (2000) 121:37–46. 10.1016/S0047-6374(00)00195-0 [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Capri M, Monti D, Giunta S, Olivieri F, Sevini F, et al.. Inflammaging and anti-inflammaging: a systemic perspective on aging and longevity emerged from studies in humans. Mech Ageing Dev. (2007) 128:92–105. 10.1016/j.mad.2006.11.016 [PubMed] [CrossRef] [Google Scholar]
- Salvioli S, Monti D, Lanzarini C, Conte M, Pirazzini C, Bacalini MG, et al.. Immune system, cell senescence, aging and longevity–inflamm-aging reappraised. Curr Pharm Des. (2013) 19:1675–9. 10.2174/1381612811319090015