
O que lembramos com a frase "ficção científica"? É claro, robôs, carros voadores, o estudo de cantos inexplorados do Universo, alienígenas e toda uma série de conspirações. Entre eles, um lugar especial sempre foi ocupado pelo tema de estabelecer outro planeta, seja pela confiança na inevitabilidade da própria morte, seja pelo desejo de mudar radicalmente a situação. O primeiro candidato ao título da Terra 2.0 sempre foi Marte, frio e sem vida. No momento, ainda não é possível fazer as malas e voar para Marte em férias por duas semanas, mas isso é absolutamente realista e viável, a questão é apenas em quanto tempo. O sinal menos visível de Marte (com exceção da falta de uma Internet normal) é a falta de uma atmosfera aceitável para a vida. Para voar para o destino, saia da aeronave e respire fundo, sentindo toda a frescura do ar local - não se trata de Marte. Mas isso nem sempre será.
Hoje, encontraremos um estudo que descreve um novo método para gerar oxigênio através de uma reação química incomum. Como os cientistas produziram oxigênio molecular a partir do CO
2 , qual é a eficácia desse método e onde ele pode ser usado, além de viagens interplanetárias? Procuraremos respostas para essas perguntas no relatório dos cientistas. Vamos lá
Base de estudo
Uma pessoa precisa apenas de três coisas para a vida: comida, água e ar, nas quais haverá oxigênio suficiente. Essas são as nossas principais necessidades (sim, a Internet não está nesta lista). Mas o oxigênio simplesmente não está na estrada, principalmente fora do nosso amado planeta. Portanto, se queremos ir a algum lugar, precisamos levá-lo conosco e usar vários dispositivos para limpar o ar e reutilizá-lo. Toda essa alegria ocupa muitos lugares, e mais cedo ou mais tarde o oxigênio estará esgotado. E reabastecer reservas no espaço ou em Marte será, para dizer o mínimo, problemático.
No entanto, recentemente, os cientistas descobriram uma quantidade bastante grande de oxigênio no cometa 67P / CG6, o que os levou a fazer uma pergunta muito óbvia - de onde veio? O oxigênio em corpos como os cometas é o resultado de uma reação abiótica que ocorre sob condições extremas, durante as quais H
2 O, CO
2 , CO, etc. O
2 (oxigênio) é liberado. Os cientistas afirmam que essas reações podem explicar a presença de oxigênio nos cometas, na atmosfera superior de Marte e na atmosfera primitiva da Terra. Uma pessoa pode usar essa reação química para produzir O
2 a partir de CO
2 , o que tornará Marte adequado para a vida.
Se muito exagerada e breve, a reação mencionada acima é a decomposição do CO
2 em componentes: C + O
2 . Em outras palavras, dissociação.
A dissociação de CO
2 pode ocorrer em vários cenários, dependendo da energia disponível para a reação. A dissociação parcial de CO
2 → CO + O (5,43 ou 7,56 eV) requer menos energia. Há também uma dissociação completa de CO
2 → C + O + O, exigindo 16,46 eV. E a dissociação mais curiosa e exótica é quando o CO
2 se decompõe em C e O
2 . Os cálculos mostram que uma reação semelhante ocorre na superfície da energia potencial do estado fundamental, formando primeiro um composto intermediário de CO
2 cíclico [c-CO
2 (
1 A
1 )], que depois se transforma em um COO intermediário colinear (
1 Σ
+ ) a caminho da dissociação em C + O
2 .
Essa reação é possível se a molécula for "dobrada", de modo que os dois átomos de O se tornem o mais próximo possível um do outro. Isso requer 6 eV de energia interna. E, você deve admitir, não importa quão fortes os homens dobrem as hastes de metal, será muito mais difícil dobrar uma molécula.
Transições para estados aniônicos e eletronicamente excitados de CO
2 podem ajudar a dobrar a molécula. Os cientistas lembram que experimentos recentes de seus colegas mostraram que o uso de fotoexcitação VUV (ultravioleta a vácuo) e adição de elétrons permite a dissociação de CO
2 a C (
3 P) + O
2 (X
3 Σ
g -). No entanto, ninguém estudou esse processo exótico em um nível suficientemente detalhado. E tudo porque, como resultado de tais experimentos, não foram encontrados produtos de O2 ionizados. Mas, como sabemos, não encontrar algo não significa que não esteja.
Portanto, no estudo que estamos examinando hoje, os cientistas aplicaram métodos de espalhamento de feixe de íons juntamente com modelagem matemática para demonstrar uma nova maneira de ativar a redução direta de CO
2 a O
2 com a detecção de produtos de O
2 ionizados. Esse processo contém uma via de reação intramolecular anteriormente desconhecida que ocorre durante colisões ativas de íons e a superfície do CO
2 . O mais surpreendente é a falta de dependência dessa reação com a natureza e a temperatura da superfície.
Resultados da pesquisa
Em primeiro lugar, os cientistas demonstram a formação de O
2 em colisões hipertermicas de CO
2 + / Au, plotando a distribuição de energia cinética de três produtos de íons moleculares dispersos (CO
2 + , O
2 + e O
2 - ) para diferentes energias de CO
2 + incidentes (E
0 ) . Em E
0 <80 eV, um sinal muito fraco de CO
2 + espalhado foi detectado (
1a , gráfico à esquerda).
 Imagem Nº 1
Imagem Nº 1A energia de pico do CO
2 + de saída
é proporcional a E
0 , ou seja, há uma recuperação balística ou pulsada da superfície, o que exclui a pulverização física. Os cientistas acreditam que a observação de um sinal "dinâmico" de CO
2 + é crucial porque é evidência de que algum CO
2 sobrevive a uma colisão de superfície. Além disso, é possível determinar a sequência de colisões de átomos constituintes. Além do CO
2 + , também foram observados sinais de íons O
2 dispersos (
1b ,
1c / gráfico no centro e à direita). Nesse caso, as energias dos O
2 + e O
2 liberados representam uma grande fração da energia das partículas incidentes (57%) e aumentam uniformemente paralelamente a E
0 em uma faixa mais ampla do que o CO
2 + espalhado. O sinal máximo de íons O2 foi observado em E0 ~ 100 eV.
Os pesquisadores consideram surpreendente a descoberta de produtos iônicos de O2, pois nem a atomização da superfície de O2 nem as reações de abstração do átomo de O podem explicar a formação desses íons. E tudo porque esses dois mecanismos produziriam O2 com energias de saída muito mais baixas do que as observadas. É lógico supor que a própria dissociação de CO
2 esteja envolvida aqui.
A dissociação parcial e completa do CO
2 está de acordo com outros produtos iônicos detectados (CO
+ , CO
- , O
+ , O
- e C
+ ). E a energia do CO
+ , CO
- e O
- de saída muda em paralelo com a energia das partículas incidentes, o que é consistente com a formação dinâmica em uma colisão de superfície.
Mas os picos O
+ e C
+ mostram uma dependência extremamente pequena de E
0 , o que indica uma origem diferente, isto é, a pulverização. Confirmação da dissociação completa são produtos C
+ dispersos, que se manifestam em E
0 > 80 eV.
Em seguida, os cientistas usaram a cinemática para descrever o mecanismo de dispersão.
A teoria binária de colisões (BPS) permite calcular o fator cinemático, definido como a fração da energia das partículas incidentes, mantida pelo produto espalhado emergindo da superfície. No modelo mais simples, o CO2
é espalhado como uma molécula inteira, ou seja, como uma esfera sólida com uma massa atômica de 44 Da. Nesse caso, o BPS prevê um coeficiente cinemático de 0,6349, que é bastante fracamente correlacionado com os dados (
2a ).
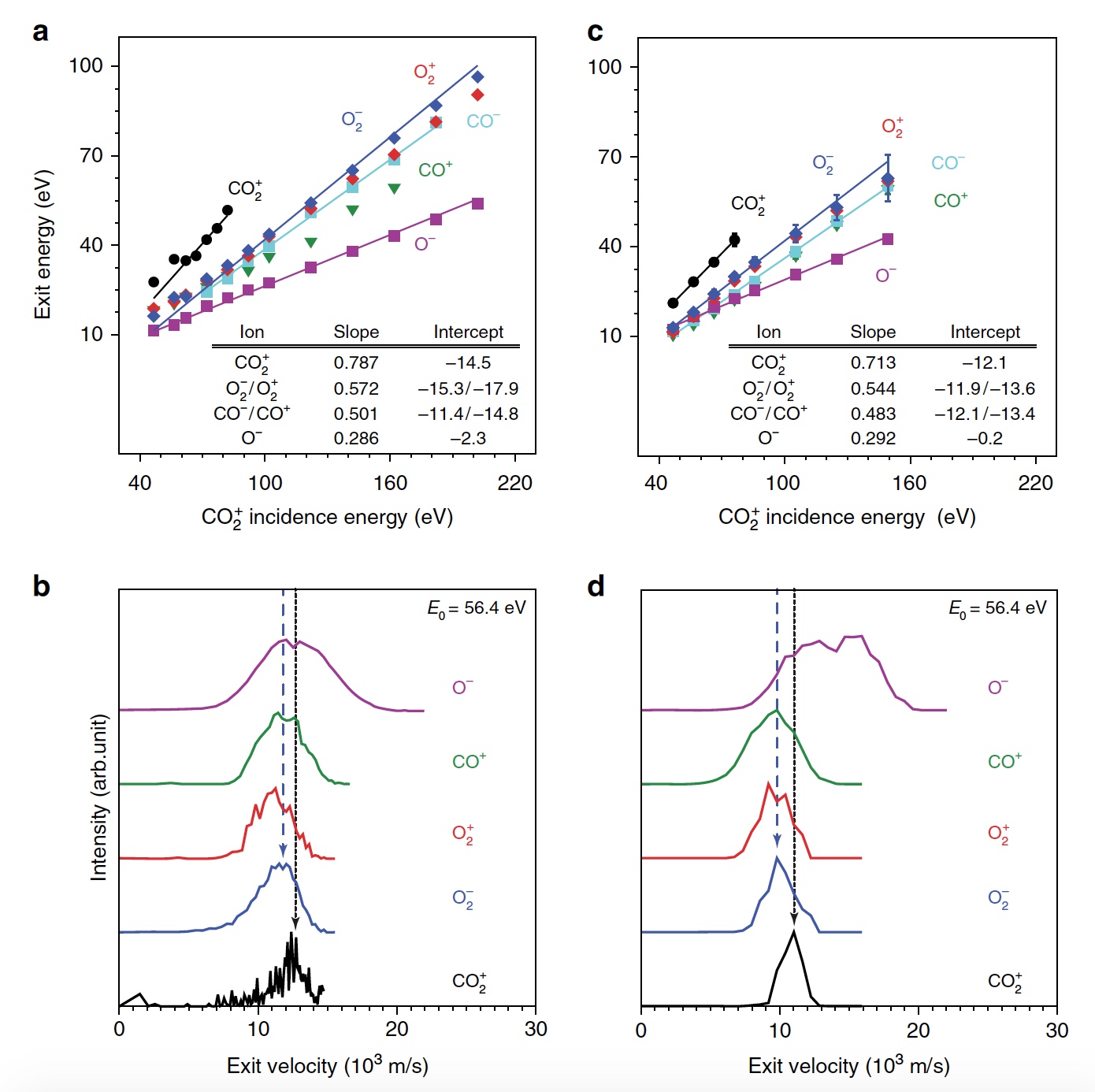 Imagem No. 2
Imagem No. 2Depois disso, os cientistas aplicaram um modelo no qual o átomo O colide primeiro com o átomo Au da superfície e, em seguida, a segunda colisão do fragmento CO ocorre sem rápida dissociação da molécula de CO
2 . A aplicação de BPS neste modelo de colisões sucessivas fornece um coeficiente cinemático de 0,7870, que está em excelente concordância com os dados de energia do CO
2 + de saída (linha preta em
2a ). O gráfico
2a também mostra as energias de outros produtos iônicos dispersos de saída.
A principal fonte potencial de tais produtos pode ser denominada dissociação parcial ou completa de CO
2 e pulverização superficial de fragmentos de CO
2 adsorvidos. Apesar do fato de que alguma pulverização é realmente observada em altos valores de E
0 (> 140 eV), uma análise cinemática dos dados sobre a energia das partículas que saem fornece evidências convincentes da presença de dissociação precisamente pulsada da molécula de CO
2 .
Em seguida, os cientistas realizaram uma análise da velocidade das partículas dispersas observadas.
A Figura
2b mostra uma comparação dos picos da distribuição de íons em E0 = 56,4 eV. Como podemos ver, as taxas de saída de CO
+ , O
2 + , O
2 - e parte mais lenta da distribuição O
- se sobrepõem, o que indica uma origem comum. No entanto, a distribuição de O
é notavelmente mais ampla, estendendo-se a velocidades de saída mais altas, o que pode indicar uma origem alternativa. Os produtos de íon O2 saem a taxas inferiores a CO
2 + devido à inelasticidade devido à ruptura de ligações químicas e ionização superficial não ressonante.
A análise cinemática acima, dizem os cientistas, forneceu evidências conclusivas de que algumas moléculas de CO
2 estão espalhadas intactas após uma colisão seqüencial em duas etapas de fragmentos de O e CO. No entanto, ainda restam dúvidas sobre vários aspectos do mecanismo de formação de O2.
Após os experimentos, várias questões permanecem. Primeiro, ainda não está claro se o O2
é produzido pelo mecanismo eletrônico adiabático ou não adiabático. Em segundo lugar, os caminhos de colisão subjacentes à distribuição de velocidade na saída dos fragmentos iônicos são desconhecidos. Em terceiro lugar, não se sabe quanto O2 neutro
é formado .
Nesse caso, a modelagem pode esclarecer a situação, a saber, o método clássico de dinâmica molecular (método MD).
Para simular a trajetória de espalhamento de CO
2 em Au (111), foi aplicada a geometria de espalhamento observada no experimento. Supõe-se que o CO
2 seja liberado na superfície da energia potencial de um elétron singleto no caso de neutralização dos íons CO
2 + recebidos antes de uma colisão forte.
A neutralização rápida ocorre através do tunelamento ressonante dos elétrons da superfície do metal para o cátion molecular, uma vez que o nível molecular de CO
2 (-13,8 eV) está dentro da zona Au ocupada (de -5,3 a -15,3 eV). Na simulação, as transferências de elétrons de / para a superfície também foram levadas em consideração para levar em consideração a ionização de produtos de colisão neutros.
A imagem
2c mostra os valores calculados de energia das partículas que saem.
Verificou-se que um pequeno número de CO
2 mantém a integridade em E
0 > 80 eV, o que é consistente com a ausência de um sinal nessas energias durante experimentos práticos. Os dados obtidos através da modelagem estão em excelente concordância com os dados experimentais, o que é fácil de ver através da comparação dos gráficos
2a (experimento) e
2c (simulação).
Além dessa coordenação de experimentos e simulações, ele também se manifesta na comparação da taxa de íons de saída em E
0 = 56,4 eV (
2d ). Tanto o modelo quanto o experimento mostram uma expansão da distribuição das velocidades de CO
+ e O
- . Também foi confirmado que as distribuições de O
2 + e O
2 - são semelhantes ao cátion saindo mais lentamente que o ânion. Além disso, em ambos os casos, verificou-se que o CO
2 + emerge a uma taxa maior que os produtos de O
2 ionizados.
Portanto, o uso dessa técnica de modelagem pode fornecer dados bastante precisos sobre o mecanismo de reação da conversão direta de CO
2 em O
2 .
Durante o estágio principal da simulação, 20.000 trajetórias de colisão de CO
2 -em-Au foram recriadas em diferentes energias das partículas de saída. Como resultado, várias variantes de produtos de dissociação foram obtidas, incluindo O
2 (
3a ).
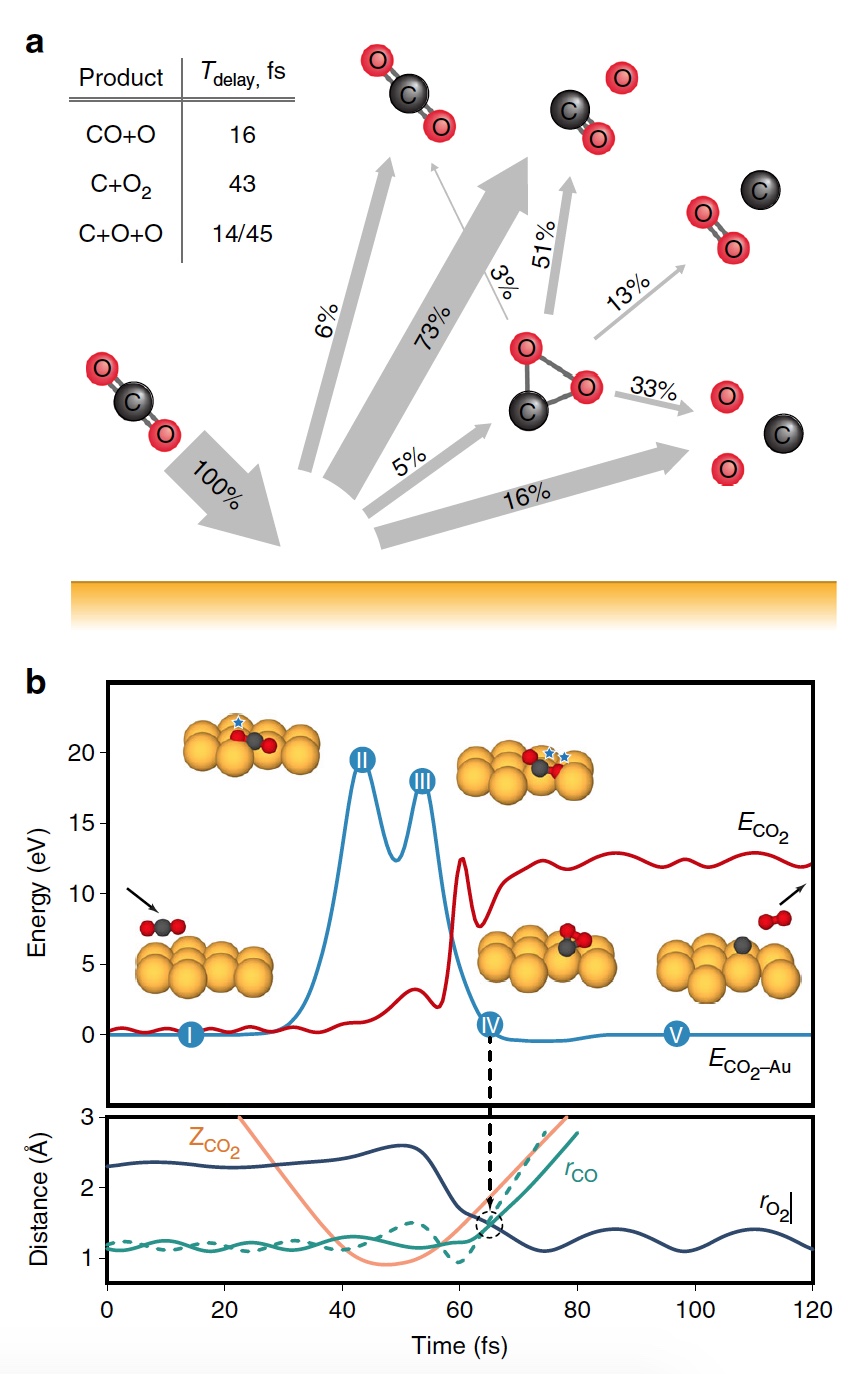 Imagem No. 3
Imagem No. 3A Figura
3b mostra uma trajetória representativa que resulta na formação de O2. Como resultado da transferência de energia pulsada durante uma colisão, ocorre um rearranjo intramolecular significativo no interior do CO
2 com retorno. A distância O - O diminui e a distância C - O aumenta, atingindo um pico quando o CO
2 adquire uma configuração triangular com comprimentos de ligação quase iguais. Esse produto intermediário de CO
2, fortemente dobrado, possui uma quantidade significativa de energia interna e se dissocia rapidamente, resultando na formação de um átomo de C livre e de uma molécula de O
2 vibracionalmente quente.
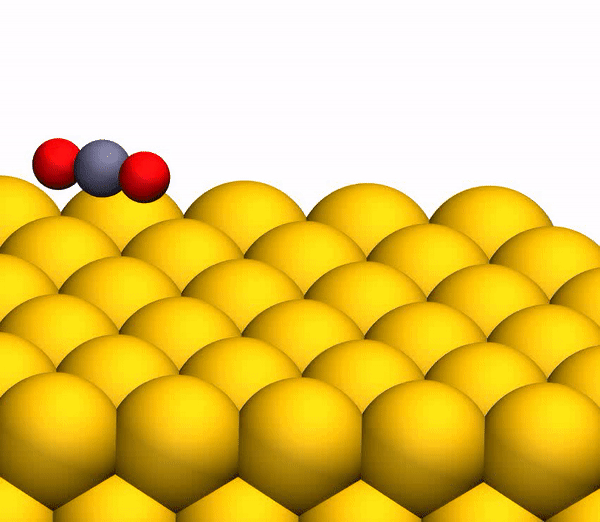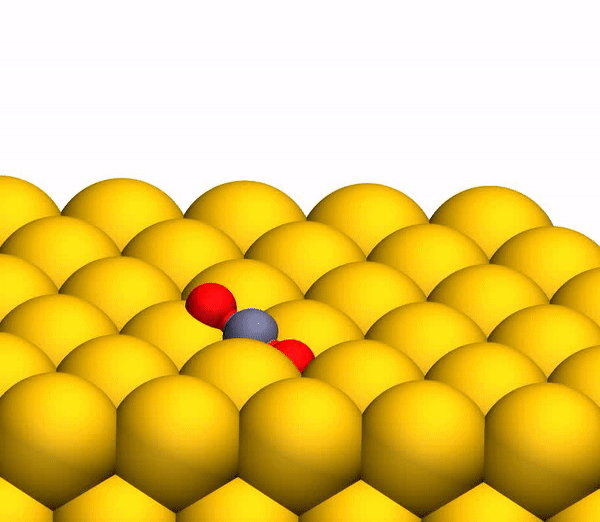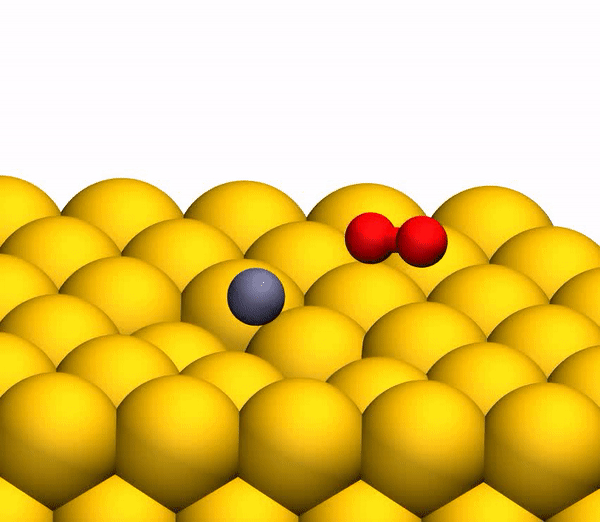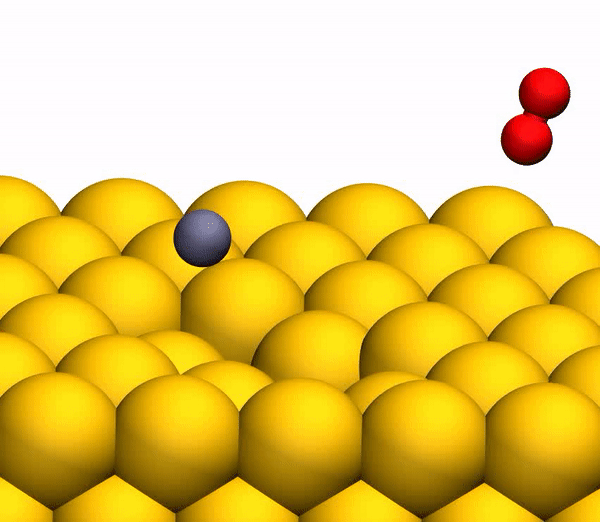 O processo de separação de CO 2 em um átomo de C livre e uma molécula de O 2 vibracionalmente quente.
O processo de separação de CO 2 em um átomo de C livre e uma molécula de O 2 vibracionalmente quente.Vale ressaltar que o mecanismo de separação descrito acima é totalmente consistente com as conclusões do modelo cinemático usado anteriormente.
Os cálculos mostraram que aproximadamente 5% de todas as trajetórias levam a um estado intermediário fortemente dobrado de CO
2 , que é um dos estágios da extração de O
2 . Essa condição é fragmentada principalmente pela dissociação parcial (51%), após a qual a dissociação completa segue novamente, mas com um resultado mais alto (33%).
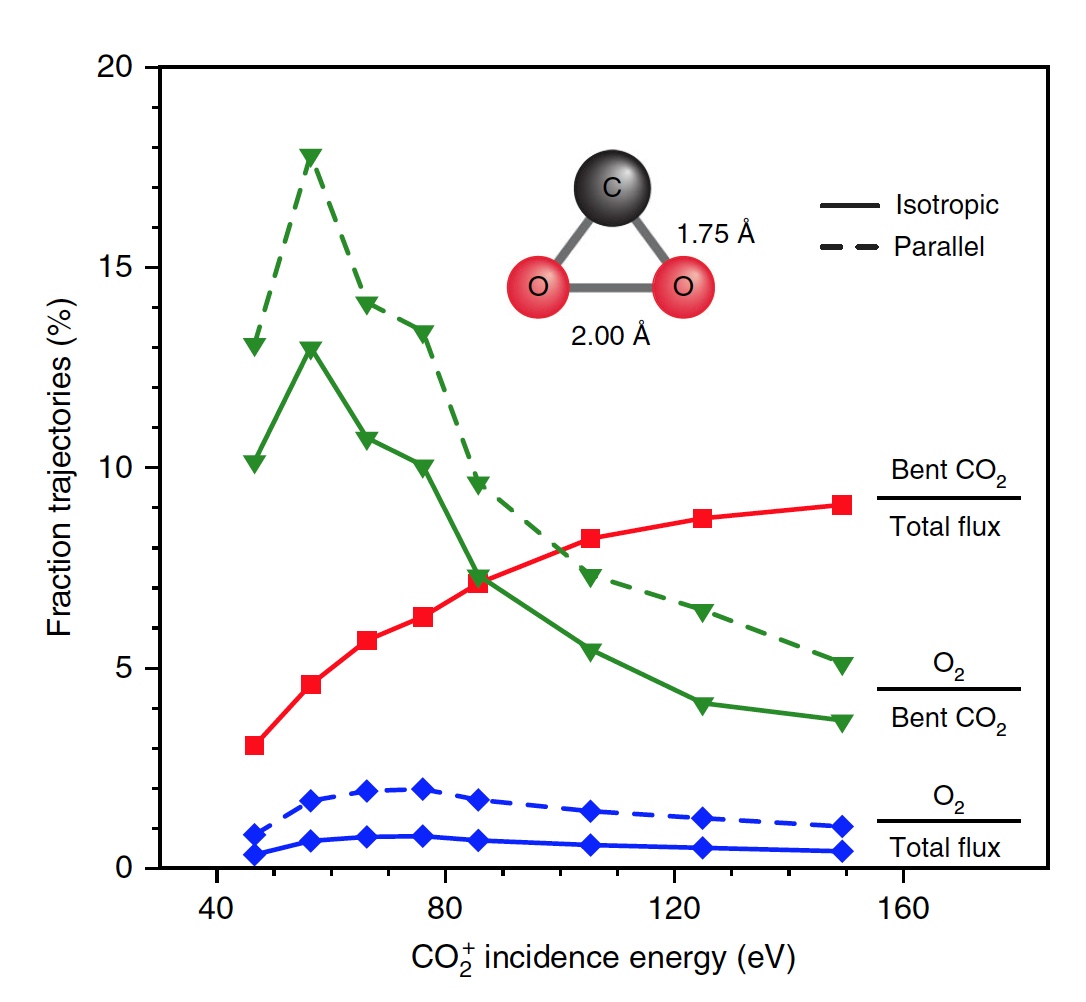 Imagem No. 4
Imagem No. 4Os cientistas observam que, de todas as moléculas curvas de CO
2 , apenas 13% produzem oxigênio. Ou seja, o resultado geral da dissociação de CO
2 → C + O
2 é de 0,6% em E
0 = 56,4 eV. Se você aumentar a energia das partículas incidentes, poderá obter O
2 até 0,8 ± 0,2% em E
0 ~ 70 ± 15 eV (linha azul na imagem nº 4).
Além disso, a fração das trajetórias de formação
de O2 aumenta significativamente quando é atingido um estado intermediário fortemente dobrado de CO
2 (linha verde), atingindo um máximo de 13% em E0 ~ 55 ± 10 eV. O menor rendimento total de O2 neutro se deve ao fato de que apenas uma pequena fração das moléculas lineares de CO
2 atinge um estado fortemente dobrado (linha vermelha). Se você alterar especificamente a orientação das moléculas de CO
2 recebidas (eixo paralelo à superfície), como resultado, poderá obter 2% a mais de O2 (linha verde tracejada).
Para um conhecimento mais detalhado das nuances do estudo, recomendo que você analise o
relatório dos cientistas .
Epílogo
Este trabalho demonstrou que através de reações químicas não padronizadas é possível obter oxigênio a partir do dióxido de carbono. Ninguém argumentará que tal técnica requer refinamentos e melhorias adicionais. No entanto, o fato de que este trabalho realmente abre novas possibilidades para viagens interplanetárias, a colonização de Marte, e não só não pode ser negado. Há também um problema com oxigênio e dióxido de carbono em nosso planeta. Pelo contrário, com o último, seu volume aumentou significativamente desde a industrialização. E considerando que o CO
2 é um dos principais culpados pelo aquecimento global, reduzir sua quantidade e obter oxigênio a partir dele parece uma idéia muito tentadora. Como ainda não podemos ficar sem fábricas, fábricas, carros com motores de combustão interna e outras coisas, os novos métodos de limpeza de nossa atmosfera não são apenas necessários, mas extremamente necessários. Viajar para planetas distantes certamente é legal, mas antes que a mudança maciça para Marte ainda seja muito, muito distante, vale a pena pensar mais na Terra em que vivemos do que em Marte, com a qual sonhamos.
Obrigado pela atenção, continuem curiosos e tenham uma boa semana de trabalho, pessoal! :)
Obrigado por ficar conosco. Você gosta dos nossos artigos? Deseja ver materiais mais interessantes? Ajude-nos fazendo um pedido ou recomendando a seus amigos, um
desconto de 30% para os usuários da Habr em um análogo exclusivo de servidores básicos que inventamos para você: Toda a verdade sobre o VPS (KVM) E5-2650 v4 (6 núcleos) 10GB DDR4 240GB SSD 1Gbps de US $ 20 ou como dividir o servidor? (as opções estão disponíveis com RAID1 e RAID10, até 24 núcleos e até 40GB DDR4).
Dell R730xd 2 vezes mais barato? Apenas temos
2 TVs Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 TV a partir de US $ 199 na Holanda! Dell R420 - 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB - a partir de US $ 99! Leia sobre
como criar infraestrutura classe usando servidores Dell R730xd E5-2650 v4 custando 9.000 euros por um centavo?