
Antes de começar a ler, calcule quantos dispositivos com baterias estão próximos a você em um raio de vários metros. Certamente você verá um smartphone, tablet, relógio inteligente, rastreador de fitness, laptop, mouse sem fio? Todos esses dispositivos estão equipados com baterias de íon-lítio - sua invenção pode ser considerada um dos eventos mais importantes no campo da energia.
As baterias de íon-lítio leves, espaçosas e compactas contribuíram para o boom dos eletrônicos portáteis, cuja existência era anteriormente impossível. Apenas os aparelhos nos últimos 30 anos deram um salto tecnológico fantástico, e as modernas baterias de íons de lítio quase não são diferentes dos primeiros modelos de produção do início dos anos 90. Quem e como inventou as baterias recarregáveis de íon de lítio, quais composições são usadas nelas e existe uma conspiração global contra as baterias “eternas”? Nós estamos dizendo.
A lenda da primeira bateria
Entre a primeira tentativa de produzir eletricidade quimicamente e a criação de baterias de íon-lítio, talvez dois milênios se passaram. Há um palpite não confirmado de que o primeiro elemento galvânico feito pelo homem na história da humanidade foi a “bateria de Bagdá”, encontrada em 1936 perto de Bagdá pelo arqueólogo Wilhelm Koenig. A descoberta, datada do século II-IV aC. e., é um recipiente de argila no qual existe um cilindro de cobre e uma barra de ferro, cujo espaço entre eles pode ser preenchido com "eletrólito" - ácido ou alcalino. A reconstrução moderna da descoberta mostrou que, quando a embarcação está cheia de suco de limão, é possível atingir uma voltagem de até 0,4 volts.
 A bateria de Bagdá é bastante semelhante a uma bateria portátil. Ou um caso de papiro? Fonte: Ironie / Wikimedia
A bateria de Bagdá é bastante semelhante a uma bateria portátil. Ou um caso de papiro? Fonte: Ironie / Wikimedia
Por que a "bateria de Bagdá" poderia ser usada se restassem alguns milhares de anos antes da descoberta de eletricidade? Talvez tenha sido usado para a deposição precisa de ouro em figuras pelo método de galvanização - a corrente e a tensão da "bateria" são suficientes para isso. No entanto, isso é apenas uma teoria, porque os povos antigos não obtiveram nenhuma evidência do uso de eletricidade e da mesma "bateria": a douração era aplicada por amálgama naquele momento, e a embarcação incomum em si também poderia ser um recipiente protegido para pergaminhos.
A teoria do pequeno estrondo
O provérbio russo "Não haveria felicidade, mas o infortúnio ajudou" ilustra o curso dos trabalhos sobre as baterias de íon-lítio da melhor maneira possível. Sem um incidente inesperado e desagradável, a criação de novas baterias pode ser adiada por vários anos.
Na década de 1970, o britânico Stanley Whittingham, que trabalhou na Exxon Energy Company, usou um ânodo de sulfeto de titânio e um cátodo de lítio para criar uma bateria de lítio recarregável. A primeira bateria de lítio recarregável mostrou indicadores de corrente e tensão toleráveis, explodiu apenas periodicamente e envenenou as pessoas ao seu redor com gás: o dissulfeto de titânio liberava sulfeto de hidrogênio ao entrar em contato com o ar, o que é pelo menos desagradável de respirar e, no máximo, perigoso. Além disso, o titânio sempre foi muito caro em todos os momentos, e na década de 1970 o preço do dissulfeto de titânio era de cerca de US $ 1.000 por quilograma (o equivalente a US $ 5.000 atualmente). Sem mencionar o fato de que o lítio metálico queima no ar. Então Exxon desviou o projeto de Whittingham do pecado.
Em 1978, Koichi Mizushima, que defendeu seu doutorado em física, estava envolvido em pesquisas na Universidade de Tóquio quando recebeu um convite de Oxford para ingressar no grupo de John Goodenough, que procurava novos materiais para os ânodos das baterias. Esse foi um projeto muito promissor, já que o potencial das fontes de energia de lítio já era conhecido, mas elas realmente não conseguiam domesticar o metal caprichoso - as recentes experiências de Whittingham mostraram que o início da produção em massa das cobiçadas baterias de íon de lítio ainda estava muito longe.
As baterias experimentais usavam um cátodo de lítio e um ânodo de sulfeto. A superioridade dos sulfetos sobre outros materiais nos ânodos deu a Mizushima e seus colegas uma direção para pesquisar. Os cientistas encomendaram um forno de sulfureto em seu laboratório no local para experimentar rapidamente diferentes compostos. O trabalho com o fogão não terminou muito bem: um dia ele explodiu e causou um incêndio. O incidente forçou uma equipe de pesquisadores a reconsiderar seus planos: talvez os sulfetos, apesar de sua eficácia, não tenham sido a melhor escolha. Os cientistas voltaram sua atenção para os óxidos, que eram muito mais seguros para sintetizar.
Após muitos testes com vários metais, incluindo ferro e manganês, Mizushima descobriu que o óxido de cobalto e lítio apresenta os melhores resultados. Basta usá-lo não da mesma maneira que a equipe de Gudenaf supôs antes - para procurar não material que absorva íons de lítio, mas material que mais prontamente fornece íons de lítio. O cobalto também foi melhor do que outros, porque atende a todos os requisitos de segurança e também aumenta a tensão da célula para 4 volts, ou seja, o dobro do que as opções anteriores de bateria.
O uso de cobalto foi o mais importante, mas não o último passo na criação de baterias de íon-lítio. Tendo lidado com um problema, os cientistas enfrentaram outro: a densidade atual era muito baixa para o uso de células de íons de lítio ser economicamente viável. E a equipe que fez uma inovação fez a segunda: ao reduzir a espessura dos eletrodos para 100 mícrons, foi possível aumentar a força da corrente para o nível de outros tipos de baterias, com dupla voltagem e capacidade.
Primeiras etapas comerciais
A história da invenção das baterias de íon-lítio não termina aí. Apesar da descoberta de Mizushima, a equipe Gudenaf ainda não tinha uma amostra pronta para produção em massa. Devido ao uso de metal de lítio no cátodo durante a carga da bateria, os íons de lítio retornaram ao ânodo não em uma camada uniforme, mas por dendritos - correntes em relevo que, crescendo, causavam um curto-circuito e fogos de artifício.
Em 1980, o cientista marroquino Rachid Yazami descobriu que a grafite lida com o papel de um cátodo, e é absolutamente à prova de fogo. Os eletrólitos orgânicos existentes na época se decompuseram rapidamente em contato com a grafite, então Yazami os substituiu por eletrólito sólido. O cátodo de grafite de Yazami foi inspirado na descoberta da condutividade do polímero pelo professor Hideki Shirakawa, pelo qual recebeu o Prêmio Nobel de Química. E o cátodo de grafite Yazami ainda é usado na maioria das baterias de íon-lítio.
Lançamento em produção? E novamente não! Outros 11 anos se passaram, os pesquisadores melhoraram a segurança da bateria, aumentaram a voltagem, experimentaram diferentes materiais de cátodo antes que a primeira bateria de íon de lítio fosse vendida.
A amostra comercial foi desenvolvida pela Sony e pela gigante química japonesa Asahi Kasei. Tornou-se a bateria da filmadora amadora de filmes Sony CCD-TR1. Ele aguentou 1000 ciclos de carga e a capacidade residual após esse desgaste foi quatro vezes maior que a de um tipo similar de bateria de níquel-cádmio.
Pedra de tropeço em cobalto
Antes da descoberta do óxido de lítio-cobalto de Koichi Mizushima, o cobalto não era um metal muito procurado. Seus principais depósitos foram descobertos no território da África, no estado hoje conhecido como República Democrática do Congo. O Congo é o maior fornecedor de cobalto - 54% desse metal é extraído aqui. Devido à revolta política no país na década de 1970, o preço do cobalto subiu 2000%, mas depois retornou aos seus valores anteriores.
A alta demanda cria preços altos. Nem nos anos 90, nem nos anos 2000, o cobalto era um dos principais metais do planeta. Mas o que começou com a popularização dos smartphones nos anos 2010! Em 2000, a demanda por metal era de aproximadamente 2.700 toneladas por ano. Em 2010, quando os smartphones iPhone e Android marchavam triunfantemente pelo planeta, a demanda saltou para 25.000 toneladas e continuou a crescer ano a ano. Agora, o número de pedidos excede o volume de cobalto vendido em 5 vezes. Para referência: mais da metade do cobalto minerado no mundo é destinado à produção de baterias.
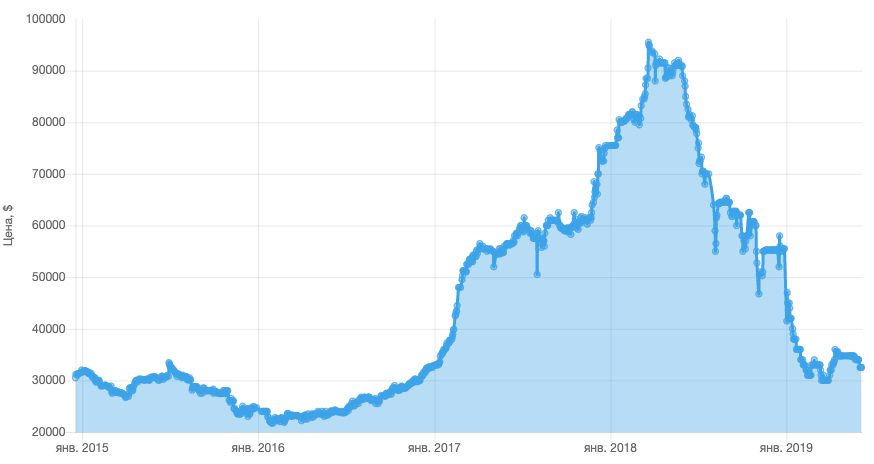 Tabela de preços de cobalto nos últimos 4 anos. Os comentários são redundantes. Fonte: Elec.ru
Tabela de preços de cobalto nos últimos 4 anos. Os comentários são redundantes. Fonte: Elec.ru
Se em 2017 o preço por tonelada de cobalto foi em média de US $ 24.000, então desde 2017 aumentou acentuadamente, em 2018 atingindo um pico em torno de US $ 95.500. Embora os smartphones usem apenas 5 a 10 gramas de cobalto, o aumento dos preços do metal afetou o custo dos dispositivos.
E essa é uma das razões pelas quais os fabricantes de carros elétricos estão preocupados com a diminuição da participação de cobalto nas baterias de carros. Por exemplo, Tesla reduziu a massa de metal escasso de 11 para 4,5 kg por máquina e, no futuro, planeja encontrar compostos eficazes sem cobalto. Até 2019, o preço do cobalto subiu de forma anormal e caiu para os valores de 2015, mas os desenvolvedores de baterias intensificaram os esforços para recusar ou reduzir a participação do cobalto.
Nas baterias tradicionais de íons de lítio, o cobalto é cerca de 60% da massa total. A composição lítio-níquel-manganês usada nos automóveis compreende de 10% a 30% de cobalto, dependendo das características desejadas da bateria. A composição de lítio-níquel-alumínio é de apenas 9%. No entanto, essas misturas não substituem completamente o óxido de cobalto e lítio.
Problemas de iões de lítio
Até o momento, vários tipos de baterias de íon de lítio são as melhores para a maioria dos consumidores. Capazes, poderosos, compactos e baratos, eles ainda apresentam sérias desvantagens que limitam o escopo de uso.
Perigo de incêndio. Para operação normal, uma bateria de íons de lítio precisa de um controlador de energia para evitar sobrecarga e superaquecimento. Caso contrário, a bateria se tornará uma coisa muito inflamável, tentando inchar e explodir no calor ou durante o carregamento de um adaptador de baixa qualidade. O risco de explosão é talvez a principal desvantagem das baterias de íon-lítio. Para aumentar a capacidade dentro das baterias, o arranjo é compactado, devido ao qual até um leve dano ao invólucro leva instantaneamente a um incêndio. Todo mundo se lembra da sensacional história do Samsung Galaxy Note 7, na qual, devido ao aperto no interior do gabinete, a tampa da bateria esfregava com o tempo, o oxigênio penetrava no interior e o smartphone brilhava repentinamente. Desde então, algumas companhias aéreas solicitam que as baterias de íon-lítio sejam transportadas apenas na bagagem de mão e, nos vôos de carga, um grande adesivo de advertência é feito na embalagem com baterias.
Despressurização é uma explosão. Recarga é uma explosão. Você deve pagar pelo potencial energético do lítio com precauções.Envelhecimento As baterias de íons de lítio são propensas ao envelhecimento, mesmo que não sejam usadas. Portanto, comprado como um smartphone colecionador descompactado há 10 anos, por exemplo, o primeiro iPhone, a carga será muito menor devido ao envelhecimento da bateria. A propósito, as recomendações para manter as baterias carregadas até a metade da capacidade são justificadas - quando totalmente carregadas durante um longo armazenamento, a bateria perde sua capacidade máxima muito mais rapidamente.
Auto-descarga. Acumular energia em baterias de íon-lítio e armazená-lo por muitos anos é uma má idéia. Em princípio, todas as baterias perdem sua carga, mas o íon de lítio faz isso especialmente rapidamente. Se as células NiMH perdem 0,08 a 0,33% ao mês, as células de íons de lítio perdem 2-3% ao mês. Assim, em um ano, a bateria de íons de lítio perderá um terço da carga e, após três anos, "sentará" a zero. Para ser justo, digamos que as baterias de níquel-cádmio ainda são piores - 10% por mês. Mas esta é uma história completamente diferente.
Sensibilidade à temperatura. O resfriamento e o superaquecimento afetam fortemente os parâmetros dessa bateria: +20 ° C graus são considerados a temperatura ambiente ideal para baterias de íon-lítio; se for reduzida para +5 ° C, a bateria fornecerá ao dispositivo 10% menos energia. O resfriamento abaixo de zero leva dezenas de por cento da capacidade e também afeta a saúde da bateria: se você tentar carregá-lo, por exemplo, de um banco de potência, um "efeito de memória" será exibido e a bateria perderá irrevogavelmente a capacidade devido à formação de metal de lítio no ânodo. Nas temperaturas médias do inverno na Rússia, a célula de íons de lítio não funciona - deixe o telefone em janeiro na rua por meia hora para verificar isso.
Para lidar com os problemas descritos, os cientistas estão experimentando materiais de ânodos e cátodos. Ao substituir a composição dos eletrodos, um grande problema é substituído por problemas menores - a segurança contra incêndio leva a uma diminuição no ciclo de vida e uma alta corrente de descarga reduz o consumo de energia específico. Portanto, a composição para os eletrodos é selecionada dependendo da aplicação da bateria.
Quem roubou a revolução?
Todos os anos, nos feeds de notícias, há relatos de outra inovação na criação de baterias extremamente amplas e duradouras - parece que os smartphones funcionam por um ano sem recarregar e carregam em dez segundos. E onde está a revolução da bateria que os cientistas prometem a todos?
Freqüentemente nesses relatórios, os jornalistas distorcem os fatos, omitindo detalhes muito importantes. Por exemplo, uma bateria com carregamento instantâneo pode ter uma capacidade muito baixa, adequada apenas para alimentar um despertador de cabeceira. Ou a voltagem não chega a um volt, embora os smartphones precisem de 3,6 V. E para obter uma vida útil, a bateria precisa ter um baixo custo e alta segurança contra incêndio. Infelizmente, a grande maioria dos desenvolvimentos foi inferior em pelo menos um parâmetro, por causa do qual as baterias "revolucionárias" nunca foram além do laboratório.
 No final dos anos 2000, a Toshiba experimentou células de combustível de metanol recarregáveis (reabastecendo com metanol na foto), mas as baterias de íon-lítio eram ainda mais convenientes. Fonte: Toshiba
No final dos anos 2000, a Toshiba experimentou células de combustível de metanol recarregáveis (reabastecendo com metanol na foto), mas as baterias de íon-lítio eram ainda mais convenientes. Fonte: Toshiba
E, é claro, deixamos de lado a teoria da conspiração "baterias sem fim não são lucrativas para os fabricantes". Atualmente, as baterias nos dispositivos de consumo são insubstituíveis (ou melhor, podem ser trocadas, mas difíceis). Há 10 a 15 anos, a substituição de uma bateria danificada em um telefone celular era simples, mas as fontes de energia realmente perderam muita capacidade em um ou dois anos de uso ativo. As modernas baterias de íon de lítio duram mais do que o ciclo de vida médio do dispositivo. Nos smartphones, você pode pensar em substituir a bateria antes de 500 ciclos de carregamento, quando ela perde de 10 a 15% de sua capacidade. Em vez disso, o próprio telefone perderá relevância antes que a bateria finalmente falhe. Ou seja, os fabricantes de baterias não ganham na substituição, mas na venda de baterias para novos dispositivos. Portanto, a bateria "eterna" em um telefone de dez anos não prejudicará os negócios.
A equipe de Goodenough de volta aos negócios
Mas o que aconteceu com os cientistas do grupo John Goodenough, que descobriram o óxido de lítio-cobalto e, assim, deram vida a baterias eficientes de íons de lítio?
Em 2017, Goodenough, 94 anos, anunciou que, junto com cientistas da Universidade do Texas, havia desenvolvido um novo tipo de bateria de estado sólido que podia armazenar de 5 a 10 vezes mais energia do que as baterias de íon-lítio anteriores. Para isso, os eletrodos foram feitos de lítio e sódio puros. Preço prometido e baixo. Mas ainda não há detalhes e previsões sobre o início da produção em massa. Dado o longo caminho entre a abertura do grupo Gudenaf e o início da produção em massa de baterias de íon-lítio, amostras reais podem ser esperadas em 8 a 10 anos.
Koichi Mizushima continua a pesquisa na Toshiba Research Consulting Corporation. “Olhando para trás, estou surpreso que ninguém diante de nós tenha adivinhado o uso de material tão simples como o óxido de cobalto e lítio no ânodo. Naquela época, muitos outros óxidos haviam sido tentados, então, provavelmente, se não fosse por nós, alguém teria feito essa descoberta dentro de alguns meses ", disse ele.
 Koichi Mizushima, com um prêmio da Royal Chemical Society da Grã-Bretanha, recebeu por participar da criação de baterias de íons de lítio. Fonte: Toshiba
Koichi Mizushima, com um prêmio da Royal Chemical Society da Grã-Bretanha, recebeu por participar da criação de baterias de íons de lítio. Fonte: Toshiba
A história não tolera o humor subjuntivo, especialmente porque o próprio Mizushima admite que um avanço na criação de baterias de íons de lítio era inevitável. Mas ainda assim é interessante imaginar como seria o mundo da eletrônica móvel sem baterias compactas e espaçosas: laptops com alguns centímetros de espessura, smartphones enormes que precisam ser carregados duas vezes por dia e sem relógios inteligentes, pulseiras fitness, câmeras de ação, quadriciclos e até veículos elétricos. Todos os dias, cientistas de todo o mundo estão aproximando uma nova revolução energética, o que nos dará baterias mais poderosas e compactas e, com elas, aparelhos eletrônicos incríveis, com os quais só podemos sonhar.