
Os sucessos da oncologia clínica moderna são inegáveis. Operações cada vez mais complexas, novos medicamentos, métodos eficazes de alívio da dor e eliminação de sintomas dolorosos. Em nosso blog,
conversamos bastante sobre como hoje é possível estender e facilitar a vida dos pacientes, mesmo nos últimos estágios da doença.
Mas, no entanto, milhares de pacientes com câncer em todo o mundo aprendem diariamente que um tumor que ontem cedeu a determinado tratamento está crescendo novamente hoje ou se transformando em metástase. Os médicos se encontram regularmente parados: todos os medicamentos e métodos de tratamento prescritos foram testados e não restam medicamentos eficazes para esse paciente.
No entanto, até mesmo uma saída desse impasse pode ser encontrada. Com o desenvolvimento da genética e da biologia molecular, os oncologistas encontraram uma nova maneira de estudar o tumor, a fim de encontrar vulnerabilidades nele.
Para fazer isso, use testes genéticos moleculares - determinando as características do DNA das células cancerígenas. O método é tecnicamente complicado, caro, requer conhecimento específico de um médico.
O estudo leva 3 semanas, custa de 250 a 670 tr Como resultado, o médico recebe um relatório de 30 páginas de informações complexas, que ele ainda deve poder usar. Mas para os pacientes que já deixaram de ter esperança, isso dá mais tempo de vida.
Na
Medicine 24/7, recorremos regularmente à pesquisa genética molecular para tratar uma pessoa quando "todo mundo já tentou - nada mais a fazer". E os pacientes, que pareciam ser nada mais para ajudar, continuam a viver. Alguns são dois meses em vez de duas semanas, e outros são anos em vez de alguns meses.
Hoje queremos falar sobre como o teste genético molecular é feito, em que casos ele pode ajudar o paciente e que conhecimento o médico fornece.
Somos todos mutantes, esta é a norma. Mas algumas mutações levam ao câncerAs células "decentes" vivem sem incomodar outras. Eles usam uma quantidade estritamente alocada de recursos, desempenham adequadamente suas funções biológicas e, no devido tempo, morrem, dando lugar às próximas gerações (esse processo é chamado de apoptose). A cada 7-10 anos, o corpo humano é completamente atualizado.
Para fazer isso, todas as células somáticas (aquelas que compõem o corpo), exceto as células vermelhas do sangue, se dividem continuamente.
Antes de dividir, a célula é estocada com uma "cópia" de informação genética hereditária que está em seu núcleo. As cadeias de DNA "dobradas" em cromossomos dentro do núcleo são replicadas, isto é, dobrar. E depois disso, a célula se divide, distribuindo silenciosamente a cada uma das células filhas um conjunto idêntico de cromossomos. De uma célula, duas são absolutamente iguais e, juntamente com sua bagagem genética, cada uma delas obtém “conhecimento” sobre como precisa viver, que função executar e quantas vezes na vida compartilhar.
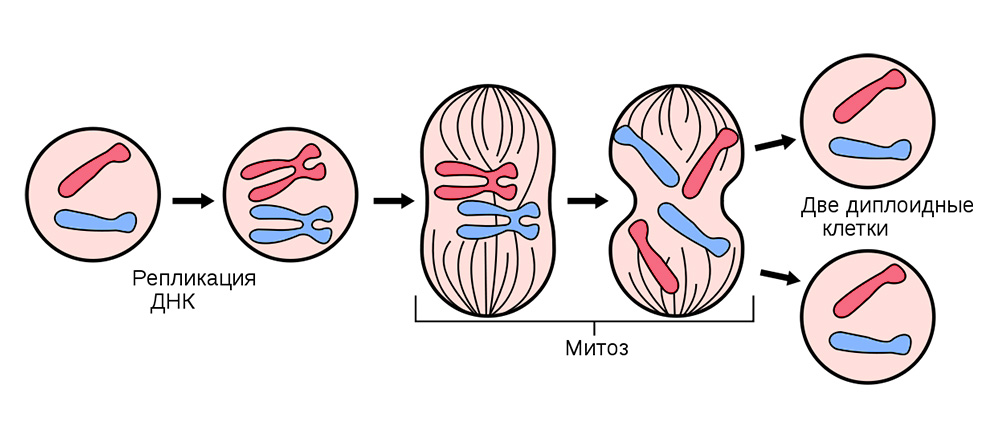 A divisão celular somática ocorre em todos os órgãos e tecidos.
A divisão celular somática ocorre em todos os órgãos e tecidos.Às vezes, no processo de falhas de divisão - ocorrem mutações. Ou a fita de DNA se rompe, é copiada com um erro ou as seções dos cromossomos são misturadas. Centenas de fatores podem afetar isso: do estresse e da fumaça do tabaco à exposição à radiação.
Mutações podem ser divididas em 4 tipos.1. Substituição de um par de bases (polimorfismo de nucleotídeo único, SNP): um nucleotídeo - a "letra" do código genético - muda para outro. A estrutura da proteína codificada por esta sequência nucleotídica também é interrompida.
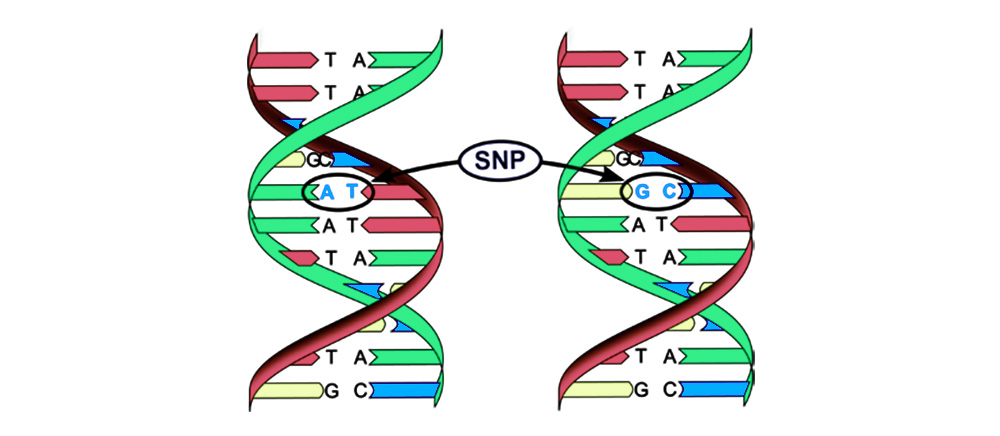 2. Aberrações cromossômicas.Exclusão
2. Aberrações cromossômicas.Exclusão - perda de um local cromossômico. Eles ocorrem devido ao término da porção terminal ou à ruptura do DNA em dois locais ao mesmo tempo. É isso aí - esse gene não é mais expresso no cromossomo.
"Pedaços" de DNA arrancados podem ser inseridos no cromossomo adjacente - uma
inserção (ou inversão, se a inserção ocorrer na ordem inversa)
resultará . Às vezes, entre os cromossomos, há uma "troca mútua" de seções de DNA -
translocação . O resultado é um: genes "extras" são
expressos .
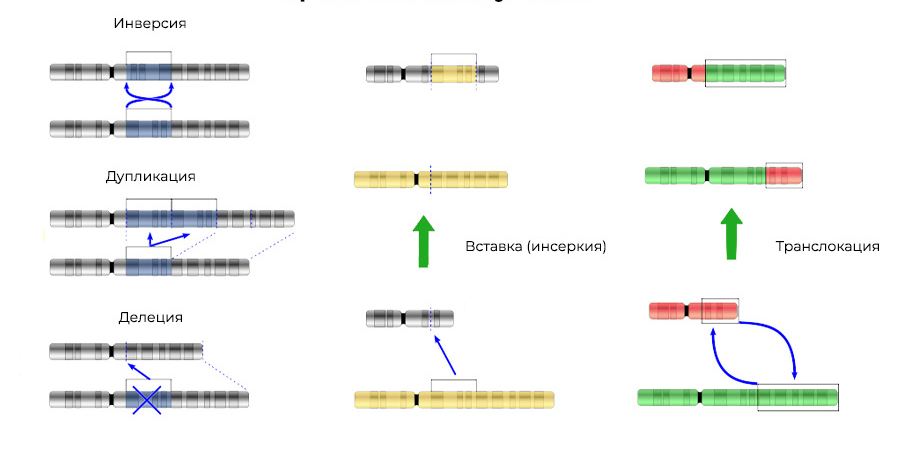 Mutações alteram não apenas a estrutura de um local de DNA, mas também a ordem desses locais3. Fusão de genes
Mutações alteram não apenas a estrutura de um local de DNA, mas também a ordem desses locais3. Fusão de genes - um gene é "montado" a partir de partes de outros genes e expresso (desencadeado) como um todo. A proteína na expressão de um gene quimérico também se mostra incomum, híbrido, com propriedades nocivas.
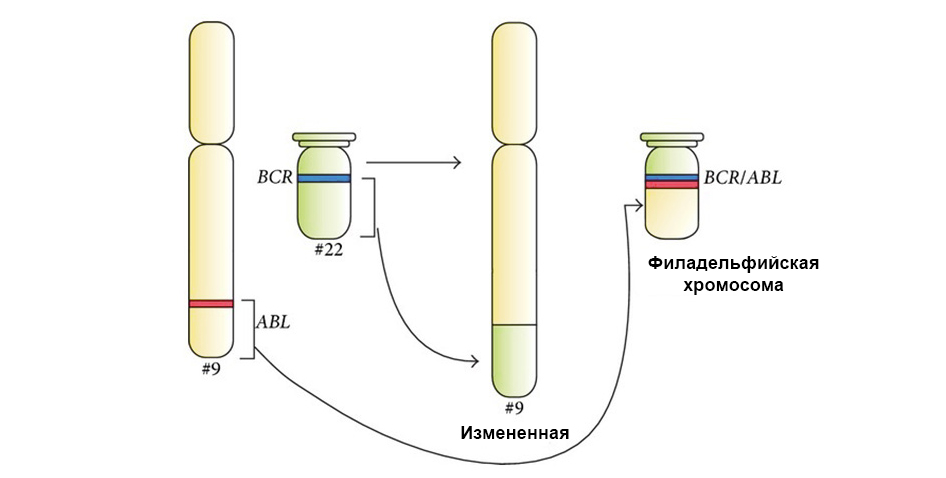 Dois genes "aderiram" durante a translocação e formaram um gene quimérico (causa leucemia)
Dois genes "aderiram" durante a translocação e formaram um gene quimérico (causa leucemia)Temos sorte de o DNA estar cheio de seções não muito significativas que não codificam nada. Muitas mutações ocorrem nessas áreas - e se revelam insignificantes, não afetam o trabalho posterior das células. E essa célula, com uma pequena diferença do "padrão", continua a viver e compartilhar normalmente.
Ao longo de 70 anos, 100 trilhões de divisões celulares ocorrem no corpo humano. São 1,4 trilhões de divisões por ano - há casos suficientes para acumular uma "massa crítica" de erros no DNA ao longo do tempo ou para que outra falha ainda possa entrar na seção de DNA que codifica algo importante. Isso resultará em uma mutação inofensiva, devido à qual a célula se tornará maligna (maligna).
Uma célula maligna é diferenciada de uma desordem normal do ciclo celular.O ciclo celular (vida celular de divisão para divisão / morte) é estritamente regulado pelo
trabalho de proteínas especiais: quinases, ciclinas, fatores de crescimento e fatores de transcrição - existem dezenas delas em todas as células vivas e cada uma tem sua função especial, mas importante.
Eles transmitem sinais entre as células de um organismo multicelular, ativam-se, iniciam o processo de divisão e controlam sua correção, mantêm a ativação correta dos genes, desempenham suas funções pela célula, “verificam” a integridade do genoma, “comandam” a célula para iniciar a apoptose se for hora de morrer, e t .p.
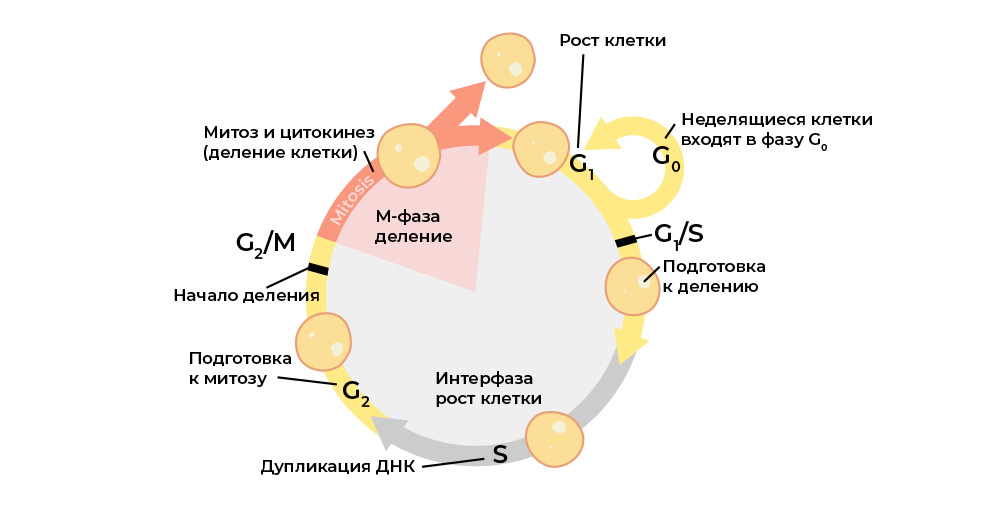 Cada estágio do ciclo celular é controlado por proteínas reguladoras.
Cada estágio do ciclo celular é controlado por proteínas reguladoras.E cada uma dessas proteínas é codificada em uma
parte específica do DNA - o gene. Se esse gene sofrer uma mutação prejudicial, ele "reproduzirá" a proteína reguladora correspondente incorretamente. E o regulador protéico “errado” interromperá o ciclo celular e, com ele, o comportamento de toda a célula.
Por exemplo, o gene do regulador protéico da proliferação (crescimento da massa celular) “se decompõe” - e os “mutantes” começam a se dividir mais do que deveriam, as células saudáveis “se esmagam”.
Esses genes significativos, alterações nas quais podem levar à carcinogênese (o início do câncer), são dois grandes grupos.Os protonconcogenes são genes "normais" que podem se tornar
oncogenes devido ao aprimoramento ou alteração de suas funções. Os genes cuja expressão pode levar à malignidade da célula e ao desenvolvimento de neoplasias são chamados
oncogenes . Se uma mutação prejudicial ocorre no proto-oncogênio, ela se torna um
oncogênio e pode causar um tumor.
Dos mais
estudados e amplamente ouvidos:
- EGFR, ALK, BRAF - câncer de pulmão de células não pequenas;
- BRAF - melanoma;
- HER2 - câncer de mama (câncer de mama);
- KRAS - câncer colorretal.
Além disso, mutações desses genes são encontradas em vários tipos de tumores. Por exemplo, a expressão aumentada de HER2 é encontrada não apenas no câncer de mama, mas também no câncer de pulmão e estômago.
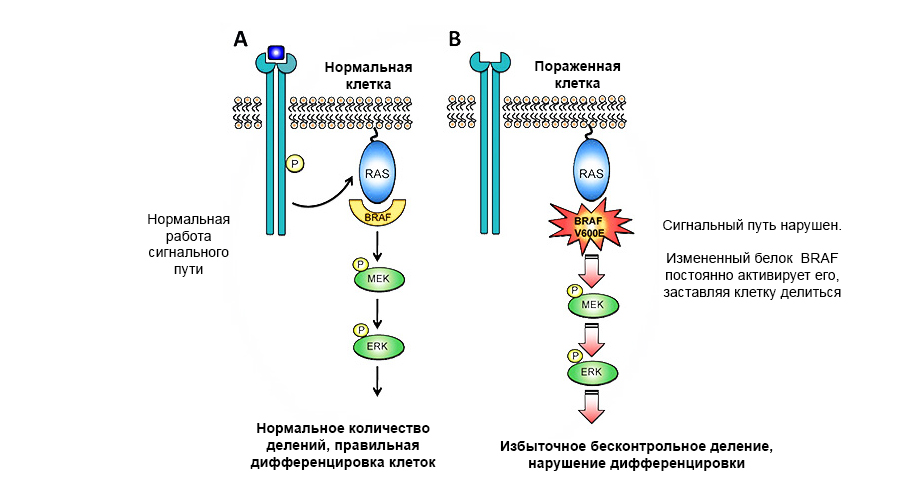 Uma mutação no proto-oncogênio da proteína BRAF leva ao crescimento descontrolado do tumor.
Uma mutação no proto-oncogênio da proteína BRAF leva ao crescimento descontrolado do tumor.Genes supressores de tumor (anti-oncogenes) - pelo contrário, podem
suprimir o crescimento de células tumorais ou participar no reparo (reparo) de DNA danificado. Mas a inativação dos genes supressores como resultado de mutações aumenta drasticamente a probabilidade de um tumor maligno.
Por exemplo:
- mutações BRCA1, BRCA2 - câncer das glândulas mamárias, ovários;
- mutações p53 - até 50% de vários tipos de tumores cancerígenos, incluindo sarcomas;
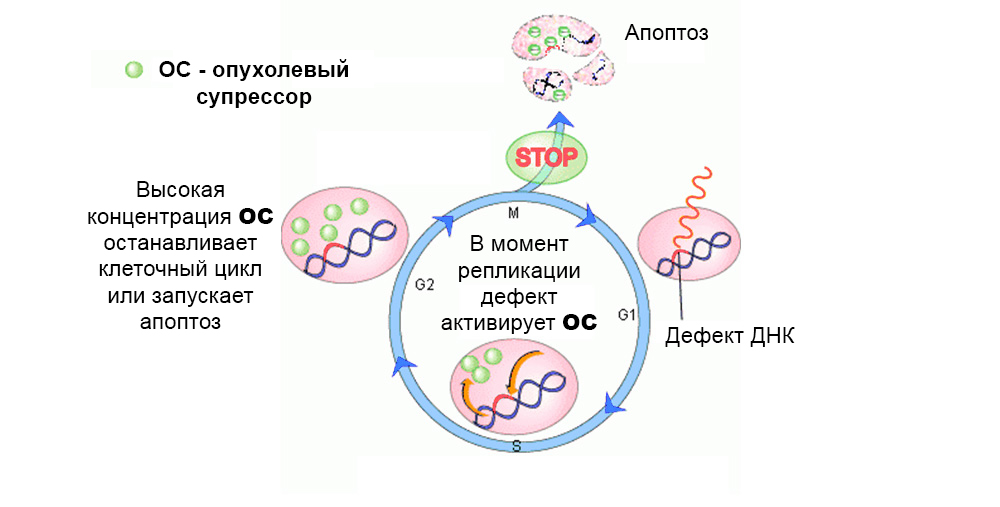 Normalmente, os mecanismos de proteção agem contra o desenvolvimento de células mutadas. Um defeito no gene supressor de tumor "os desliga"
Normalmente, os mecanismos de proteção agem contra o desenvolvimento de células mutadas. Um defeito no gene supressor de tumor "os desliga"No total, foi estudado o efeito de várias dezenas de proto-oncogenes e supressores de tumores na carcinogênese.
Por que existem tantas dificuldades e como elas prolongam a vida dos pacientesCada mutação encontrada em um gene proto-oncogênio ou supressor é a causa das "superpotências" da célula cancerosa, como a negligência da apoptose e a capacidade de se esconder da imunidade. Mas, ao mesmo tempo - este é o seu potencial ponto fraco.
Sabendo qual é o motivo das peculiaridades do mecanismo de operação do tumor, pode-se encontrar uma substância que "cunha" esse mecanismo e interrompe as reações patológicas na célula. Ou seja, mutações específicas no tumor - indicam o alvo no qual os médicos "atingiram" o medicamento. Este princípio permitiu o desenvolvimento de
terapia direcionada .
A terapia direcionada - o nome de todo um ramo da terapia medicamentosa eficaz para o câncer - nasceu da palavra alvo em inglês. Os medicamentos direcionados agem "direcionados" às células cancerígenas - porque apenas eles têm mutações nos genes correspondentes. As células saudáveis não têm essas mutações - e as drogas não agem sobre elas.
A figura abaixo mostra o mecanismo de ação do fármaco Imatinib nas células tumorais com a mutação do cromossomo Filadélfia: o gene de fusão BCR-ABL. Essa mutação leva ao fato de que o mecanismo de apoptose deixa de funcionar na célula - os erros no genoma se acumulam, a célula degenera e se transforma em um câncer.
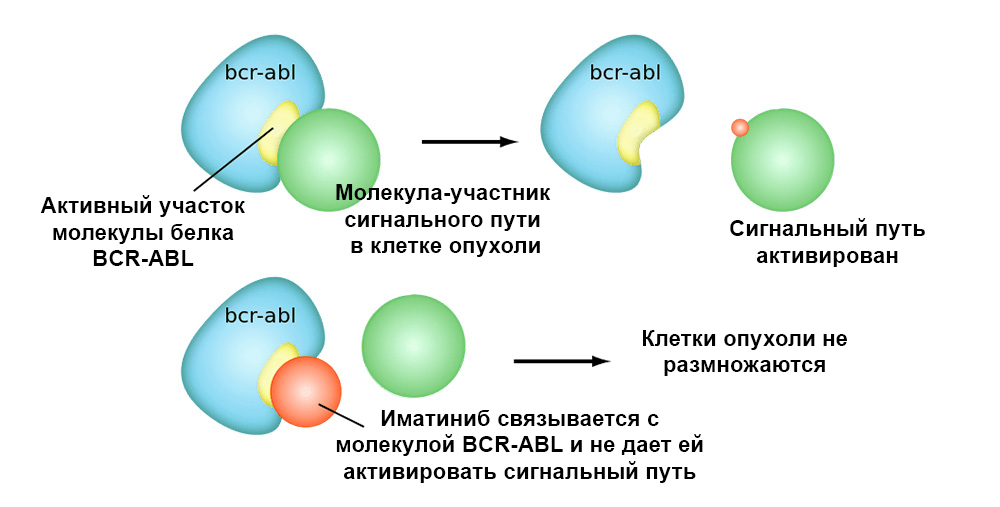 O imatinibe se liga ao local ativo da molécula de proteína BCR-ABL e bloqueia sua capacidade de interagir com outras moléculas nas vias de sinalização.Os medicamentos direcionados têm 2 vantagens importantes sobre a quimioterapia clássica.Maior eficiência.
O imatinibe se liga ao local ativo da molécula de proteína BCR-ABL e bloqueia sua capacidade de interagir com outras moléculas nas vias de sinalização.Os medicamentos direcionados têm 2 vantagens importantes sobre a quimioterapia clássica.Maior eficiência. A ação direcionada nas células tumorais permite obter uma melhor "resposta" do tumor ao tratamento. Por exemplo, comparada com o tratamento clássico, a adição do medicamento alvo Trastuzumab, juntamente com a quimioterapia para câncer de mama com superexpressão de HER2,
aumentou significativamente a frequência de "respostas" - 81% versus 73% e a frequência de remissão morfológica completa (desaparecimento do tumor) - 43% versus 23%
Menos efeitos colaterais. Quimioterapia clássica com efeito citotóxico. Essencialmente, substâncias tóxicas para matar ou pelo menos retardar o crescimento de células cancerígenas. Acima de tudo, eles agem em células que se dividem rapidamente. É por isso que, por exemplo, o cabelo cai fora: é também um tipo de células que se dividem ativamente e elas “caem na distribuição”. Devido a essa ação não muito direcionada, os medicamentos quimioterápicos produzem efeitos colaterais graves: o trato gastrointestinal e outros órgãos também sofrem.
Na prática
da Medicina 24/7, geralmente prescrevemos medicamentos direcionados como parte de um tratamento abrangente: combinamos quimioterapia, alvo e imunoterapia.
A dificuldade é que cada tumor é único em seu conjunto de mutações "alvos"Assim como cada pessoa tem um código de DNA único, os tumores são únicos. Afinal, eles "nascem" das próprias células do corpo. Não há tumores com as mesmas propriedades moleculares genéticas. Portanto, criar uma “pílula” universal para o câncer é fundamentalmente impossível. O câncer é uma doença muito individual.
Mas o tratamento para ele deve ser apropriado - selecionado individualmente para um paciente em particular - com base no fato de determinarmos mutações em suas células tumorais.
No passado recente, os tumores malignos podiam ser classificados apenas pela histologia, isto é, dependendo de qual órgão eles se originaram e como as células cancerígenas se pareciam ao microscópio.
Para usar efetivamente a terapia direcionada, isso não é suficiente. O médico deve saber quais são as mutações nas células tumorais de um paciente em particular, se existem “marcadores” de biomarcadores para este ou aquele medicamento. Medicina personalizada como ela é.
Para isso, usamos estudos genéticos moleculares. Para encontrar os "alvos" para os quais você precisa atingir medicamentos direcionados e imunotrerapevticheski - é necessário determinar de quais genes o DNA do tumor é coletado e quais genes são "quebrados". Como resultado:
- aprendemos a sensibilidade do tumor às drogas;
- descubra se o tumor tem resistência a certos medicamentos;
- descobrir as características genéticas que dão hipersensibilidade às drogas;
- escolheremos um novo tratamento se o tumor parar de responder à terapia padrão;
detectar um tumor / metástase em um estágio muito inicial - por fragmentos de seu DNA no sangue; - podemos prever um curso favorável ou agressivo da doença.
A amostra é geralmente o tecido tumoral, colhido durante a operação para remover o foco primário ou uma biópsia - uma parte microscópica do tumor é colhida com uma agulha longa e fina especial.
Você pode procurar o DNA das células tumorais no sangue - então você precisa da chamada biópsia líquida, dois tubos de ensaio com sangue de 8,5 ml cada.
Durante uma biópsia, geralmente encontramos o fato de que muitos pacientes têm medo de tocar o tumor completamente - eles temem que isso provoque seu crescimento. Até o momento, não há estudos disponíveis que mostrem esse relacionamento. Obviamente, uma biópsia deve ser realizada corretamente. Quando fazemos uma biópsia, os médicos costumam marcar o local de entrada da agulha: eles fazem uma pequena tatuagem (existe um instrumento assim) ou colocam um suporte (cirúrgico). Se uma operação for necessária mais tarde, eles eliminam todo o curso em que a agulha estava - da pele ao tumor -, por isso reduzimos ainda mais a chance de as células cancerígenas se espalharem além do tumor.Em seguida, as amostras são enviadas ao laboratório de estudos genéticos moleculares.Lá, o DNA do tumor é isolado da amostra e sequenciado. Ou seja - eles “leem” a sequência de “letras” - nucleotídeos. E então o comparam com um painel de diagnóstico selecionado no banco de dados de bibliotecas - já descriptografou genomas de milhares de outras pessoas. O painel é selecionado para cada paciente - levando em consideração o histórico e os dados clínicos. Tudo isso, é claro, é feito por seqüenciadores automáticos e um computador.
E se há 20 anos a “leitura” do genoma levou meses, foi necessária uma descriptografia lenta e complexa, hoje no laboratório com o qual trabalhamos, uma análise é feita em poucos dias úteis.
Além disso, vários métodos são usados ao mesmo tempo:
sequenciamento de uma nova geração (NGS), sequenciamento de Sanger e o método de hibridização por fluorescência (FISH) . Juntos, eles permitem a leitura de toda a sequência de DNA de um tumor, a descoberta de mutações no driver - ou seja, aquelas que iniciaram o processo maligno e agora podem ser direcionadas pela terapia direcionada - e até a visualização de todo o cariótipo (conjunto de cromossomos).
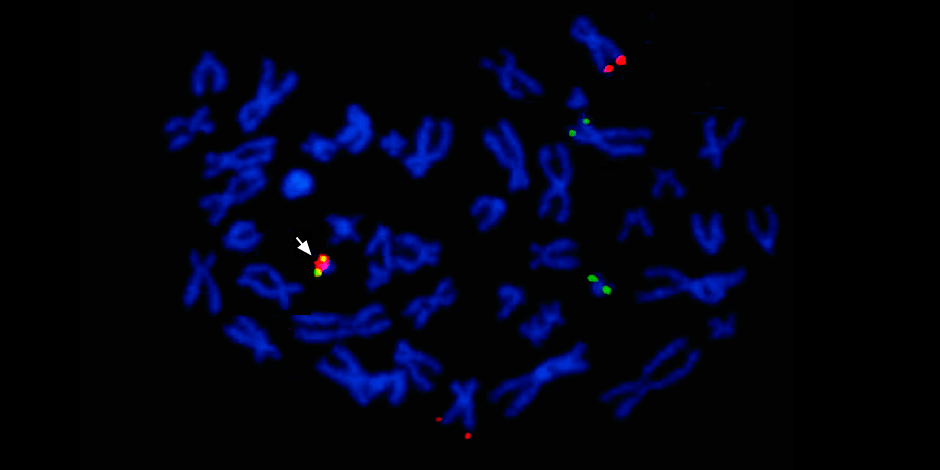 Sob a seta à esquerda - a fusão do sinal vermelho e verde - evidência da fusão do material genético dos cromossomos 9 e 22 com a formação do cromossomo quimérico da Filadélfia.
Sob a seta à esquerda - a fusão do sinal vermelho e verde - evidência da fusão do material genético dos cromossomos 9 e 22 com a formação do cromossomo quimérico da Filadélfia.Além disso, um estudo genético molecular completo determina necessariamente a
instabilidade dos microssatélites (MSI, instabilidade dos microssatélites) - uma violação do mecanismo de reparo do DNA, que leva ao rápido acúmulo de mutações nas células. Esse fator permite que você faça uma previsão sobre o curso adicional da doença.
Após a obtenção do perfil genético molecular do tumor, inicia-se sua análiseProgramas especiais processam os resultados e fazem recomendações automaticamente. Mas essas recomendações são necessariamente supervisionadas manualmente por uma equipe de especialistas. A análise envolve genética, bioinformática, oncologistas, imunologistas e quimioterapeutas. Nesta fase, refinamentos e adições ocorrem necessariamente.
Dependendo da solicitação, esse estudo pode levar
de 5 a 15 dias úteis : um paciente só precisa determinar o tipo de tumor e esclarecer a terapia recomendada - basta verificar a presença de um conjunto básico de 20 mutações no DNA, de acordo com as recomendações das associações mundiais de câncer. E outro, com um diagnóstico raro ou resistência ao tratamento padrão - você precisa fazer um "passaporte molecular" do tumor e, para isso - sequenciar 400 genes.
Como resultado, na primeira parte do relatório, todas as mutações encontradas no tumor do paciente e os medicamentos direcionados que serão mais eficazes nesse caso são
registrados .
A terapia direcionada é aprovada para esse tipo de tumor com mutações detectadas e a terapia direcionada é aprovada para o tratamento de outros tipos de câncer com as mesmas mutações. Na prática, tivemos casos em que medicamentos de segunda ordem, off label, foram prescritos e agiram bem.
Além disso, a equipe do laboratório faz um excelente trabalho de monitoramento da pesquisa científica, o que pode ser significativo no caso desse paciente.
A segunda parte do relatório contém uma visão geral dos estudos existentes na época com dados detalhados sobre a frequência de ocorrência dessa mutação, o efeito de vários medicamentos e a possibilidade de usar um ou outro tipo de terapia direcionada para mutações identificadas. Isso ajuda a fazer pelo menos um prognóstico aproximado para o paciente.
A terceira parte do relatório contém estudos clínicos relevantes nos quais o paciente pode participar para receber tratamento experimental. Este é o método de emergência mais recente, mas conhecer todos os detalhes sobre ele é útil para a tranqüilidade do paciente.
Como resultado, a partir deste relatório, o médico recebe o perfil genético molecular mais completo do tumor maligno. Ele tem informações sobre o que exatamente tratamos, que desagregação específica em uma célula. Há um entendimento “mais recente” de quais medicamentos estão atualmente aprovados ou disponíveis para uso em ensaios clínicos.
 O relatório é bastante pesado - 30 páginas de leitura de tirar o fôlego
O relatório é bastante pesado - 30 páginas de leitura de tirar o fôlegoQuem precisa disso?
Aqueles que desenvolveram resistência ou intolerância a todos os medicamentos a partir do protocolo de tratamento padrão.
A situação em que "todos tentaram - não ajudou"., , (NCCN), « 24/7», – « » .
, 1- – , . . – – – 2- – , . – 3- , .. «» .
, , : , «» , . – . , , . – , , .
– «», . , off-label, . , ?
- , , . – .
. , . , , 80% , 20% – . , - , 80% , 20% .
- , , . , , . , : , , , . , , 10 – 10 .
30% – . , – : 600 . , , HER2/Neu.
. - – , – . , . 600 . ., 5 – , , , . .
- . . «» . , , , , ..
, . (, , ) – , .
, , «». – .
, , .
, 48 , ( ). , . , , . .
- . , 600 . , , 250, – , .
, . EGRF – .
4 . 5 , . , , 4 , .
,
« 24/7» , – .
.