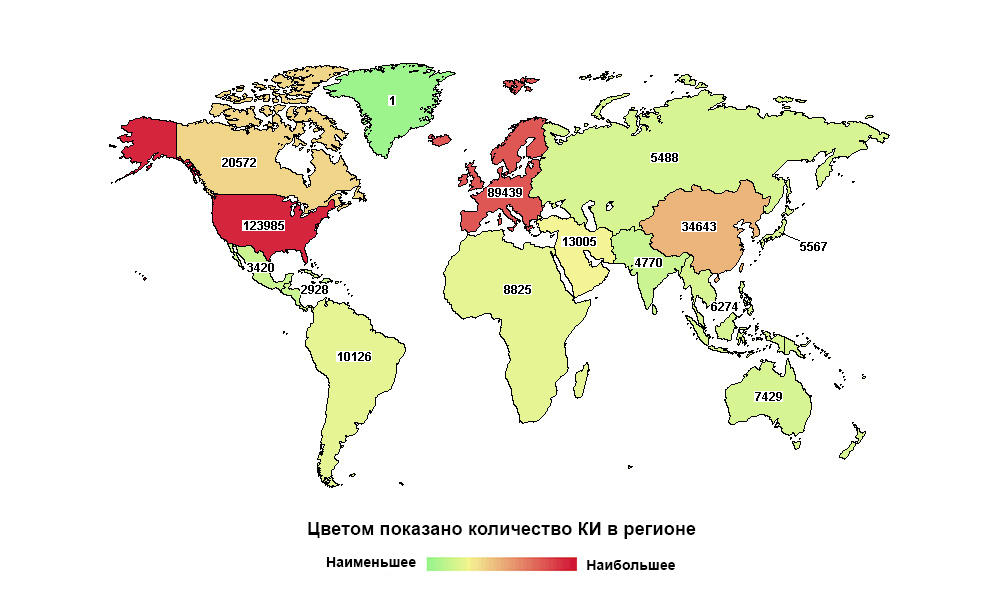
 A Rússia está longe de ser a primeira do mundo, mas a primeira em número de estudos em sua macrorregião
A Rússia está longe de ser a primeira do mundo, mas a primeira em número de estudos em sua macrorregiãoQualquer medicamento hoje, antes de chegar ao paciente, passa por uma longa série de ensaios clínicos. É necessário provar que é capaz de resolver um problema de saúde específico e fazê-lo de maneira mais eficaz e, de preferência, mais segura que seus antecessores.
A seleção é restrita - 98% de todos os medicamentos estudados não chegam aos pacientes. Em 2% dos “sortudos”, a pesquisa científica sobre uma nova substância antes de entrar no mercado leva mais de 12 anos e mais de 1,5 bilhão de dólares.
Na Clínica
Medicina 24/7, estamos diretamente envolvidos em ensaios clínicos. Pelo segundo ano consecutivo, realizamos ensaios clínicos de medicamentos antitumorais estrangeiros. Com a nossa ajuda, novos medicamentos têm acesso à Rússia mais rapidamente e mais de 100 pessoas por ano - outra chance de tratamento, gratuitamente.
Para clínicas privadas, a prática é incomum: um mínimo de benefícios comerciais, muitas dificuldades na organização do processo e requisitos estritos para uma instituição médica. Normalmente, apenas grandes centros federais conseguem cumpri-los.
Mas para muitos pacientes na Rússia, um ensaio clínico do medicamento é a única chance de obter tratamento gratuito para uma doença mortal. Mas entre os pacientes russos com câncer, 30% simplesmente não sabem o que é um ensaio clínico e apenas alguns deles participaram.
Portanto, queremos que o maior número possível de pessoas aprenda e verifique: talvez elas tenham a chance de conseguir um medicamento que possa salvar suas vidas.
Neste artigo, explicaremos por que precisamos e como os ensaios clínicos são organizados, quem e como chegar lá.
Histórias tristes. Por que os ensaios clínicos são necessários e por que é ruim sem eles
Pesquisa / ensaio clínico (doravante - IC) - um estudo científico envolvendo pessoas como sujeitos, conduzido para avaliar a eficácia e segurança de um novo medicamento ou expandir as indicações para o uso do já conhecido. Além dos medicamentos, os ICs também podem estudar a eficácia e a segurança de novos métodos de tratamento e diagnóstico.
A medicina está evoluindo e se transformando em uma ciência exata, que não pode prescindir de estatísticas.
Anteriormente, o médico de família conhecia as histórias de todos os seus pacientes de cor, o médico podia viver toda a vida em uma cidade, encontrar e lembrar uma abordagem pessoal para tratar a todos. Além disso, a escolha de poções era pequena: ervas medicinais, sanguessugas, mercúrio e arsênico. A responsabilidade durante o postulado de "toda a vontade de Deus" sobre os médicos era menor.
 O arsênico do final do século XVIII "restaurou" a potência e a artrite "curada" ...
O arsênico do final do século XVIII "restaurou" a potência e a artrite "curada" ... ... e mercúrio, por exemplo, era um laxante e "da sífilis".
... e mercúrio, por exemplo, era um laxante e "da sífilis".Quando a medicina se espalhou, os médicos precisaram desenvolver táticas de tratamento verdadeiramente inconfundíveis. Certos medicamentos deveriam ajudar a maioria dos pacientes sob determinadas condições.
Idealmente, um médico deve usar apenas os métodos de prevenção, diagnóstico e tratamento com uma probabilidade extremamente baixa de obter "resultados aleatórios", porque sua utilidade e eficácia foram comprovadas por muitos experimentos realizados corretamente.
Este é
um medicamento baseado em evidências - a única abordagem adequada para um assunto tão sério como a saúde humana atualmente.
E é a
pesquisa clínica que é a
base da medicina baseada em evidências.
Até meados do século XX (!), Não havia regulamentação da pesquisa sobre novos medicamentos. Para restaurar a ordem, como muitas vezes acontece, foram necessárias algumas tragédias.
Em 1937, 105 crianças e um adulto morreram, tomando o "elixir" da sulfonamida anti-séptica e ... do dietileno glicol venenoso. Sim, o que é usado hoje no anticongelante. Em seguida, a empresa farmacêutica
ME Massengill, sem saber, o usou como solvente, excipiente. Não foram realizados estudos de segurança do "coquetel" resultante para seres humanos. Quando eles subitamente perceberam e apreenderam a droga à venda, já havia mais de cem vítimas. Em 1938, o Congresso dos EUA aprovou uma lei sobre pesquisa obrigatória de drogas antes que elas fossem colocadas à venda. O controle foi confiado à FDA (
Administração de Medicamentos e Alimentos), a Administração de Medicamentos e AlimentosUm escândalo ainda mais alto ocorreu com a
talidomida no final dos anos 50 e início dos anos 60. "Pílulas calmantes e para dormir, que ajudam perfeitamente na toxicose de mulheres grávidas", esgotaram rapidamente. Seus estudos foram realizados apenas em ratos. Acabou que isso não é suficiente. Nos seres humanos, a talidomida causou defeitos no desenvolvimento do feto. Na Europa, Austrália e Japão, cerca de 10.000 crianças nasceram com malformações (malformações) dos membros. A droga foi proibida na maioria dos países em 1961.
 Mães dessas crianças bebiam pílulas para dormir, não testadas em seres humanos
Mães dessas crianças bebiam pílulas para dormir, não testadas em seres humanosDesde então, os medicamentos foram cuidadosamente estudados antes do registro. Isso é regido pelas
Regras Tripartidas Harmonizadas Internacionais de Boas Práticas Clínicas (Diretriz Tripartida Harmonizada para Boas Práticas Clínicas da ICH, abreviada como ICH GCP). De 1996 a 1997, eles operam nos Estados Unidos, Japão e UE, e desde 2003 foram introduzidos na Rússia.Como está indo o estudo e por que há tanto tempo?
Todo o processo de criação do medicamento pode ser dividido em três grandes fases.
1. Procure idéias e estudos pré-clínicos - in vitro e em animais.
2. Se isso não termina aí, começam os estudos clínicos, com as pessoas: primeiro cuidado, depois mais massivas.
3. O medicamento é registrado nas autoridades reguladoras para se tornar um nome familiar nos diretórios médicos.
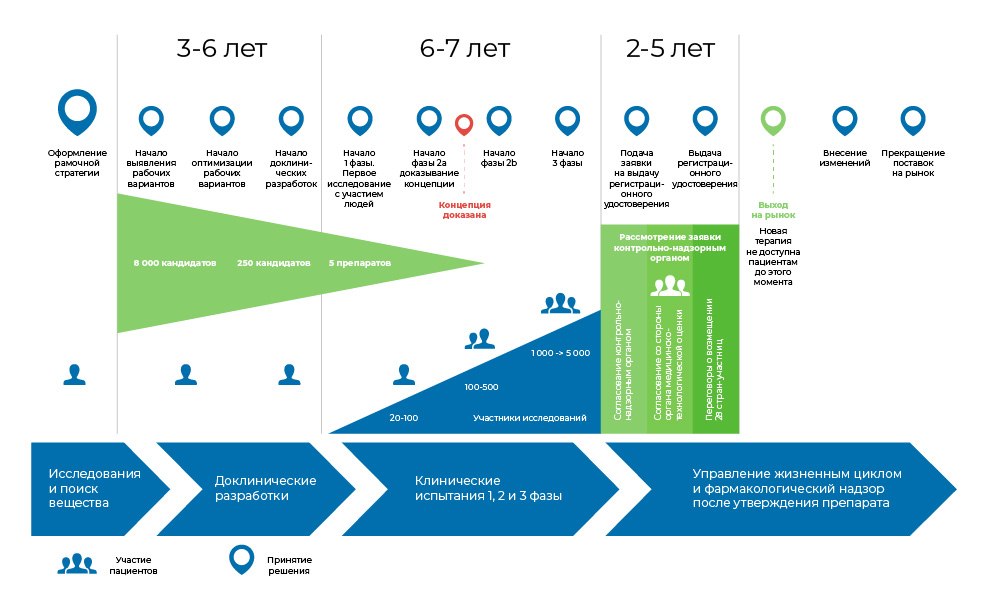 O processo de desenvolvimento de uma droga. Desde o momento em que a molécula é criada até o início da venda do medicamento, leva de 8 a 20 anos.Então, alguém precisa disso?
O processo de desenvolvimento de uma droga. Desde o momento em que a molécula é criada até o início da venda do medicamento, leva de 8 a 20 anos.Então, alguém precisa disso? A oncologia é uma das áreas mais flagrantes da medicina em termos da necessidade não atendida de medicamentos. Segundo a Organização Mundial da Saúde, em 2018, o câncer
matou 9,6 milhões de pessoas. Os tumores são frequentemente encontrados nos estágios posteriores, quando apenas o tratamento paliativo permanece.
Ao mesmo tempo, descobertas no campo da biologia molecular e genética permitiram entender os mecanismos que contribuem para o desenvolvimento e a progressão do câncer, e melhorou a compreensão do trabalho da imunidade antitumoral.
E hoje, o desenvolvimento de medicamentos antitumorais é uma das áreas mais populares e intensivas em ciência da medicina.
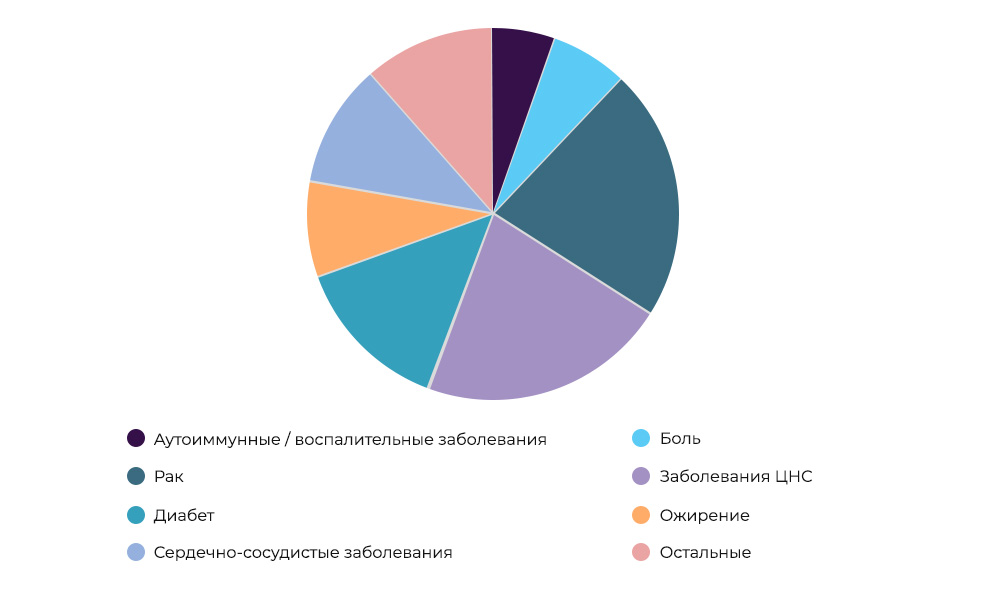 Pesquisa sobre medicamentos anticâncer - 23% de todos os IC no mundoQuem paga pela pesquisa.
Pesquisa sobre medicamentos anticâncer - 23% de todos os IC no mundoQuem paga pela pesquisa. Às vezes, o organizador e o patrocinador podem ser uma organização de pesquisa. Porém, mais frequentemente, os cientistas estão envolvidos em pesquisas científicas às custas das empresas farmacêuticas. Eles esperam entrar no mercado com um medicamento bem-sucedido, obter lucro e recuperar os custos de IC e desenvolvimento. É como comprar um novo filme para locação em um filme: o distribuidor não sabe se ele vai filmar ou não. Produzir novos medicamentos é um negócio muito arriscado.
Anteriormente, muitas empresas farmacêuticas realizavam pesquisas por conta própria, usando a equipe de cientistas. Agora, uma instituição médica que passou na acreditação e atende a certos requisitos pode se tornar uma plataforma e executora do experimento.
Este é exatamente o caso do nosso
"Remédio 24/7" . A empresa farmacêutica está pronta para pagar, mas as finanças são alocadas no final do estudo, pelo fato dos custos incorridos. A clínica não ganha nenhum lucro. E os médicos pesquisadores geralmente não ganham nada além do salário habitual. Pelo contrário, esta é a posição do chefe da clínica: uma pessoa considera correto avançar o medicamento do país e aproveita a oportunidade para participar dele.
Primeiro, surge uma ideia. Na verdade, o que investigar? Na oncologia, os “alvos” são encontrados pela primeira vez - um ponto fraco da doença. Se você interrompe ou simplesmente "desliga" as moléculas alvo, o tumor "sofre". Muitos medicamentos modernos contra o câncer,
direcionados ou
imunoterapêuticos, são construídos sobre esse princípio.
 O mecanismo de drogas direcionadas no câncer colorretal. As células cancerígenas param de se dividir ou crescem vasos sanguíneos adicionais ao tumor, ou o medicamento protege as células vizinhas de se tornarem malignas
O mecanismo de drogas direcionadas no câncer colorretal. As células cancerígenas param de se dividir ou crescem vasos sanguíneos adicionais ao tumor, ou o medicamento protege as células vizinhas de se tornarem malignasPara encontrar essas substâncias e, em seguida, escolher os candidatos mais adequados, são necessários muitos recursos e tempo para
estudos in vitro e silicio - ou seja, in vitro ou usando simulação por computador.
A substância selecionada é armazenada na quantidade certa - produzida de acordo com regras especiais (na Rússia é GOST R 52249-2009), sem impurezas e violação da tecnologia. E com esses tubos de ensaio, os cientistas vão testar a droga em animais.
O mouse é o motor do progresso. Depois de testar as idéias in vitro, um cientista com um suprimento de sua droga em potencial vai ao viveiro - você precisa verificar como o protótipo se comporta no corpo de um mamífero (in vivo).
Mesmo em 1025, Avicenna escreveu no "Canon of Medical Science" que os medicamentos devem ser verificados. Além disso, é desejável - em um paciente em potencial, uma pessoa. Afinal, o resultado obtido em leões e cavalos não garante que o medicamento afete as pessoas da mesma maneira.
E ainda na medicina, sem experimentos em animais - não posso fazer. Os leões e cavalos, no entanto, foram deixados sozinhos. Estudos pré-clínicos em todo o mundo ocorrem principalmente em ratos, porquinhos-da-índia e coelhos.
 Os ratos de laboratório até colocaram um monumento no Novosibirsk Academgorodok
Os ratos de laboratório até colocaram um monumento no Novosibirsk AcademgorodokNesta fase, verifique o quão nocivo / seguro é o medicamento:
- causa alergias
- tem efeitos tóxicos nos tecidos e órgãos,
- como isso afeta a capacidade dos animais de se reproduzirem e o desenvolvimento normal do feto, etc.
Além disso, eles observam como o candidato a medicamentos se comporta dentro do corpo do animal (farmacocinética):
- taxa de absorção e aumento da concentração sanguínea,
- qual é a dose máxima e mínima
- a rapidez com que é excretada do corpo, etc.
Todos esses dados são necessários para decidir
se é possível usar a substância em teste em humanos. E se sim, quanto é necessário.
Mal inevitável. Burocracia O
Departamento de Estado monitora o progresso correto do IC
. regulamentação da circulação de medicamentos do Ministério da Saúde e do Serviço Federal de Supervisão da Saúde (Roszdravnadzor).Se o cientista chegou ao momento em que é necessário prosseguir com os ensaios clínicos em humanos - é hora de preparar um aplicativo para a realização de IC. Para fazer isso, ele precisa de vários
documentos .
- Dossiê do medicamento do estudo. Tudo o que já foi descoberto sobre a droga: dados sobre farmacocinética, eficácia, toxicidade, etc.
- Protocolo de Estudo Ele detalha o plano para futuras pesquisas e métodos para avaliar os resultados;
- Brochura do Pesquisador. Uma pequena folha de dicas para explicar claramente a essência do estudo a voluntários e pacientes e obter seu consentimento informado.
Comitê de Ética. O próximo estágio da busca é obter a avaliação e conclusão do comitê de ética.
O Comitê de Ética é um grupo independente de médicos, cientistas, pessoal médico e não especialistas (membros do público). Eles estudam o protocolo do estudo e o consentimento informado para garantir que foi alcançado um acordo entre o paciente, pesquisadores, empresa farmacêutica e a autoridade reguladora nacional, que os direitos de ninguém foram violados, ninguém foi sujeito a coerção e ninguém violou o livre arbítrio.
Após graves efeitos colaterais de um medicamento em 2006, o comitê de ética tornou-se ainda mais rigoroso. Portanto, às vezes o estudo pode "congelar" nesta fase por um ano ou mais.
Após a verificação de todos os documentos e a aprovação do comitê de ética, o medicamento em potencial entra na fase dos
ensaios clínicos - em humanos.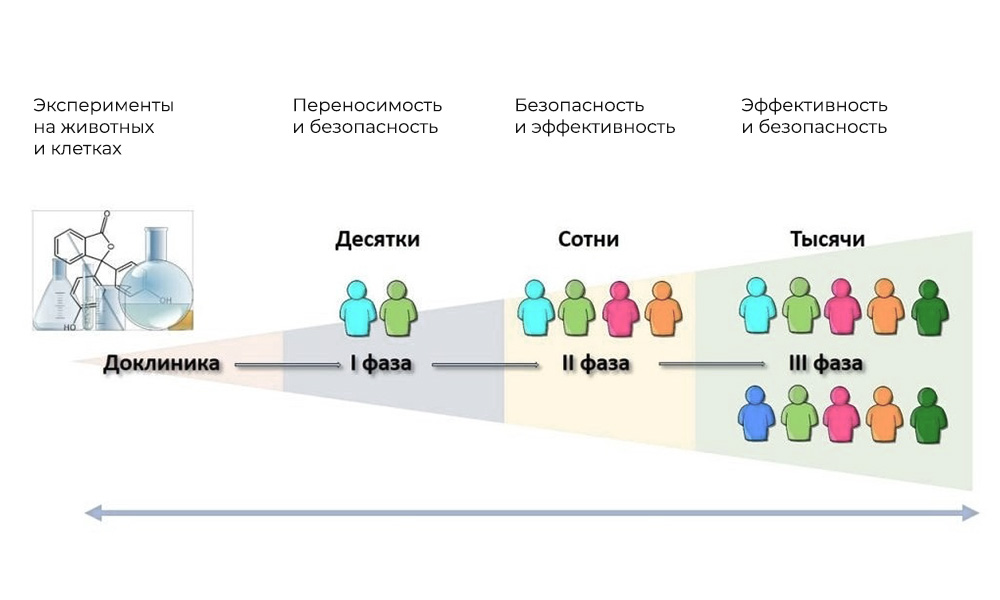 As principais fases dos ensaios clínicos são em seres humanos.
As principais fases dos ensaios clínicos são em seres humanos.Fase I. Testando o mecanismo de ação
Participantes: 20 - 100 pessoas.
Duração: de vários meses a 1 ano.
Objetivo: estudar tolerância, farmacodinâmica e farmacocinética.
Verifica-se se a substância age nos seres humanos da mesma maneira que nos animais, se é segura.
Na primeira fase de um estudo clínico, teoricamente, voluntários saudáveis devem participar, mas os testes oncológicos de substâncias potentes em um corpo saudável não podem ser chamados de éticos. Portanto, pessoas com a doença correspondente estão envolvidas, contra as quais o futuro medicamento pode ser eficaz.
Os participantes são gradualmente injetados com todas as doses maiores do medicamento, começando do mínimo ao máximo permitido. Após cada administração, a condição do paciente é monitorada.
A farmacocinética é avaliada : taxa de absorção e excreção (excreção de substância inalterada), distribuição sobre tecidos e órgãos.
A farmacodinâmica também
é avaliada: o efeito do medicamento nas células tumorais, em outros órgãos e órgãos, efeitos colaterais. A aplicação preferida e o nível de dosagem estão sendo esclarecidos.
Além de estudos com doses crescentes, na fase I, verifique:
- o efeito dos alimentos na droga;
- interação com outras drogas;
- o efeito de outras doenças que podem afetar a dose desejada do medicamento (por exemplo, em um paciente com insuficiência renal).
Segundo o
FDA , 70% dos medicamentos passam com sucesso na primeira fase do IC.
Fase II Verificando a ação para um determinado objetivo: um tipo específico de doença
Participantes: 100 a 500 pacientes.
Duração: de vários meses a 2 anos.
Objetivo: testar a eficácia de certas indicações
É necessário estudar a eficácia do novo medicamento em comparação com o placebo ou com o tratamento existente. Além disso, um número maior de participantes pode detectar efeitos colaterais mais raros que não são detectados na fase I.
Para participar desta fase do IC, os pacientes são selecionados de acordo com um número muito maior de critérios do que na primeira fase. Por exemplo, não apenas “câncer de mama”, mas “câncer de mama, estágio T2N1M0, subtipo HER2 positivo”.
Normalmente, os estudos nesta fase são conduzidos como
duplo-cego, randomizado, controlado por placebo.Ocultação dupla: nem o médico nem o paciente sabem quem está recebendo a substância ativa e quem está recebendo um placebo ou o tratamento ideal atualmente existente.
A randomização implica que os pacientes sejam divididos em grupos aleatoriamente - usando um gerador de números aleatórios. Nem o médico nem o participante no IC podem influenciar esse processo.
O controle do placebo significa que os participantes de um grupo receberão um placebo nas mesmas condições que os participantes de outro grupo que receberam a substância ativa.
 Todos - o mesmo na aparência, sabor e cheiro do medicamento.
Todos - o mesmo na aparência, sabor e cheiro do medicamento.Toda essa "teologia da conspiração" é necessária para excluir a distorção intencional ou inconsciente dos dados experimentais por participantes ou pesquisadores.
Portanto, na primeira fase, onde não existem requisitos rigorosos, há resultados impressionantes. Esta é uma estatística "suja": na fase II, é limpo o excesso e os resultados se tornam plausíveis.
Segundo o FDA, apenas 33% dos medicamentos que atingem a fase II passam por IC e passam para a fase seguinte.
Fase III Estudos de apoio
Número de participantes: 300 - 3.000 ou mais.
Duração: de um ano a vários anos.
Objetivo: confirmação da eficácia e segurança da substância em estudo em amostras grandes.
Essa é a maior, mais complexa e mais cara parte do processo de desenvolvimento de medicamentos. O objetivo de tais estudos é confirmar a eficácia e a segurança da substância em teste quando usada por um grande número de pacientes.
Com base nos resultados dessa fase, os fabricantes de medicamentos recebem permissão para lançá-lo no mercado.
Na fase III, milhares de pacientes de diferentes países podem participar. Tudo deve ser planejado nos mínimos detalhes, para que em todos os lugares do estudo seu design e condições significativas sejam exatamente as mesmas.
O desenho do estudo é tão restrito que não apenas um paciente que está morrendo, mas também um paciente com um prognóstico para remissão estável. O medicamento deve ser tão seguro que possa ser administrado a uma pessoa praticamente saudável - e a qualidade de vida não diminui.
Antes do início da fase III, existem muitas consultas e discussões entre pesquisadores e especialistas terceirizados: é muito importante refletir sobre o projeto de experimentos para não perder o importante e obter todos os dados necessários.
Durante a fase III, a eficácia e segurança do novo medicamento e a relação dose-resposta são finalmente confirmadas.
A correlação de vantagens e riscos é analisada. Com base nos resultados, o órgão regulador decide se é possível levar o medicamento ao mercado. Para fazer isso, as seguintes condições devem ser atendidas:
- o medicamento é mais eficaz do que os análogos conhecidos anteriormente,
- produz menos efeitos colaterais / melhor tolerado
- eficaz quando os medicamentos conhecidos anteriormente não funcionam,
- mais rentável economicamente,
- mais fácil de usar.
O processo de revisão do aplicativo pelo supervisor leva de 12 a 18 meses.
De acordo com o FDA, a terceira fase dos ensaios clínicos termina com um resultado positivo em apenas 25 a 30% dos casos de todos os que estavam no início da terceira fase.
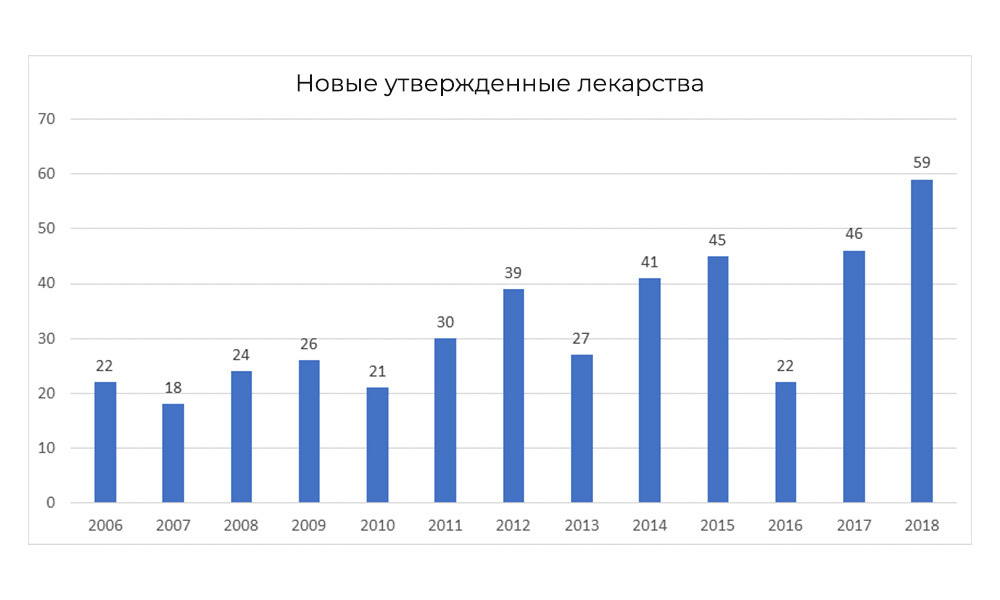 No entanto, em 2018, o FDA quebrou seu próprio recorde para o número de medicamentos aprovados.
No entanto, em 2018, o FDA quebrou seu próprio recorde para o número de medicamentos aprovados.Características da pesquisa nacional: uma fase adicional da IC na Rússia
O controle de novos medicamentos na Rússia tem seus próprios bugs (ou recursos, como parecer). De acordo com a lei, os medicamentos estrangeiros aprovados devem passar por ensaios clínicos adicionais na Rússia: supostamente, isso aumentará a qualidade dos medicamentos estrangeiros.
3 , , . , , , 3 , , .
, 12 – 12 , . , 6 12. , , , , .
2-3 .
« 24/7» III.
. , « ». , . , – , , .
, III – – , «» .
, . .
-,
GCP, Good Clinical Practice.-, . , - : - . . .
-, . , , , , , , – . – : , .
 –
–, , , , .
1 200 , . : , , , , . « » – - .
2 3 , .
2 :
. , , , , .. —
. .
– , , .
, . «», : , , / , – .
. , – . , .
18 .
, – , , 3-4 . : 10 , – .
, , .
– – . , . , , .
, , , , – – . .
, .
–
RosOncoWeb ,
CTAgency .
« 24/7» – .