À medida que as ferramentas para o estudo da biologia melhoram, os pesquisadores começam a revelar os detalhes das microproteínas, que, aparentemente, são fundamentais para alguns processos celulares, incluindo aqueles relacionados ao câncer. As proteínas são constituídas por cadeias de aminoácidos ligados e a proteína humana média contém cerca de 300 resíduos de aminoácidos. Enquanto isso, as microproteínas contêm menos de 100 resíduos de aminoácidos. Os cientistas mostraram recentemente que uma das microproteínas, PIGBOS, composta por 54 aminoácidos, ajuda a aliviar o estresse celular.
Trabalho sobre isso por Alan Saghatelian et al. foi publicado na Nature Communications.
O estudo começou quando os cientistas descobriram o PIGBOS nas mitocôndrias.
A primeira tentativa de detectar a proteína PIGBOS através da proteína verde fluorescente (GFP) falhou. A microproteína era muito pequena em comparação com o tamanho da GFP. A equipe de cientistas resolveu esse problema tentando uma abordagem menos comum chamada GFP compartilhada, na qual combinaram apenas uma pequena parte da GFP, chamada beta, com o PIGBOS.
Os pesquisadores foram capazes de ver o PIGBOS e estudar como ele interage com outras proteínas. Quando mapearam a localização do PIGBOS, perceberam que estava na membrana mitocondrial externa, pronta para fazer contato com proteínas em outras organelas. Eles ficaram surpresos ao ver que o PIGBOS interage com uma proteína chamada CLCC1, que faz parte de uma organela chamada retículo endoplasmático (ER).
"O PIGBOS serve como a junção entre mitocôndrias e ER", diz outro co-autor do trabalho, Qian Chu. "Não costumávamos ver isso nas microteínas - e raramente nas proteínas comuns".
Os pesquisadores descobriram que o PIGBOS realmente se liga ao CLCC1 para regular o estresse no ER. Sem o PIGBOS ER, é provável que haja estresse, o que leva a uma cadeia de eventos quando a célula tenta limpar as más proteínas deformadas (resposta ao dobramento inadequado de proteínas, UPR). Se uma célula não consegue se livrar dessas proteínas, inicia uma sequência de autodestruição e morre.
Os cientistas não esperavam ver o papel da proteína mitocondrial na reação da UPR. Esse novo entendimento do PIGBOS abre as portas para futuros tratamentos que podem direcionar as células de estresse.
"No futuro, poderíamos considerar como o PIGBOS está envolvido em doenças como o câncer", diz Q. Chu. "Em pacientes com câncer, o ER é mais estressante do que em uma pessoa normal, portanto, gerenciar o ER do estresse pode ser um bom objetivo".
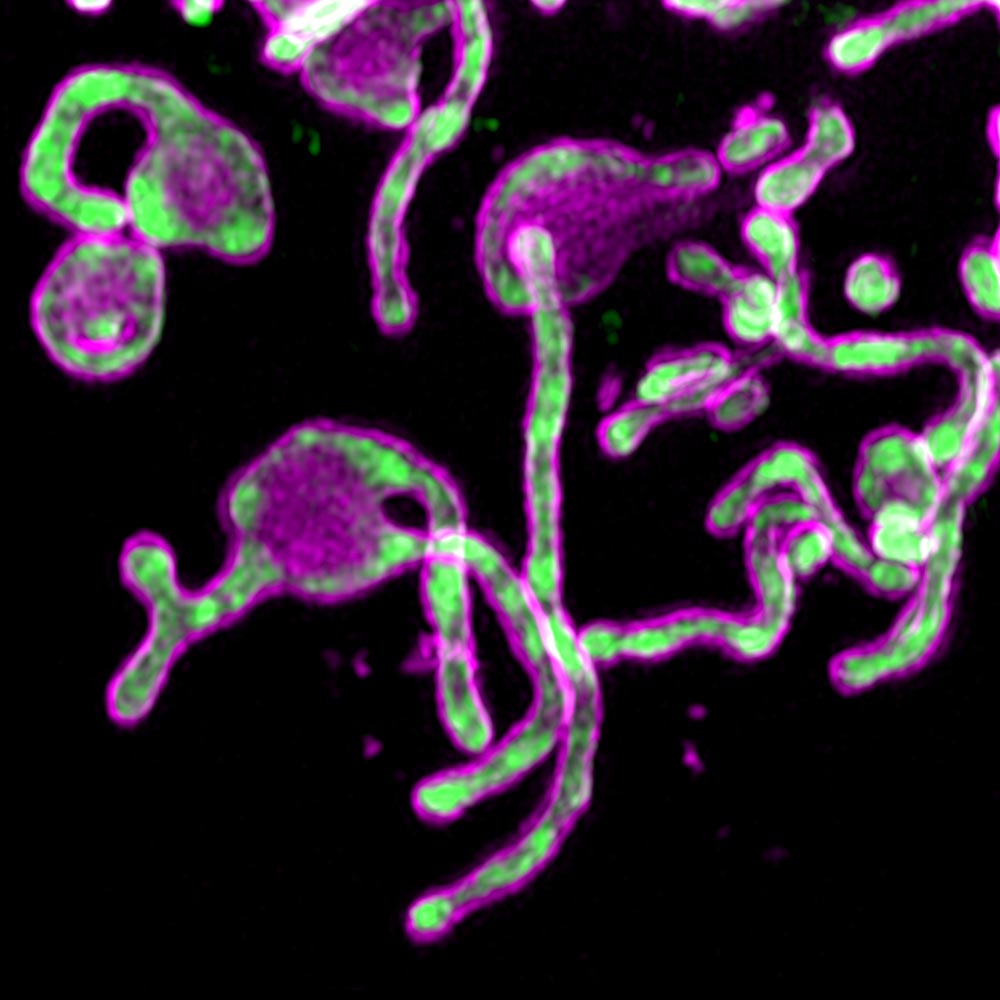 Fig. 1. Imagem por Microproteína PIGBOSwww.salk.edu/news-release/mysterious-microproteins-have-major-implications-for-human-disease
Fig. 1. Imagem por Microproteína PIGBOSwww.salk.edu/news-release/mysterious-microproteins-have-major-implications-for-human-diseaseOs pesquisadores estão interessados em estudar o papel de outras proteínas mitocondriais no estresse no ER, bem como o funcionamento do PIGBOS em modelos animais. A equipe também está avançando na caracterização de uma extensa biblioteca de microteínas que podem ser críticas na biologia celular.
O que são microproteínas?
O termo "microproteínas" refere-se a pequenas proteínas que são codificadas por pequenos quadros de leitura abertos (smORF). Os avanços na tecnologia genômica e proteômica indicam que os genomas de mamíferos contêm centenas a milhares de microteínas codificadas por smORFs. Como uma parte grande e ainda pouco estudada do genoma, as microteínas oferecem uma grande oportunidade para obter uma nova compreensão da biologia moderna.
Não é por acaso que o jornal americano The Scientist chamou as microproteínas de "matéria escura do proteoma humano". Embora o primeiro deles, Id, tenha sido descoberto cerca de 30 anos atrás. Uma característica comum da família das proteínas Id em mamíferos é a sua regulação do destino celular. As proteínas id atuam em vários tecidos e células, incluindo mioblastos, sistema nervoso e sistema imunológico. Além de atuar como moduladores do mecanismo de transcrição e afetar o destino das células em desenvolvimento, as proteínas Id também afetam o controle do ciclo celular e são superexpressas em vários tumores humanos. A função molecular das proteínas Id nos processos de desenvolvimento é bem compreendida, mas pouco se sabe até agora sobre a função das proteínas Id nos adultos.
Até o momento, apenas alguns smORFs e microteínas são bem caracterizados. Por exemplo, alguns smORFs específicos do músculo nos permitiram descrever novas vias que controlam a função e o desenvolvimento muscular. A microproteína humana MOTS-C regula a homeostase metabólica, a microproteína NoBody (polipeptídeo dissociador do corpo P não anotado) interage com proteínas de clivagem de mRNA, que são os componentes moleculares do primeiro passo enzimático na via de quebra do mRNA. E uma microteína chamada CYREN regula a escolha da via de reparo do DNA durante o ciclo celular.
O mecanismo de ação atualmente conhecido das microproteínas é suprimir a formação de complexos de proteínas. E é assim que parece. Muitas proteínas cumprem suas funções agindo como parte de complexos multiproteicos. A formação desses complexos é estritamente regulada e mediada pelos domínios de interação proteína-proteína. A interrupção do complexo ou da capacidade das proteínas de formar homodímeros, heterodímeros ou multímeros pode ter sérias conseqüências para a função celular. A este respeito, a formação de dímeros e multímeros pode ser interrompida por microteínas. As microproteínas se comportam como reguladores pós-traducionais, formando dímeros homotípicos com seus alvos e atuam através da supressão dominante-negativa da função do complexo proteico.
Simplificando, as microproteínas interferem no trabalho complexo de proteínas maiores, inibindo alguns processos celulares e estimulando outros. Estudos mostram que a ação das microteínas é evolutivamente conservadora e comum aos reinos animal e vegetal. Os resultados de estudos primários mostram que as microproteínas estão envolvidas em processos imunológicos, controlam a destruição de moléculas de RNA com defeito, protegem as bactérias do calor e do frio, determinam o período de floração das plantas e servem como fonte de toxinas de muitos tipos de venenos de animais. Segundo os cientistas, parece que as microproteínas estão envolvidas em todos os processos biológicos. Pouco antes de eles não prestarem atenção.
É provável que muitos outros processos celulares importantes também sejam mediados por microteínas não descritas. Tanto a detecção quanto a caracterização de smORFs e microteínas são uma importante tarefa de pesquisa.
Apesar dos mistérios restantes, os cientistas já estão testando o uso potencial dessas moléculas. Uma empresa vende inseticidas derivados de microproteínas encontradas no veneno de um atracido australiano. Em ensaios clínicos, é testado um agente de contraste baseado em outra pequena proteína no veneno de escorpião. A tarefa desta substância é isolar os limites dos tumores para que os cirurgiões possam extraí-los com maior precisão. Muitas empresas farmacêuticas agora estão procurando microproteínas com potencial médico.
O quão pequenos eles podem ser ainda não está claro. A drosófila precisa de uma microproteína com 11 aminoácidos para produzir patas normais, e alguns micróbios podem produzir proteínas com menos de dez aminoácidos. Mas mesmo as maiores microteínas não atingem proteínas de tamanho médio, como a alfa-amilase, uma enzima de 496 aminoácidos encontrada em nossa saliva e que quebra o amido.
Somente a detecção recente de uma pequena quantidade de microteínas está associada ao critério de reconhecimento gênico estabelecido há cerca de 20 anos. Quando os cientistas analisam o genoma do corpo, costumam escanear quadros de leitura abertos (ORF). Para não se afogar em uma quantidade enorme de dados, no passado, os pesquisadores geralmente descartavam qualquer SRO com uma proteína de menos de 100 aminoácidos em eucariotos ou 50 aminoácidos em bactérias. Por exemplo, no fermento, essa condição limitou a lista de OPCs a cerca de seis mil.
O enfraquecimento deste critério mostra que as células contêm significativamente mais OPC. No início deste ano, os cientistas identificaram fragmentos do genoma de micróbios que habitam quatro partes do corpo humano, incluindo intestinos e pele. Ao pesquisar por pequenos OPCs que podem codificar proteínas de cinco a 50 aminoácidos, os pesquisadores descobriram cerca de quatro mil famílias de potenciais microteínas. Quase metade delas não são semelhantes às proteínas conhecidas, mas a sequência de uma pequena ORS sugere que a proteína correspondente está localizada nos ribossomos - e isso indica que ela pode desempenhar algum papel fundamental. Quando os cientistas negligenciaram os pequenos OPCs, não apenas os genes com algumas funções raras foram perdidos, mas também os genes com funções-chave.
Outras células também contêm um grande número de OPCs curtos: a levedura, por exemplo, é capaz de produzir mais de 260 mil moléculas com um espectro de dois a 99 aminoácidos. Mas as células quase certamente não usam todos esses ORSs, e algumas das cadeias de aminoácidos que produzem podem não ser funcionais.
Weissman et al. encontraram microproteínas de outra maneira: usando o método que inventaram, visando a uma identificação mais ampla de que tipo de proteínas são produzidas pelas células. Para formar qualquer proteína, a célula primeiro copia o gene em um mensageiro de RNA. Então os ribossomos leem o mRNA e ligam os aminoácidos em uma ordem específica. Ao sequenciar o mRNA ligado aos ribossomos, Weissman e sua equipe determinam com precisão quais deles realmente se transformam em proteínas e onde o ribossomo começa a "ler" o RNA. Em um estudo de células de 2011, um cientista com sua equipe aplicou esse método de criação de ribossomos, também chamado Ribo-seq, a células-tronco embrionárias de camundongos e descobriu que as células produzem milhares de proteínas imprevistas, incluindo muitas nas quais o número de aminoácidos estará abaixo do limiar de 100 unidades. "Estava claro que o universo padrão ignorava o vasto universo de proteínas, muitas das quais eram curtas", diz Weissman.
Saghatelian e colegas adotaram uma terceira abordagem para detectar a abundância de microteínas em nossas próprias células. Os cientistas usaram análises espectrométricas de massa, nas quais as proteínas são divididas em fragmentos classificados de acordo com a massa, a fim de identificar o espectro de identificação de cada proteína. Saghatelyan e colegas aplicaram esse método a misturas de proteínas de células humanas e subtraíram deles os sinais de tipos conhecidos de proteínas. Este método revelou espectros de 86 pequenas proteínas anteriormente desconhecidas, as menores das quais com 18 aminoácidos, como observaram os cientistas em um artigo da revista Nature Chemical Biology em 2013.
Tamanho pequeno limita o potencial protéico. As proteínas maiores combinam-se em formas complexas destinadas à implementação de certas funções, por exemplo, catalisando reações químicas. Não é provável que proteínas contendo de 50 a 60 aminoácidos formem compostos. E, portanto, eles não são adequados para a formação de enzimas ou proteínas estruturais.
No entanto, seu tamanho pequeno também abre certas possibilidades. Eles são pequenos o suficiente para caber nos cantos de proteínas grandes que funcionam como canais e receptores. As proteínas pequenas geralmente compartilham trechos curtos de aminoácidos com seus parceiros maiores e, portanto, podem se ligar e alterar a atividade dessas proteínas. As microproteínas ligadas também podem direcionar moléculas grandes para novos locais - por exemplo, facilitando sua penetração nas membranas celulares.
Devido à sua atração por proteínas maiores, proteínas menores podem dar às células uma maneira reversível de ativar ou desativar proteínas maiores. Em um estudo de 2016 publicado na revista PLOS Genetics, Stephan Wenkel e colegas usaram plantas Arabidopsis geneticamente modificadas para produzir uma quantidade adicional de duas pequenas proteínas. As plantas geralmente florescem em um momento em que o dia é longo o suficiente, mas após o nascimento de uma quantidade excessiva de dois tipos de microteínas, a floração foi adiada. Pequenas proteínas provocaram esse atraso ao bloquear a grande proteína chamada CONSTANS. Eles ligam CONSTANS a outras proteínas inibidoras que o desativam.
Em 2016, Saghatelyan e seus colegas descobriram que as células humanas produzem uma proteína contendo 68 aminoácidos, que eles chamaram de NoBody. Esta proteína pode ajudar na destruição de moléculas de RNA defeituosas ou desnecessárias. O nome "Nikto" reflete o papel dessa proteína na prevenção da formação de corpos processuais, aglomerados misteriosos no citoplasma, onde a destruição do RNA pode ocorrer. Quando não há proteína suficiente, são formados mais corpos processuais, o que acelera a destruição do RNA e altera a estrutura interna da célula. "Isso prova que pequenas proteínas podem ter um enorme efeito dentro da célula", dizem os cientistas.
Músculos dependem de muitas microproteínas diferentes. Durante o desenvolvimento do embrião, as células musculares individuais se fundem em fibras que desencadeiam a contração. A proteína Myomixer de 84 aminoácidos combina-se com uma proteína maior para conectar células, como Olson et al., Apresentado em 2017 em seu trabalho na revista Science. Sem ele, os embriões de ratos não podem formar músculos e são quase transparentes.
Além disso, à medida que se desenvolve, a mioregulina entra em vigor, o que ajuda a regular a atividade muscular. Quando um músculo recebe um estímulo, o armazém celular libera cálcio, estimulando a contração do tecido e a produção de energia. Em seguida, uma bomba de íons, uma proteína chamada SERCA, começa a devolver o cálcio ao armazenamento, permitindo que o tecido muscular relaxe. A mioregulina se liga ao SERCA e o inibe. Esse efeito limita a frequência da contração muscular, provavelmente fornecendo uma reserva de energia para uma emergência, por exemplo, ao fugir de um predador. Outra proteína pequena, a DWORF, tem o efeito oposto de ativar a SERCA e estimular a contração muscular sistemática.
Até organismos minuciosamente estudados, como a bactéria E. coli (Escherichia coli), escondem pequenas proteínas inesperadas que desempenham um papel importante. Storz et al. relataram em 2012 que uma proteína de 49 aminoácidos anteriormente desconhecida, chamada AcrZ, ajuda esse micróbio a sobreviver quando exposto a certos tipos de antibióticos, estimulando uma bomba livre de drogas.
o veneno produzido por uma variedade de organismos - incluindo aranhas, escolopendras e moluscos venenosos - também é abundante em pequenas proteínas. Muitos componentes do veneno imobilizam ou matam, bloqueando os canais de sódio ou outros íons necessários para a transmissão de impulsos nervosos. Pequenas proteínas "atingem esses canais iônicos com incrível precisão e poder, dizem os cientistas. Eles são os principais componentes dos venenos e é com eles que a maioria das conseqüências farmacológicas e biológicas estão associadas.
O inseto australiano gigante que come peixe, por exemplo, não depende apenas de mandíbulas afiadas e partes da boca de ponta para derrotar suas presas. Introduz às vítimas uma dose contendo mais de 130 proteínas, das quais 15 são menos de 100 aminoácidos.
Diferentemente das proteínas grandes, como anticorpos, as microproteínas ingeridas de comprimidos ou injeções podem penetrar nas células e modificar suas funções. O captopril, o primeiro de uma classe de medicamentos de alta pressão, conhecido como inibidor da enzima de conversão da angiotensina, foi desenvolvido a partir da pequena proteína encontrada no veneno do calor comum, uma espécie de víbora venenosa. Este medicamento, aprovado para venda nos Estados Unidos em 1981, foi descoberto por acaso, mesmo antes dos cientistas reconhecerem pequenas proteínas como um grupo separado. Até agora, apenas algumas microteínas chegaram ao mercado ou em ensaios clínicos.
Pesquisadores de câncer estão tentando usar a microproteína encontrada no veneno de escorpião amarelo, comum na África e no Oriente Médio. Essa molécula é misteriosamente atraída por tumores. Ao adicioná-lo a uma substância fluorescente, os cientistas esperam destacar os limites dos tumores cerebrais para que os cirurgiões possam extirpar com segurança as áreas afetadas pelo câncer. Ilumina o tumor. Assim, você pode ver suas bordas e detectar a presença de metástases. Em ensaios clínicos, os pesquisadores estão avaliando se uma molécula dupla ajudará os cirurgiões a remover tumores cerebrais em crianças.
Ainda é desconhecida a importância da importância das pequenas proteínas na medicina, mas elas já entregaram várias alegações de biólogos. Norbert Hübner, do Centro Max Delbrück de Medicina Molecular, em Berlim, e colegas descobriram dezenas de novas microteínas em células cardíacas humanas. O grupo revelou sua fonte inesperada: sequências curtas dentro de RNAs não codificantes, ou seja, em uma espécie que antes se pensava não produzir proteínas. Ao identificar 169 RNAs não codificadores longos, provavelmente lidos por ribossomos, Huybner e sua equipe usaram um dos tipos de espectrometria de massa para confirmar que mais da metade deles produz microproteínas nas células cardíacas.
seu trabalho foi publicado este ano na Cell.As seqüências de DNA de outras pequenas proteínas também podem ser encontradas em locais não convencionais. Por exemplo, alguns estão nos quadros de leitura abertos, OPC, proteínas maiores. Os cientistas acreditavam anteriormente que essas seqüências ajudam a controlar a produção de proteínas maiores, mas raramente produzem as próprias proteínas. Algumas sequências de codificação de microteínas recém-detectadas estão mesmo em sequências que codificam para outras proteínas mais longas.Essas surpresas genômicas podem lançar luz sobre como surgem novos genes, diz a bióloga de sistemas evolucionários Anne-Ruxandra Carvunis, da Universidade de Pittsburgh, Pensilvânia. Os cientistas acreditavam anteriormente que a maioria dos genes aparece quando os genes existentes se multiplicam ou se fundem, ou quando as espécies trocam DNA. No entanto, de acordo com Karvunis, as microproteínas indicam que os protógenos podem se formar quando as mutações estabelecem um novo sinal de início e parada na parte não codificante do genoma. Se o OPC resultante produzir uma proteína útil, as novas seqüências permanecerão no genoma e passarão pelo processo de seleção natural, evoluindo ainda mais para genes maiores que codificam proteínas mais complexas.Em um estudo de 2012, Carvounis e colegas descobriram que o fermento transforma mais de mil ORS curtos em proteínas. E isso sugere que essas seqüências são protógenos. Em um novo estudo, Carvounis e sua equipe testaram se a SRO jovem poderia ser benéfica para as células. Eles alteraram geneticamente o fermento para aumentar o resultado de 285 ORSs em evolução recente, a maioria dos quais tem como alvo moléculas menores que as proteínas padrão ou um pouco mais que isso. Em quase 10% das proteínas, um aumento em seus níveis aumentou o crescimento celular em pelo menos um meio."As microproteínas são uma área que cresce rapidamente", diz A. Saghatelian. "Mas acho que este estudo influenciou realmente o entendimento atual da influência das microproteínas na bioquímica e na biologia celular."Links :Regulação da função das proteínas por 'microProteínas'Novo universo de miniproteínas está diminuindo a biologia e a genética celularRegulação da resposta ao estresse do ER por uma microproteína mitocondrial