
Qualquer sistema, não importa quão complexo e com várias camadas, tenha sua própria base - a base sem a qual não funcionaria da maneira que funciona. Na biosfera do nosso planeta também existem tijolos básicos sobre os quais tudo repousa. Eles são autotróficos - organismos que podem converter compostos inorgânicos em orgânicos. Hoje, encontraremos um estudo em que cientistas de Israel criaram em laboratório um novo tipo de bactéria que se alimenta de dióxido de carbono. Quais métodos foram usados no processo de desenvolvimento, como a bactéria se comportou e o que esse trabalho pode significar para a humanidade? Aprendemos sobre isso no relatório do grupo de pesquisa. Vamos lá
Base de estudo
Autotróficos podem ser chamados de uma das criaturas mais antigas do planeta. Acredita-se que os primeiros autótrofos tenham aparecido dois bilhões de anos atrás, quando uma bactéria heterotrófica (incapaz de sintetizar orgânicos de inorgânicos) através da evolução adquiriu a capacidade de fotossíntese. O termo em si foi proposto em 1892 pelo cientista alemão Albert Bernhard Frank.
 Albert Bernhard Frank
Albert Bernhard FrankAlguns organismos estão na encruzilhada da síntese autotrófica e heterotrófica, pois obtêm carbono de compostos orgânicos, mas energia de inorgânicos. Seguindo essa lógica, os autotróficos podem ser divididos em vários principais: fototróficos, quimiotróficos, radiotróficos, litotróficos e mixotróficos. Existem também grupos de transição, cujos representantes são extremamente difíceis de atribuir a uma ou outra margem do espectro de síntese, mas sua classificação ainda não foi concluída.
Os fototróficos , como o nome
indica , usam fótons como fonte de energia, ou melhor, energia solar. É a partir desses organismos que ocorre um tipo de nutrição como a fotossíntese.
Os quimiotróficos são mais próximos da química do que da física. Tais organismos usam várias reações redox como fontes de energia, isto é, quimiossíntese.
Os mais mal estudados e, ao mesmo tempo, o tipo mais curioso são os
radiotróficos - resultado de um fenômeno chamado "estimulação radioelétrica de cogumelos". Este é o processo de estimular o metabolismo microscópico dos fungos devido à radiação ionizante. Pela primeira vez, esses organismos foram encontrados em 1991 como parte do mofo preto, cujas amostras foram obtidas na usina nuclear de Chernobyl. Um pouco mais tarde (em 2006), cientistas de Nova York testaram a hipótese de radioestimulação de fungos e descobriram que três fungos das espécies Cladosporium sphaerospermum, Wangiella dermatitidis e Cryptococcus neoformans, que contêm o pigmento melanina, aumentaram sua biomassa e acetato acumulado (ácido acético, CH
3 OH). ) em um ambiente em que o nível de radiação excedeu a norma em 500 vezes.
Os litotróficos processam compostos inorgânicos na energia e no carbono de que precisam através da respiração aeróbica ou anaeróbica. Somente representantes de arquéias (unicelulares sem núcleo e organelas da membrana) e bactérias podem se orgulhar de quimiolitotrofia.
Os mixotróficos são soldados universais, pois podem usar vários tipos diferentes de alimentos ao mesmo tempo (ou alternadamente, dependendo das circunstâncias), ou seja, sejam fototróficos e quimiotróficos, por exemplo.
Os autores do estudo que estamos considerando hoje acreditam que uma compreensão mais detalhada dos processos de atividade vital dos autotróficos permitirá aplicar o conhecimento adquirido em larga escala. E, na opinião deles, a melhor maneira de estudar a autotrofia é criar um organismo autotrófico sintético. Teoricamente, você pode criar uma bactéria que se alimentará de dióxido de carbono. Mas chamar esse processo de linguagem fácil não muda. Os próprios pesquisadores identificam três etapas principais que devem ser concluídas para que seu trabalho seja realizado.
Em primeiro lugar, para uma transição completa para a nutrição autotrófica, o corpo deve usar o mecanismo de fixação de CO
2 no caminho em que o carbono recebido consiste exclusivamente em CO
2 , e as moléculas de saída são moléculas orgânicas que entram no metabolismo central do carbono e fornecem todos os 12 principais precursores de biomassa.
Em segundo lugar, o corpo deve usar mecanismos enzimáticos para obter energia regenerativa, coletando energia não química (luz, eletricidade etc.) ou por processos redox que não são fontes de carbono.
Em terceiro lugar, o corpo deve regular e coordenar as maneiras de coletar energia e fixar o CO2, para que juntos mantenham um crescimento constante quando o CO2 for a única fonte de carbono.
Anteriormente, foram realizados estudos nos quais eles tentavam criar um organismo que se alimenta de CO
2 , mas nesses trabalhos havia uma grande falha - a presença de compostos orgânicos multibares no interior do corpo, que serviam como fonte "nutricional" de nutrição. Em outras palavras, ainda não foi possível criar um organismo heterotrófico que retire carbono exclusivamente do CO
2 .
Como base metodológica para suas pesquisas, os cientistas usaram
o ciclo de Calvin (
ciclo de Calvin-Benson-Bassam) - uma série de reações bioquímicas durante a fotossíntese em plantas, cianobactérias, etc. Este ciclo é o mecanismo de fixação de dióxido de carbono mais comum.
E o principal experimental foi a bactéria
Escherichia coli , mais conhecida por nós sob o nome "E. coli".
Resultados da pesquisa
Antes de tudo, era necessário realizar a reorganização metabólica e a evolução laboratorial do corpo para realizar a transição para a autotrofia. Foram considerados vários compostos candidatos que poderiam servir como doadores de elétrons para a fixação de CO
2 , o que permitiria a transferência da bactéria para completar a autotrofia.
O formato * foi escolhido como fonte de elétrons, pois esse composto orgânico de um carbono pode servir como fonte da parte redutora do processo, mas não suporta naturalmente o crescimento de
E. coli e não é absorvido pela biomassa.
Formatos * - sais e ésteres de ácido fórmico.
O potencial de recuperação do formato (E
0 = 420 mV) é baixo o suficiente para reduzir o NAD
+ , o principal portador eletrônico da célula (E
0 = 280 mV em
E. coli ). Outra vantagem é que ele pode ser obtido eletroquimicamente de fontes renováveis, enquanto a biomassa será negativa em carbono.
Para coletar elétrons do formato e direcioná-los ao principal reservatório de recuperação de energia celular do NADH (nicotinamida adenina dinucleotídeo), o FDH (formato desidrogenase) ligado ao NAD
+ da bactéria metilotrófica
Pseudomonas sp .
Uma análise estequiométrica (razão de massa do composto químico) da rede metabólica em
E. coli mostrou que a adição de FDH, Rubisco (bifosfato carboxilase de ribulose) e Prk (fosforibulocinase) à rede metabólica de
E. coli seria suficiente para o crescimento autotrófico (imagem abaixo).
 Imagem 1: Esquema de uma bactéria quimotrófica modificada em laboratório E. coli.
Imagem 1: Esquema de uma bactéria quimotrófica modificada em laboratório E. coli.Infelizmente, a co-expressão de três enzimas recombinantes na cepa primária de
E. coli (BW25113) não levou ao crescimento em condições autotróficas. Como a análise estequiométrica não leva em consideração a cinética da enzima, o nível de expressão e a regulação, optou-se por usar a evolução adaptativa do laboratório como uma ferramenta para otimização metabólica para obter crescimento autotrófico.
Esse método se deve ao fato de a expressão heteróloga de um mecanismo enzimático estranho expandir o espaço de possíveis reações metabólicas para a célula, proporcionando a possibilidade de crescimento autotrófico. O problema é que não há garantia de que o fluxo necessário passará por um conjunto de reações recentemente expandido.
Portanto, como o metabolismo central de
E. coli é adaptado ao crescimento heterotrófico, é provável que seja usada uma distribuição de fluxo que suporte o crescimento heterotrófico. É exatamente por isso que a evolução laboratorial foi usada, capaz de redirecionar o fluxo ao longo da via metabólica desejada.
Um dos processos mais importantes da evolução laboratorial é o rearranjo do metabolismo central para estabelecer dependência da corrente de carboxilação de Rubisco e a adaptação do meio de crescimento para suprimir o fluxo pelas vias heterotróficas originais (
2A ). Em outras palavras, foi necessário interromper a bactéria usando os mecanismos heterotróficos do metabolismo, passando para a autotrofia.
 Imagem Nº 2: esquema da estratégia evolutiva desenvolvida para converter a bactéria heterotrófica E. coli em quimiotrófica.
Imagem Nº 2: esquema da estratégia evolutiva desenvolvida para converter a bactéria heterotrófica E. coli em quimiotrófica.Primeiramente, durante a evolução artificial, foram excluídos três genes que codificam duas enzimas no metabolismo central do carbono: fosfofructoquinase (Pfk) na glicólise e glicose-6-fosfato desidrogenase (Zwf) na via oxidativa da pentose fosfato. O primeiro possui duas isoenzimas codificadas por dois genes (pfkA e pfkB). Quando as células crescem com
xilose *, esse rearranjo garante que o crescimento celular dependa da carboxilação de Rubisco, necessária para a transição para a quimiotrofia.
Xilose * é um monossacarídeo pentose (C5H10O5).
Em seguida, foi realizada a expressão heteróloga de Rubisco, Prk, anidrase carbônica (CA), que converte CO
2 e bicarbonato e FDH. A seguir, é apresentado o processo de crescimento de células em
quimiostatos com xilose limitada
* , que suportam as células em constante fome de carbono.
O quimostato * é um método de cultivo de microrganismos quando o equilíbrio e a concentração ideais de substratos são mantidos no meio nutritivo em que crescem.
Esse meio de cultura permite a proliferação das células (crescimento de tecidos por divisão celular), mas retarda as vias
catabólicas heterotróficas
* .
Catabolismo * - decomposição metabólica de substâncias complexas em substâncias mais simples ou oxidação de uma substância (metabolismo energético).
O quimiostato, onde as células foram cultivadas, também continha um excesso de formato e foi constantemente purgado com ar enriquecido com CO
2 (teor
de CO
2 de 10%).
Assim, esse meio de crescimento diminui a heterotrofia, fazendo com que as células tendam a autotrofia. As células são literalmente forçadas a reduzir sua dependência da contribuição externa de carbono do açúcar orgânico.
O método de cultivo estava pronto, era necessário verificar. Uma vez por semana, as amostras foram removidas dos quimiostáticos e testadas quanto ao crescimento em condições autotróficas. Em particular, essas são condições quimio-organotróficas para Escherichia coli, que consistem em um meio do tipo M9 com a adição de 30 mM (milimolar) de formato de sódio em uma atmosfera com alto teor de CO
2 (10%), mas sem nenhuma outra fonte de carbono.
Após aproximadamente 200 dias de propagação em quimiostatos, equivalente a aproximadamente 150 gerações, foi detectado crescimento em meios sem xilose (isto é, em condições autotróficas). Este fenótipo estava presente em todas as amostras daquele dia. No 350º dia, a xilose foi completamente excluída do meio de cultura (
2B ). Crescimento e turbidez sustentados implicavam que células exclusivamente independentes da xilose estavam presentes no quimiostato. Verificou-se que as amostras precisavam de um meio com alta concentração de CO
2 para o seu crescimento, o que sugere um mecanismo de fixação de carbono.
Em seguida, os cientistas escolheram um dos
clones mais robustos em crescimento
* para uma análise mais profunda. O
tempo de duplicação foi estabelecido
* 18 ± 4 horas (
2C ).
Clone * - neste caso, queremos dizer um grupo de células geneticamente idênticas.
Tempo de duplicação * - o tempo que leva para algo dobrar de tamanho.
Era necessário garantir que as células cultivadas fossem realmente autotróficas e, durante o seu crescimento, não havia fontes de carbono "ocultas" ou ativação de formato heterotrófico. Para isso, foram realizadas experiências na marcação de isótopos.
Para começar, os clones evoluídos foram crescidos em um meio com formato marcado com 13C e 13CO2 (10 gerações até que um estado isotópico estável fosse obtido). Em seguida, uma análise de marcadores 13C para vários metabólitos foi realizada por cromatografia líquida e espectrometria de massa em tandem.
13 C * - carbono-13, um isótopo estável de carbono.
Metabolitos * - produtos metabólicos de qualquer composto.
O método de cromatografia líquida e espectrometria de massa em tandem * é um método de pesquisa química que combina cromatografia líquida que separa misturas de vários componentes e espectrometria de massa, o que garante a identidade estrutural dos componentes individuais.
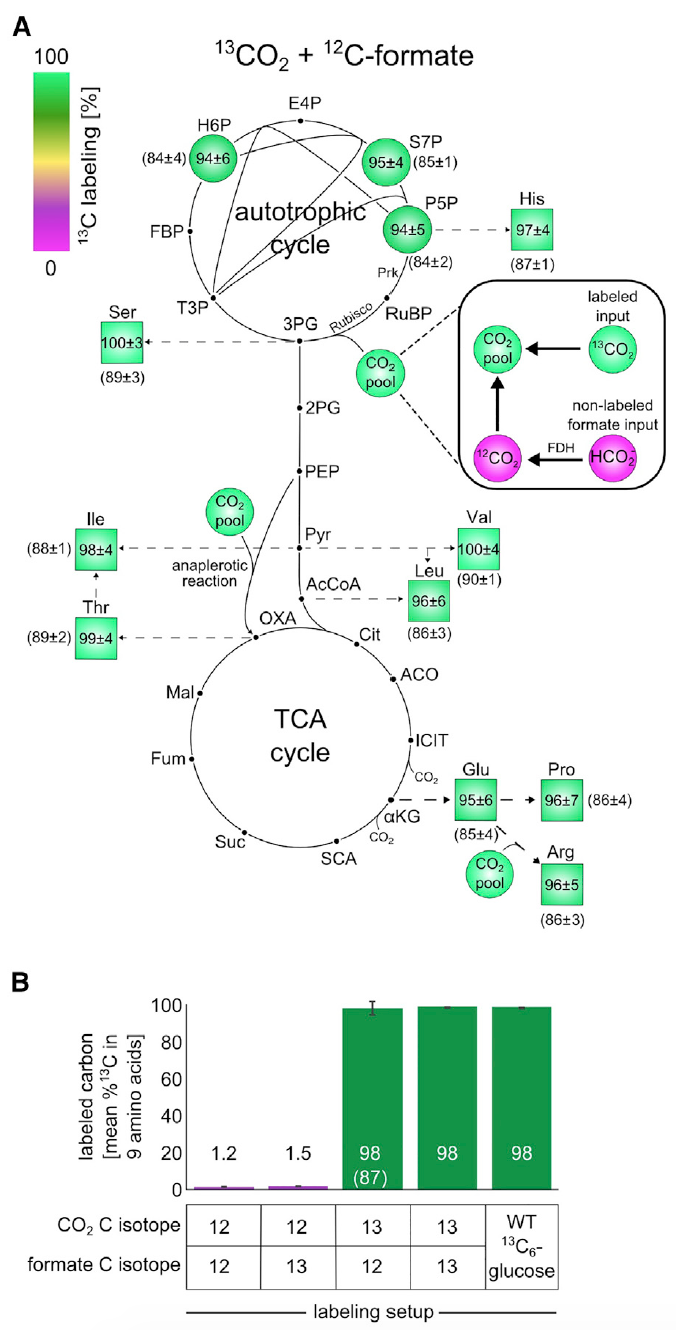 Imagem 3: Experimentos de marcação de isótopos usando 13 C mostram que todos os componentes da biomassa são formados a partir de CO 2 como a única fonte de carbono.
Imagem 3: Experimentos de marcação de isótopos usando 13 C mostram que todos os componentes da biomassa são formados a partir de CO 2 como a única fonte de carbono.A análise mostrou que cerca de 98% dos átomos de carbono nos blocos de construção da biomassa do metabolismo central foram rotulados com sucesso. Esses dados correspondem ao formato marcado e ao CO
2 contendo cerca de 99% de
13 C e 1% de bicarbonato não marcado dissolvidos em um meio nutriente.
Essa observação é uma evidência irrefutável de que o carbono na biomassa das células provém precisamente do CO
2 e do formato.
Além disso, foi verificado se o formato está concentrado na biomassa. Para isso, as células foram cultivadas em meio M9 (a concentração de CO
2 na atmosfera foi de 10%, como em experimentos anteriores) usando formato formatado com carbono 13.
O esquema de marcação de
13 C para blocos de construção da biomassa após o crescimento em um determinado ambiente mostrou uma marca de
13 C dentro de 1-2% (
3B ), que é o valor esperado com base no conteúdo natural de
13 C e em uma pequena quantidade de formato marcado. Em outras palavras, os resultados mostraram que as células não assimilam o formato.
A totalidade dos resultados das experiências acima sugere com confiança que a fonte de carbono para as culturas cultivadas são exclusivamente CO2 e formato. E isso, por sua vez, indica uma autotrofia de cem por cento das células
E.coli que sofreram evolução laboratorial.
Os cientistas realizaram outro experimento para verificar esta afirmação, onde foram utilizados
13 CO
2 e formato não rotulado. Devido ao alto custo de
13 CO
2 , os navios em que o experimento foi realizado foram fechados. Essa pequena nuance é extremamente importante, pois, devido ao ambiente fechado (nos experimentos anteriores, os recipientes foram ventilados), foi acumulado CO2 não rotulado acumulado devido à oxidação do formato. E isso distorce os resultados da observação. No entanto, o processo de “contaminação” pode ser monitorado e até corrigido de olho na análise do glutamato marcado.
Essa experiência mostrou que cerca de 85-90% dos átomos de carbono nos blocos de construção da biomassa do metabolismo central foram rotulados com sucesso. Como pode ser visto nas imagens
3A e
3B , se aplicarmos o ajuste para o componente marcado com 13C, a marcação de átomos na biomassa será quase 100%, o que indica a natureza autotrófica do desenvolvimento da bactéria
E. coli .
O fato de as bactérias terem se tornado autotróficas está fora de dúvida. Resta descobrir que tipo de alterações genéticas, isto é, mutações, ocorreram no processo de evolução laboratorial.
Para esclarecer isso, os cientistas isolaram seis clones capazes de crescimento autotrófico no formato e sequenciaram seu genoma e
plasmídeos * .
Os plasmídeos * são moléculas de DNA fisicamente separadas dos cromossomos e capazes de se replicar autonomamente (o processo de criação de duas moléculas de DNA filha baseadas na molécula de DNA pai).
Dois clones (clone 1 e 2) foram isolados quando a xilose ainda estava presente no meio de cultura (250 dias de evolução), três clones (clone 3, 4 e 5) após a xilose foram excluídos do meio de cultura do quimiostato ( 400º dia de evolução). O último clone (clone 6) é isolado após a propagação de um dos clones anteriormente isolados (clone 1) por vários ciclos de diluição em série.
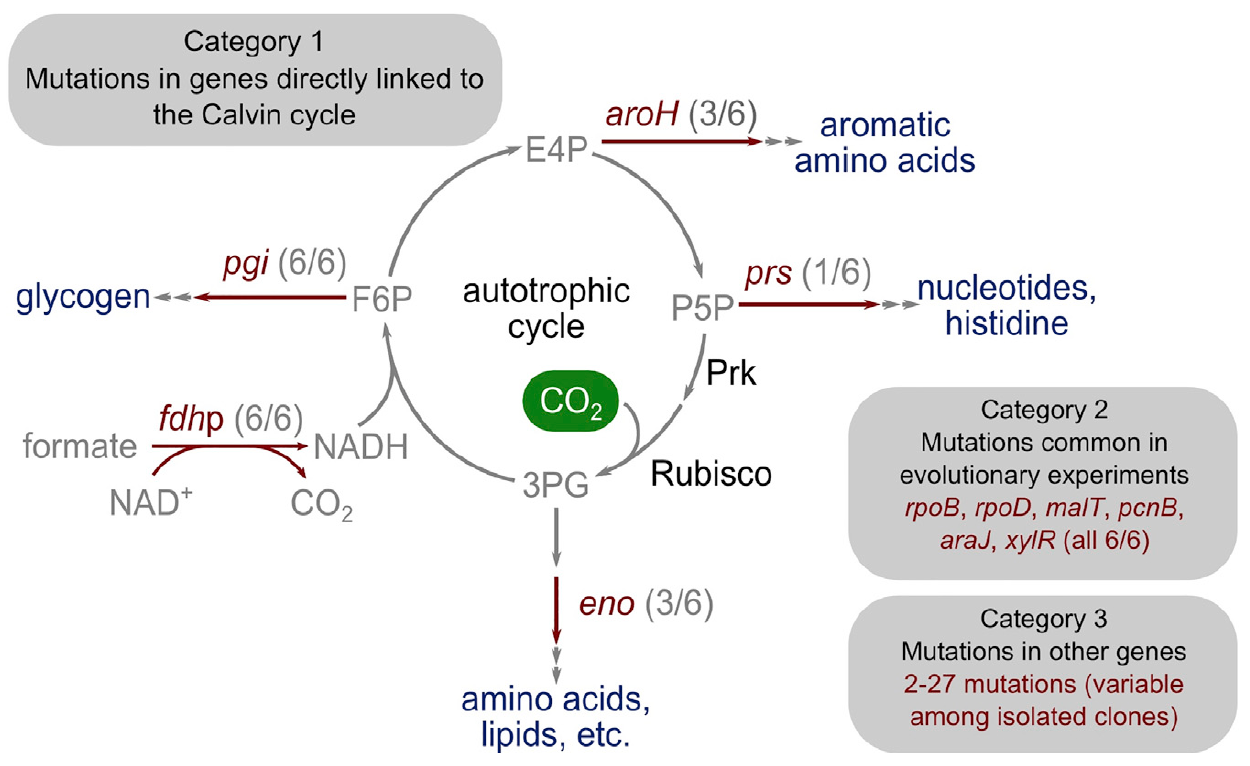 Imagem 4: A base genética da transição para a autotrofia.
Imagem 4: A base genética da transição para a autotrofia.Surpreendentemente, o número de mutações foi bastante pequeno. Os pesquisadores os dividiram em três categorias principais.
A primeira categoria consiste em genes que codificam enzimas com um link metabólico direto com a função do ciclo de Calvin. Esse gene, que codifica a ribose fosfato difosfoquinase, direciona o fosfato ribose para a biomassa.
A segunda categoria de genes mutados consiste naqueles que sofreram mutações em experimentos anteriores sobre evolução laboratorial adaptativa: pcnB (R161P), rpoB (D866E), rpoD (F563S), malT (E359K) e araJ (W156). Os cientistas associam essas mutações ao próprio processo de evolução laboratorial, ou seja, não estão necessariamente associadas ao processo de transição de bactérias para autotrofia. Da mesma forma, uma mutação foi descoberta no gene xylR que codifica uma proteína reguladora para operons responsáveis pelo catabolismo do açúcar D-xilose (E337K). Está associado à fome prolongada de xilose em um quimiostato durante o cultivo, mas não está de modo algum associado à autotrofia.
A terceira categoria de mutações inclui aquelas que não têm um papel característico e podem ser o resultado de um fenômeno como "carona genética". Em diferentes isolados, existem de 2 a 27 genes mutados adicionais, alguns dos quais podem ser mutações do fenótipo autotrófico, mas não são estritamente necessários para isso.
No futuro, os cientistas pretendem realizar estudos adicionais de mutações genéticas para determinar quais delas são básicas e necessárias para a transição de bactérias para autotrofia.
Para um conhecimento mais detalhado das nuances do estudo, recomendo que você analise o
relatório dos cientistas e
materiais adicionais .
Epílogo
Neste estudo, os cientistas foram capazes de alcançar excelentes resultados. Antes de tudo, vale a pena observar a evolução do laboratório - um processo controlado pelos cientistas, permitindo que eles transformem o corpo de acordo com um novo "design".
E. coli foi literalmente forçada pela manipulação evolucionária a se tornar um autotrófico, absorvendo CO
2 para se fornecer carbono. Essa bactéria mutante pode ser extremamente útil para uma sociedade que sofre com o aquecimento global, uma das razões pelas quais é precisamente o dióxido de carbono. , ,
2 , . «» , . -, . -, , ,
2 . , , .
, , , -. , , . , , , .
, , , . :)
Um pouco de publicidade :)
Obrigado por ficar conosco. Você gosta dos nossos artigos? Deseja ver materiais mais interessantes? Ajude-nos fazendo um pedido ou recomendando aos seus amigos o
VPS baseado em nuvem para desenvolvedores a partir de US $ 4,99 , um
analógico exclusivo de servidores básicos que foi inventado por nós para você: Toda a verdade sobre o VPS (KVM) E5-2697 v3 (6 núcleos) 10 GB DDR4 480 GB SSD 1 Gbps de US $ 19 ou como dividir o servidor? (as opções estão disponíveis com RAID1 e RAID10, até 24 núcleos e até 40GB DDR4).
Dell R730xd 2 vezes mais barato no data center Equinix Tier IV em Amsterdã? Somente temos
2 TVs Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 TV a partir de US $ 199 na Holanda! Dell R420 - 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB - a partir de US $ 99! Leia sobre
Como criar um prédio de infraestrutura. classe usando servidores Dell R730xd E5-2650 v4 custando 9.000 euros por um centavo?