
当超过某个温度时,电池将无法使用并死亡。 这种不耐高温的最简单的解释之一是,生命所必需的蛋白质是从食物或阳光中提取能量,防御入侵,破坏废物等的蛋白质。 -通常具有令人惊讶的准确形状。 从长线开始,然后将它们以螺旋,“发夹”和其他形状(由其组成顺序决定)的形式扭曲。 这些形式在其活动中发挥着巨大作用。 但是,当温度开始升高时,保持蛋白质结构的键断裂:首先是最弱的,然后是最强的。 顺理成章的是,蛋白质结构的扩散损失应该是致命的,但是直到最近,有关如何杀死过热细胞的确切细节仍不清楚。
现在,苏黎世瑞士高级技术学校的生物物理学家研究了温度升高时四种不同生物的细胞中每种蛋白质的行为。 这项研究以及
在《科学》杂志上收集的大量数据表明,在足以使细胞(人或大肠埃希氏大肠杆菌)死亡的温度下,只有少数关键蛋白质被破坏。 此外,细胞中蛋白质的丰度出乎意料地与其稳定性相关。 研究使科学家们迅速熟悉了蛋白质工作及其顺序建立的基本规则,并且其后果(如已清楚地表明的那样)远远超出了简单的热死。
负责这项工作的生物物理学家
Paola Piccotti解释说,这些实验是由古老
而未解决的问题驱动的:为什么有些细胞在高温下能生存,而另一些却死了? 嗜热栖热菌(Thermus thermophilus)细菌快乐地生活在温泉和家庭取暖器中[最适温度为65°C-大约70°C。 反式],而大肠杆菌细胞在高于40°C的温度下会崩溃。 有力的证据表明,这里的要点是这些生物体蛋白质的不同稳定性。 但是,跟踪活细胞中的蛋白质是一种理想的研究方法,非常不便。 在试管中分离蛋白质并不能给出所有答案,因为蛋白质在体内会粘在一起并影响彼此的化学反应,或者它们以必要的形式相互支撑。 为了确切地了解什么以及为什么它会分解,有必要在它们仍然相互影响的时候观察它们。
热量如何破坏蛋白质
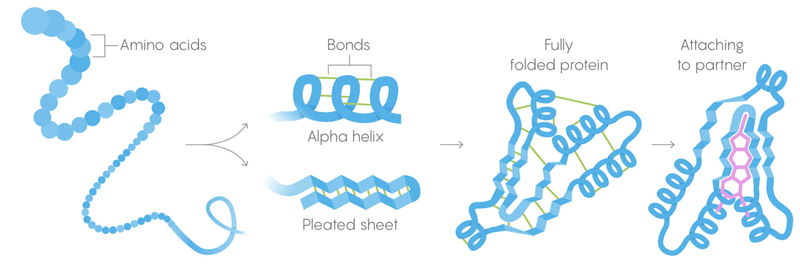 1)蛋白质的主要结构是氨基酸的长链,结合成基因给定的序列。
1)蛋白质的主要结构是氨基酸的长链,结合成基因给定的序列。
2)二级结构是氨基酸,其也折叠成由弱分子间键保持的构型。
3)三级结构-弱键稳定了蛋白质三维结构的笔直和扭曲部分的位置。 它们的位置使蛋白质可以结合所需的分子。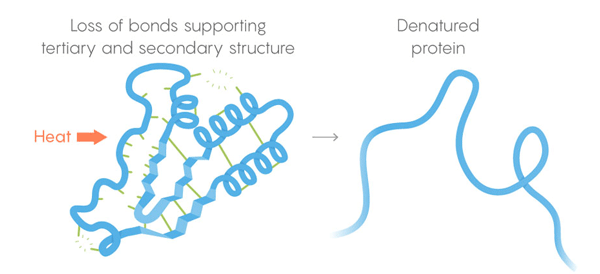 热死。 弱键失去了保留三级和二级结构的能力,蛋白质变性即展开。 但是并非所有蛋白质都在同一温度下展开-细胞中蛋白质的环境可以使其具有更多的稳定性。
热死。 弱键失去了保留三级和二级结构的能力,蛋白质变性即展开。 但是并非所有蛋白质都在同一温度下展开-细胞中蛋白质的环境可以使其具有更多的稳定性。为了解决该任务,团队开发了一个自动监视程序。 他们切开细胞并分阶段加热它们的内含物,在每个阶段释放分离蛋白质的酶。 这些酶特别擅长切割未折叠的蛋白质,因此研究人员根据被切割蛋白质的残留物,可以判断在给定温度下哪些蛋白质会分解。 因此,他们能够为所研究的数千种蛋白质构建变性曲线。 曲线的弧线从蛋白质在舒适的温度下未接触的结构变为高温下的完全发育状态。 为了寻找不同生物物种的曲线之间的差异,对人,大肠杆菌,嗜热链球菌和酵母的细胞进行了实验。 芝加哥大学的生物学家
艾伦·德拉蒙德 (
Alan Drummond)谈到该过程的规模和准确性时说:“这项研究非常漂亮。”
在观察过程中,可以清楚地看到,随着温度升高,所有生物的蛋白质不会一次全部解开。 Piccotti说:“我们发现在早期阶段只有一小部分蛋白质崩溃,而这些都是关键蛋白质。” 在具有蛋白质-蛋白质键交织关系的图中,该小子集中最易碎的蛋白质通常具有大量键,这意味着它们会影响细胞中发生的许多过程。 Piccotti说:“没有这些蛋白质,细胞将无法发挥作用。” “当它们消失时,整个网络将被破坏。” 显然,有了它,电池的寿命就停止了。
这种矛盾-最重要的蛋白质被证明是最脆弱的-可能反映出进化是如何创造它们来执行相应任务的。 如果蛋白质具有多种作用,则它的不稳定性及其展开和重新包裹的趋势将是一个优势,因为它可以使蛋白质采取适合于不同任务的不同形式。 Piccotti解释说:“这些关键蛋白中的许多具有很大的柔韧性,这使它们不稳定。”但与此同时,它们又具有与细胞中各种靶分子结合的能力。 “最有可能的是,这就是他们应对职能的方式。 这是一个折衷。”
在仔细研究了大肠杆菌(其收集的数据质量最高)后,研究人员发现蛋白质的丰度(细胞中的拷贝数)与其稳定性之间存在关联。 蛋白质构成细胞的拷贝越多,破坏它所需的温度就越高。 事实证明,大量拷贝与蛋白质对生存的重要性无关。 一些关键蛋白质非常罕见。 丰度和可靠性之间的这种联系证实了德拉蒙德十年前提出的想法-制造蛋白质的细胞系统倾向于不时犯错误。 错误通常会破坏蛋白质的稳定性。 如果发现这种蛋白质丰富,并且这种蛋白质每天在细胞中出现一百或数千次,则大量产生的错误折叠的拷贝会阻塞细胞。 因此,有益于人体的进化,以使最丰富的蛋白质也最稳定,这由Piccotti小组获得的数据证实。
为了了解某种蛋白质使蛋白质稳定的质量,研究人员比较了大肠杆菌和嗜热链球菌的数据。 大肠杆菌的蛋白质在40°C时开始分解,在70°C时几乎完全降解。 但是在这个温度下,嗜热链球菌蛋白质才刚刚开始感到不适-其中一些甚至在90°C时仍保持其形状。 研究小组发现嗜热链球菌通常具有较短的蛋白质,而在最稳定的蛋白质中,某些类型的蛋白质形式和成分更为常见。
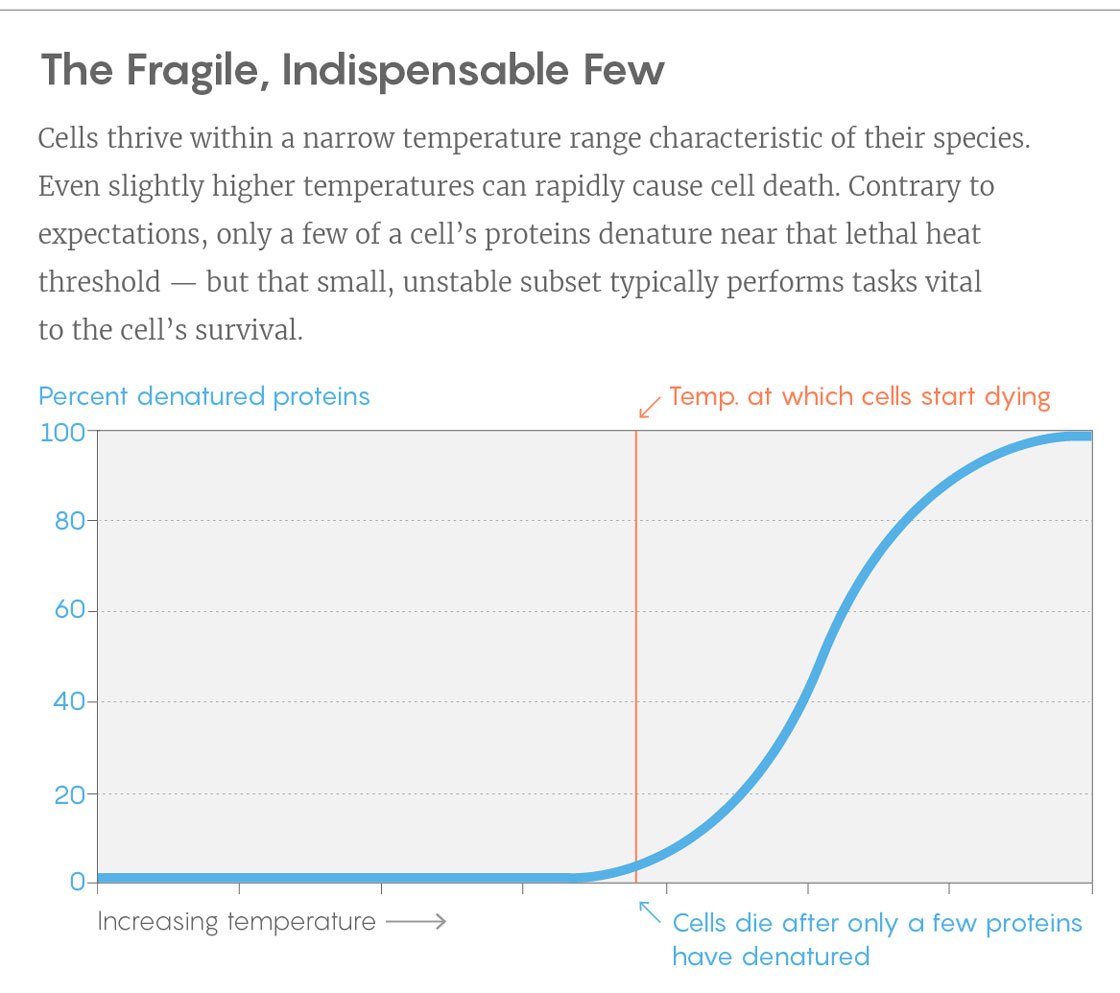 来自实验的曲线示例。 垂直-未折叠蛋白质的百分比,水平-温度。 垂直条是细胞开始死亡的温度。 要做到这一点,只需扭转一些关键蛋白质。
来自实验的曲线示例。 垂直-未折叠蛋白质的百分比,水平-温度。 垂直条是细胞开始死亡的温度。 要做到这一点,只需扭转一些关键蛋白质。发现可以帮助研究人员开发出满足其需求的稳定性蛋白质。 在许多使用细菌的工业过程中,升高温度会增加返回值-但很快细菌就会因热而死亡。 皮科蒂说,知道我们是否可以通过使关键蛋白对温度更具抵抗力来稳定细菌,将是一件很有趣的事情。
有关某些蛋白质如何轻松展开的大量信息使一些生物学家大为高兴。 其聚集的可能性直接取决于蛋白质的稳定性:未发育的蛋白质团块彼此粘附的外观。 蛋白质聚集体可能成为细胞的噩梦,并干扰主要任务的执行。 例如,他们被指控造成一些严重的神经系统问题,例如阿尔茨海默氏病,其中未折叠蛋白斑块阻塞了大脑。
 保拉·皮科蒂(Paola Piccotti)
保拉·皮科蒂(Paola Piccotti)但这并不意味着聚集仅发生在患有某些疾病的生物中。 相反,研究人员意识到,这种情况可能一直发生,而且健康的细胞拥有应对这种情况的方法。 “我认为这种现象正变得越来越普遍,”剑桥大学的生物化学家米歇尔·文杜斯科洛(Michele Vendruscolo)说。 大多数蛋白质不能正确折叠并在细胞内聚集。 Piccotti小组确定的最重要的事情是所选蛋白质处于扩展状态的时间长度。 这次决定了可能的蛋白质聚集程度。” 有些蛋白质几乎永不转身也不聚集,其他蛋白质则在某些条件下表现良好,而其他蛋白质则始终如此。 根据生物化学家的说法,新工作中对蛋白质的详细描述将极大地促进对蛋白质之间这些差异的研究和理解。 一些变性曲线表明它们的蛋白质在解折叠后聚集。 Vendruscolo说:“他们设法跟踪了部署和后续聚合的两个阶段。” “这就是这项研究的美。”
尽管许多科学家对聚集物造成了损害,但它们却引起了人们的兴趣,但有些人从另一角度来看待这种现象。 德拉蒙德说,越来越明显的是,一些骨料不仅仅是笼子里悬挂的垃圾。 它们包含继续执行其功能的活性蛋白。
德拉蒙德说,想像一下从远处看到烟雾从建筑物中冒出来。 在建筑物周围,您会看到一些数字,并且您可以想象这些是从废墟中提取的尸体。 但是,如果您离得更近一些,您可能会发现他们是从燃烧的建筑物中逃脱出来并等待事件结束的居住者。 Drummond说,聚集体的研究就是这种情况:研究人员发现聚集体中的蛋白质不是受害者,而是幸存者。 他说:“现在,科学的新领域正以爆炸性的速度增长。”
蛋白质结块可能不是破坏的迹象,而是蛋白质在困难情况下保持其功能的一种方式。 例如,它可以保护它们免受环境影响。 而且当条件改善时,蛋白质可以离开聚集体并再次折叠。 Drummond说:“它们的形状随温度的变化而变化,乍看之下似乎是不合适的。” “但这还有其他意义。” 在
2015年《细胞》杂志的
一篇文章中,他和他的同事们鉴定出177种酵母蛋白质,这些蛋白质在进入聚集体后仍能保持其功能。 在3月发表的
一篇论文中,该团队描述说,如果其中一种蛋白质发生改变,使其无法聚集,则将导致细胞功能严重问题。
通常,这项工作声称蛋白质是令人惊讶的动态结构。 起初,它们看起来像是固定任务的刚性机器,适合某种特定形式。 但是实际上,蛋白质在其正常功能期间可以采取几种不同的形式。 在适当的时候,它们的形状可能会发生很大的变化,以至于看起来它们正在恶化,尽管实际上它们却在增强。 在分子水平上,生命可以是键的永久连接和断开。