通过这次审查,我们开始撰写一系列文章,描述SENS衰老诊断小组的潜在生物标志物。
英国老年医学专家Aubrey di Gray提出了SENS(工程化可忽略的衰老策略,一种通过工程方法实现可忽略的衰老的策略)的概念。 该概念的思想是需要开发和应用技术来对抗衰老和与年龄有关的疾病,以便“修复”体内累积的损伤。 我们对潜在生物标记物的审查的目的是创建一个SENS老化诊断面板。
为什么需要SENS诊断?
- 为了使人能够从SENS的角度客观评估衰老期间身体的变化。
- 查看与老化相关的某些类型的损坏的个别风险。
- 评估开发的复兴方法的有效性。 了解身体活动,饮食,日常饮食,营养补品和药物如何根据减缓衰老的策略发挥作用。
- 与其他诊断老化面板进行比较,并补充其发展。
- 提供有关参数更改的数据以供研究。
- 根据最有趣和最敏感的风险来决定是否资助研究。
- 找到志趣相投的人,以解决因通过SENS理解自己的身体状态而引起的生物学问题。
SENS概念包括7个部分。 首先要考虑的是线粒体功能障碍(或MitoSENS)。
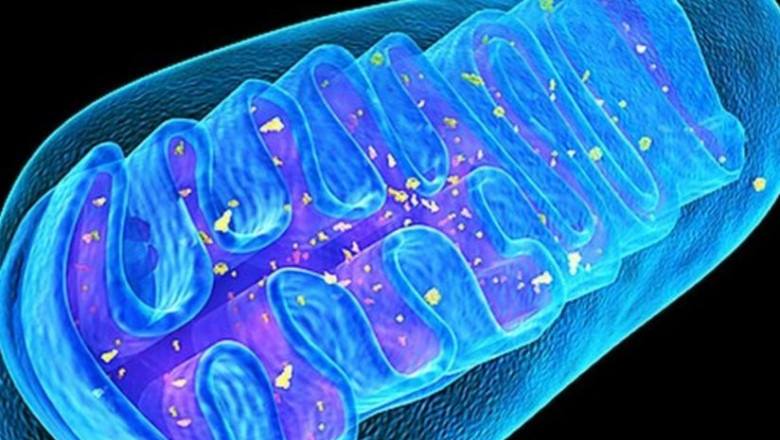
线粒体是真核生物的微小细胞器(居住在龙猫肠道中的羊羔除外),它为所有生化过程产生能量。 根据最流行的说法,线粒体曾经是独立的生命单位,紫色的光合细菌,但在进化过程中,它们被古代微生物古细菌吸收,并开始为它们产生能量。 每个细胞可以包含超过一千个线粒体,例如,心肌细胞具有多达5000个线粒体。 线粒体内膜中内置的分子马达ATP合成酶在质子通量的影响下旋转并合成主要能源三磷酸腺苷ATP。 据估计,成年人体内每天合成并消耗约40千克ATP。
与其他细胞器不同,线粒体拥有自己的2-10个DNA线粒体mtDNA。 线粒体在产生能量的过程中会产生有毒的“废物”-活性氧(ROS),会破坏其他分子和各种细胞结构,尤其是线粒体本身,从而导致线粒体DNA发生突变,并对整体产生不利影响身体的能量平衡。 因此,具有缺失(位点缺失)的mtDNA能够迅速繁殖并自身充满细胞空间,从而导致肌肉减少症和神经变性。 “腐败的”线粒体开始产生更多的ROS,导致氧化应激增加,继而引起各种病理学发展,过早衰老和细胞死亡。
一个有趣的事实与氧化应激有关。 发现膜中脂肪酸的饱和度与动物的寿命之间存在明显的关联:膜中不饱和酸的含量越多,动物的寿命越短。 西班牙生物学家追踪了这样一个序列,显示出寿命的增加,同时减少了膜中二十二碳六烯酸ω-3脂肪酸的含量:小鼠→大鼠→兔子→人→鲸鱼[1]。
这种模式很容易解释,因为不饱和脂肪酸是脂质过氧化作用的主要“受害者”。 因此,以更长的寿命为特征的动物细胞膜脂质成分表现出黄金中值:少量的完全不饱和二十二碳六烯酸22:6ω-3脂肪酸和较少的不饱和亚麻酸18:03ω-3脂肪酸占主导地位。产生相同的平衡,既可提供针对ROS的保护,又可保持所需的膜流动性。
除了动物细胞膜的脂质组成外,所有mtDNA核苷酸残基中热力学更稳定的鸟嘌呤和胞嘧啶的比例也与哺乳动物的最大寿命有关[2]。
SENS概念的创造者通过将线粒体基因的“备份副本”转移到细胞核中来解决线粒体功能障碍的问题,在那里它们不会被线粒体中产生的ROS破坏。 因此,即使mtDNA中的原始基因受到破坏,核DNA中的后备物也将能够提供维持正常能量产生所必需的蛋白质。 这种方法称为蛋白质的异位表达。 人的mtDNA共有37个基因,其中只有13个编码线粒体必需的蛋白质,其余(超过1000个)协调线粒体功能的蛋白质在核DNA中编码。 根据SENS的作者的说法,正是出于这一目的,通过进化将主要的线粒体基因转移到细胞核中-保护它们免受ROS的破坏作用。
SENS作者关于线粒体DNA进化转移到核中以保护mtDNA免受有害因素影响从而延长寿命的想法在致力于NUMT(核线粒体DNA片段)分析的研究中得到了证实。 术语NUMT是指转移到核DNA中的mtDNA片段。 对线粒体和核基因组已完全测序的17种动物的比较分析显示,预期寿命与NUMT序列数之间存在显着的正相关性[3]。 现在,仍然需要找到一种工程解决方案来转移其余13个mtDNA基因的备份。
但是,还有其他方法可以改善线粒体功能。 其中之一是从外部移植线粒体。 描述了在动物实验中成功的“线粒体”亚群。 因此,线粒体转移被用于急性肺损伤,心血管疾病和帕金森氏病的动物模型中。 线粒体植入可以通过多种方式完成:首先,将孤立的线粒体直接注射到受损区域的细胞中,然后直接注射孤立的线粒体(局部注射)。 其次,全身性给药是将线粒体引入全身血流,然后将其分布到全身。 获得的结果表明线粒体移植在治疗多种疾病中的前景[4]。
随之而来的是,寻找潜在的生物标记物来确定由线粒体功能障碍引起的氧化应激反应将是合乎逻辑的。
氧化应激是氧化剂(活性氧物质)与体内抗氧化剂防御氧化剂之间的不平衡。 在细胞中,氧化剂与生物分子(磷脂,蛋白质和核酸)积极相互作用。 结果,这些生物分子被不可逆转地破坏,从而导致细胞功能障碍,并因此导致机体的各种病变和细胞死亡。 D. Harman在1950年代提出的最流行的衰老理论之一是自由基,它把它视为衰老的主要机理。
氧化过程中形成的分子可以用作生物标记。 他们的分析用于量化人类的氧化应激。 高浓度的氧化应激生物标志物不仅在与年龄有关的或退化性疾病(例如阿尔茨海默氏病,高血压,2型糖尿病或几种癌症)中被确定,而且在慢性阻塞性肺疾病,吸烟和生活在生态不利地区中也被确定。
氧化应激最重要的生物标记之一是8-异前列腺素F2α(8-异前列腺素)。 在细胞生物膜即花生四烯酸的磷脂的非酶促氧化过程中形成了8-异前列腺素。 这种类似于前列腺素的物质导致血管和支气管变窄,减少肾脏中的血流,影响血小板聚集,因此涉及多种疾病的病理学。 健康人中8-异前列腺素的正常值被认为是11±4 pg / ml [5]。
丙二醛(MDA)也被公认为是脂质氧化生物标志物,它是由自由基引起的脂质过氧化作用和多不饱和脂肪酸分子的分解形成的。 血清中MDA浓度的增加不仅标志着氧化应激,而且还标志着内源性中毒程度。 因此,在吸烟者以及滥用酒精的人群中,血浆中MDA的浓度有所增加。 MDA与蛋白质的氨基形成Schiff碱基,导致形成不溶性脂质-蛋白质复合物(磨损颜料或脂褐素)。 MDA是在许多生物体液的样品中测定的:血清,血浆,尿液,呼出气冷凝物。 健康人(正常人)血清中的MDA浓度小于1μmol/ L [6]。
在组成蛋白质的氨基酸氧化过程中,形成了许多潜在的氧化应激生物标志物:邻酪氨酸,3-氯酪氨酸和3-硝基酪氨酸。
在体内生理上,内源性酪氨酸是由苯丙氨酸羟化酶酶促氧化苯丙氨酸形成的。 在氧化过程中,氧苯丙氨酸的活性形式形成了邻酪氨酸(o-Tyr)和间酪氨酸(m-Tyr)。 邻酪氨酸和间酪氨酸不是天然氨基酸,被认为是氧化应激的生物标记。 在白内障患者中发现高浓度的o-Tyr和m-Tyr,在2型糖尿病患者的血浆和尿液中发现o-Tyr升高。 3-氯酪氨酸(3-ClTyr)是在次氯酸(HClO,过氧化氢的衍生物)和对酪氨酸反应过程中以自由基过程形成的。
3-ClTyr的形成在心血管系统中起重要作用,因为它与动脉粥样硬化的发展有关。 3-ClTyr促进人主动脉平滑肌细胞的迁移(形成血管病变的主要机制),并且在炎症条件下3-ClTyr的升高水平可导致血管疾病。 3-硝基酪氨酸(3-Notyr)是在氧化应激期间通过将酪氨酸与侵吞性吞噬蛋白髓过氧化物酶(MPO)硝化而形成的。 这种硝化会对蛋白质的功能产生负面影响。 在患有阿尔茨海默氏病的患者的脑脊液中发现较高浓度的3-Notyr(患者为11.4±5.4 nM,健康志愿者为1.6±0.4 nM),以及患有关节炎,动脉粥样硬化和高血压[5]。
同样,在ROS和HClO对蛋白质的作用下,形成了多种蛋白质氧化(AOPP)产物。 此类蛋白质无法发挥其功能,可能会造成重大伤害。 AOPP由髓过氧化物酶-过氧化氢系统产生。 在患有急性冠状动脉综合征或活动性溃疡性结肠炎的患者的血浆或尿液中发现了更高浓度的AOPP。 血浆水平60-70 nM被认为是健康人AORP的正常指标[5]。
众所周知的用于核酸氧化的生物标记是8-羟基鸟苷(8-OHG)和8-羟基-2'-脱氧鸟苷(8-OHdG)。 8-OHdG是DNA氧化的主要产物。 8-OHG是通过RNA氧化形成的。 在患有阿尔茨海默氏病,关节炎,动脉粥样硬化,白内障,高血压,骨质疏松和2型糖尿病的患者中发现了更高浓度的8-OHdG。 8-OHdG也被认为是与吸烟有关的癌症(例如肺癌)的潜在生物标志物。 在患有阿尔茨海默氏病的患者中可以发现8-OHG,并且已经证明,氧化性RNA损伤高于DNA损伤。 健康人的血液中8-OHdG的浓度为1.09±0.52 nM,而脑脊液中8-OHG的浓度为97±32 pM [5]。
决定线粒体功能障碍和氧化应激的另一个生物标记是细胞mtDNA的拷贝数(当细胞衰变并且其水平随着年龄增长时,也有进入细胞外的细胞外mtDNA)。 因此,众所周知,随着年龄的增长,男性的线粒体DNA数量减少,女性的减少更多。 较低的mtDNA计数也与衰老性衰弱(衰老,虚弱)的发生密切相关。 mtDNA的拷贝数也可以成为各种原因导致的死亡的有效预后指标,这些原因包括心血管,肿瘤和呼吸系统疾病[7]。
内源性抗氧化剂,例如谷胱甘肽,半胱氨酸,尿酸和泛醇,也具有利用线粒体功能障碍和氧化应激作为生物标记物的潜力。 与活性氧相互作用时,内源性抗氧化剂会被氧化,然后使用特殊的酶重新还原。 因此,在人体中,抗氧化剂分子以两种形式存在:还原形式(抗氧化剂)或被氧化(与氧化剂反应后)。 使用色谱法,可以确定还原和氧化形式的抗氧化剂的比例,从而确定氧化应激的程度[8]。
线粒体功能障碍和氧化应激的生物标志物:
1.8-异前列腺素。
2.丙二醛
3.O-酪氨酸,3-氯酪氨酸,3-硝基酪氨酸。
4.蛋白质氧化产物(AOPP)。
5.8-羟基鸟苷(8-OHG)
6. 8-羟基-2'-脱氧鸟苷(8-OHdG)。
7.细胞线粒体DNA(数量和缺失突变体的存在)
8.内源性抗氧化剂(谷胱甘肽,半胱氨酸,尿酸,泛醇)。
该评论的作者:Denis Odinokov,Alexey Rzheshevsky。
二手文献清单:1. Pamplona,R.,Portero Otnn,M.,Ruiz,C.,Gredilla,R.,Herrero,A.和Barja,G.(2000)磷脂和脂质过氧化的双键含量与最大寿命成负相关。哺乳动物的心脏,机甲。 老化发展。,112,169–183。
2. Lehmann G1,Segal E,Muradian KK,Fraifeld VE。 线粒体DNA和代谢率在确定哺乳动物最大寿命方面是否互补? 复兴水库。 2008年4月; 11(2):409-17。
3. Muradian KK1,Lehmann G,弗赖费尔德VE。 长寿的NUMT(“新的强大”)假设。 复兴水库。 2010 Apr-Jun; 13(2-3):152-5。
4. Gollihue,Jenna L.,Samir P. Patel和Alexander G. Rabchevsky。 线粒体移植策略可作为中枢神经系统创伤的潜在疗法。 神经再生研究13.2(2018):194。
5. KamilaSyslová,AdélaBöhmová,MilošMikoška,Marek Kuzma,DanielaPelclová和PetrKačer。 老化中氧化应激的多标记筛选。 氧化Med Cell Longev。 2014; 562860。 在线发布于2014年7月16日。
6. Yashin A.,YashinY。氧化应激标记物的高效液相色谱。 2011。分析。 1、34-43号。
7.Foram N.等。 线粒体DNA水平与衰弱和全因死亡率的关系。 J摩尔·梅德(Berl)。 2015年2月; 93(2):177–186。
8. Goon A.A. Subbotina T.F.,Alekseevskaya E.S.,Moiseeva O.M.,Gavrilyuk N.D.,Irtyuga O.B. 心血管疾病患者线粒体功能障碍的代谢和蛋白质标志物临床实验室诊断。 2015; 60(7):35–41。