蛋白质在所有生物中起着至关重要的作用,它们执行许多不同的功能。 如您所知,它们由氨基酸组成。 为了实现其功能,蛋白质不仅必须是某些氨基酸的链,还必须具有一定的空间形状,即适当地适合于空间。 由于各种原因,在蛋白质正常折叠成所需结构时可能会发生故障。 然后,蛋白质聚集体不是淀粉蛋白原纤维,而是倾向于聚集在一起的不适当折叠的蛋白质。 这些聚集体中最著名的是β-淀粉样蛋白(Aβ,Abeta),可能与神经病理学以及某些类型的癌症以及唐氏综合症患者痴呆的原因之一有关。
这种蛋白质结构的直径约为5-10 nm,长度可达800 nm,由两条或更多条平行的多向长丝组成,形成特定的结构-交叉β折叠构象。 正是这种结构决定了淀粉样蛋白的特定光学性质-双折射能力。 而这一特性的发现是淀粉样变性病诊断的基础。 在偏光淀粉样蛋白中用刚果红染料制剂染色的显微镜将红色变成绿色[1]。
SENS概念的作者称异常蛋白质的蓄积物为“细胞外碎片”(细胞外垃圾),并确定了老化的原因之一,这似乎很合理。 淀粉样蛋白原纤维由于其结构而不受分解蛋白质(蛋白酶)的特殊酶的作用,因此具有在人体组织中积累,破坏其工作的特性。 淀粉样蛋白的结构和化学物理性质取决于主要的前体蛋白,该蛋白在原纤维中的含量约为80%,这决定了每种淀粉样变性病的特定性状。 术语淀粉样变性是指与不溶性蛋白质的原纤维的细胞外沉积有关的一组遗传性或获得性疾病,其引起组织结构障碍和器官功能障碍。 目前,已知有超过20种淀粉样蛋白前体蛋白和相同数量的淀粉样变性临床变体。 除了众所周知的β-淀粉样蛋白外,还有与类风湿性关节炎,心脏病,肾脏疾病和肠道炎症相关的AA淀粉样蛋白,参与2型糖尿病发病机理的AIAPP淀粉样蛋白等[2]。
 β-淀粉样蛋白。
β-淀粉样蛋白。SENS的作者看到了一种使用专门的催化活性抗体(所谓的抗体酶(英语:abzyme,抗体酶))解决蛋白质聚集体积累问题的方法,该抗体专门针对淀粉样蛋白选择并从组织中去除。 最近,已经开发了一种有希望的方法作为该方法的一部分。 已发现人类抗体的子集对特定抗原具有催化活性,可将其分解为较小和危害较小的片段,而不是捕获其以被其他免疫细胞清除或破坏。 与隔离其他抗体中使用的抗体相比,使用这些新的催化抗体作为淀粉样蛋白靶向疗法具有潜在的优势。 首先是需要降低剂量才能有效地从组织中去除细胞外聚集物。 这是因为螯合抗体一次只能捕获然后转运一个淀粉样蛋白分子。 当抗体酶与淀粉样蛋白分子结合时,先将其研磨,然后再移至下一个,从而使每个抗体分子迅速破坏几个淀粉样蛋白分子。 另一个是催化抗体属于通过保护大脑的血脑屏障更有效地转运的一类,而螯合抗体则更难以克服该屏障[3]。
当今最著名,研究最深入的淀粉样蛋白是β-淀粉样蛋白,许多研究人员将其归因于阿尔茨海默氏病。 这种病理学在一个多世纪以前由A. Alzheimer进行了描述,他是第一个指出这种疾病的主要病理形态学症状的人-在患有这种疾病的死者的大脑中发现了不溶性老年斑。 今天,世界上有超过4000万人被诊断出患有阿尔茨海默氏病-65岁以后,每五年出现这种病的可能性就会增加一倍。 世卫组织对未来几十年此类患者大量增加的长期估计极为悲观。
已知患者脑中的不溶性斑块主要由β-淀粉样肽(Aβ)形成,其分子量为4kDa,长度为约40个氨基酸残基。 Aβ是淀粉样蛋白前体蛋白(淀粉样蛋白前体蛋白,APP)的跨膜蛋白片段,在人体的许多组织中都有发现,包括神经元突触。 APP参与与神经可塑性,突触的形成和神经保护(神经细胞的存活)有关的一些生理过程[4]。
不同于其前身,Aβ对神经细胞有毒,导致其变性和死亡。 它是通过分离前体蛋白的细胞外N端结构域(sAPP)形成的。 此过程可以通过两种不同的分泌酶-α-分泌酶和β-分泌酶来进行,这两种酶的作用存在根本差异。 在第一种情况下,片段化发生在Aβ序列内的氨基酸残基之间,这阻止了后续淀粉样肽的形成。 其次,病理学上,在β-分泌酶的影响下,由于其特征而导致的断裂过程终止于Aβ的形成。 与神经病理学发展相关的第二种途径更为罕见,为什么前体蛋白的碎片跟随其后的原因尚不完全清楚[5]。
 β-分泌酶。
β-分泌酶。Aβ的神经毒性与违反钙稳态,兴奋性毒性,炎症过程,刺激氧化应激和细胞凋亡有关。 普遍的看法是,由于不可能从脑组织中去除Aβ,因此Aβ在脑中的蓄积是纯粹的病理过程。 今天,众所周知,仍然可以通过至少两种方式从大脑中消除Aβ:血管周围(通过淋巴)和蛋白水解(通过各种酶的裂解)[6,7]。 因此,老年性阿尔茨海默氏病的形成以及不溶性淀粉样蛋白原纤维的积累可能与各种刺激因素有关。 这可能是遗传性的,可能与压力,缺氧,局部缺血和中风有关[8]。
β-淀粉样蛋白氧化胆固醇和多不饱和脂肪酸,形成最具毒性的活性氧形式-羟基自由基和过氧化氢。 L-天冬氨酸在长寿蛋白中的外消旋作用促进了β-淀粉样蛋白和α-突触核蛋白的形成。 在帕金森氏病,阿尔茨海默氏病,利维病和其他神经退行性疾病中观察到后者的病理积累。
阿尔茨海默氏病神经变性的另一个病理形态学标志是高磷酸化tau蛋白(τ蛋白)的聚集体:成对的螺旋丝(PHF)和神经原纤维缠结(NFT)。 在生理上,τ蛋白参与神经元微管的稳定化,从而确保细胞器,糖蛋白和其他物质通过神经元细胞质转移。 在阿尔茨海默氏病中,τ蛋白被过度磷酸化,失去了稳定微管的正常能力,并在细胞中积累了不可溶的神经毒性结构。 尚不清楚在病理形成过程中较早发生的情况(即淀粉样蛋白或τ蛋白聚集体的形成)。 但是,显然,这两个过程是相互联系的,并且相互促进。 因此,两种病理蛋白都表现出与PrPsc pr病毒蛋白相似的ion病毒特性:通过链式反应类型正确折叠的蛋白质形式会刺激正常蛋白质在周围健康神经元中转化为不规则蛋白质。 在它们之间,Aβ和τ蛋白也通过of病毒的类型相互作用:描述了Aβ如何激活GSK3蛋白激酶,磷酸化τ蛋白并导致其形成不正确[5]。
 τ蛋白。
τ蛋白。最近,据信尽管病毒病和阿尔茨海默氏病具有某些生化相似性,但是第二种病理学与第一种病理学不同,它不具有传染性,并且不会从一种生物体传播到另一种生物体。 但是在2015年,第一个令人不安的消息出现了。 英国神经学家在《自然》杂志上发表了一篇文章,讨论了Aβ从一个人传播到另一个人的可能途径。 作者对8名死于Creutzfeldt-Jakob病的人的大脑进行了尸检研究。 在六个死者中,除了与潜在疾病相关的伤害外,还在大脑中发现了大量淀粉样蛋白积聚。 无论是对于年轻的死者,还是对于这种病理,都不具有什么特征。 在其基因组中也未发现与淀粉样蛋白生成和神经病理学相关的缺陷。 研究人员建议,在注射受淀粉样蛋白感染的生长激素的过程中,将Aβ引入死者体内。 就像以前有数百人被注射含生长激素的injection病毒感染并死亡一样[9]。
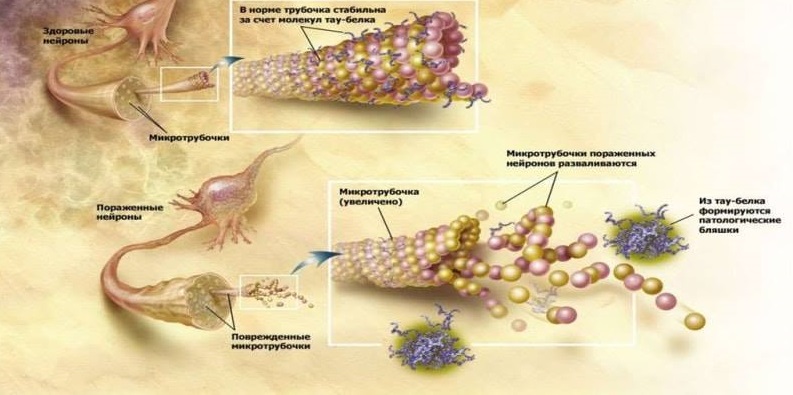 τ蛋白的功能是正常的和病理性的。
τ蛋白的功能是正常的和病理性的。阿尔茨海默氏病传染性的确证可以是另一项研究,其中将淀粉样蛋白生成增加的实验小鼠和正常小鼠通过手术与血流结合。 结果,健康的老鼠开始在大脑中积聚Aβ,这对于这些啮齿动物而言并不常见。 这项研究首次显示了血液中Aβ可能渗入大脑并随后参与神经变性的发展[10]。
与年龄相关的神经病变的组织中β-淀粉样蛋白和τ蛋白的积累之间的关系决定了需要寻找有效的方法来鉴定这些蛋白聚集体作为未来神经病理学和加速衰老的生物标志物的需要。 今天,已经知道几种这样的方法。
当β-淀粉样蛋白由引入人体并与淀粉样蛋白连接的放射性同位素确定时,可以使用正电子发射断层扫描技术检测脑组织中的淀粉样蛋白沉积。
如今,脑脊髓液(脑脊髓液)中淀粉样蛋白Aβ-42,总τ蛋白和磷酸化τ蛋白的水平被认为是阿尔茨海默氏病和中度充血性疾病(UKI)早期诊断中最敏感的生物标志物之一。 而且,具有病理学的淀粉样蛋白显示其水平降低,并且总蛋白和磷酸化的τ蛋白在脑脊髓液中的水平增加。 这是由于以下事实:在健康的人中,没有斑块形式的淀粉样蛋白积聚,因此,在脑脊液中发现了大量的游离淀粉样蛋白。 τ蛋白的值低表明神经元细胞骨架没有破坏。
发现年龄与神经系统中β-淀粉样蛋白的排泄减慢之间存在显着相关性,这可能与淋巴管的硬化和引流能力降低有关。 由Leucadia提出,恢复排水是治疗阿尔茨海默氏病的有前途的方法之一,Leucadia提出了对他的采访,并在
habr.com/post/371513上进行了翻译和发布。
因此,脑脊液中Aβ-42的浓度为716.9±94.2 ng / ml可以视为健康人的正常指标。 而显示出神经病理学风险增加的Aβ-42水平<209 ng / ml。 对于τ蛋白,脑脊液中73.9±51.7 ng / ml的水平被认为是正常值。 τ蛋白水平增加至231.6±158.5 ng / ml可能已经表明存在活跃的神经退行性过程。 根据今天的想法,对脑脊液中Aβ-42和τ蛋白水平的联合研究显示出对神经病理学的早期诊断具有很高的敏感性-94%的诊断阿尔茨海默氏病的可能性[11]。
很快,有望出现血浆中淀粉样变性(Aβ42/ 40或APP669-711 /Aβ42蛋白的比率)和神经变性(τ蛋白和神经丝)诊断的超灵敏免疫学和质谱方法[12]。 还有一些“无痕”方法可以检测血浆中折叠不正确的蛋白质[13]。
该评论的作者:Denis Odinokov,Alexey Rzheshevsky。
二手文献清单- Rameev V.,Kozlovskaya L.淀粉样变性:现代诊断和治疗方法。 有效的药物治疗。 泌尿科和肾脏科。 2012.第11号,第6-15页。
- Butler L.I.,Karpova O.Yu.,Alexandraova E.N.,Petrova S.Yu. 老年人心脏淀粉样变性。 内科医学档案。 2015.第6(26),p。 28-36。
- AmyloSENS:从细胞之间清除垃圾。
- 4Lee,V.,Goedert,M.,Trojanowski,J。(2001)Neurodegenerative tauopathies,Annu。 版本号 神经科学杂志,24,1121–1159。
- 塔塔尔尼科娃(Tatarnikova O.G.),奥尔洛夫(Orlov M.A.),巴布科娃(Babkova N.V.) β淀粉样蛋白和Tau蛋白:结构,相互作用和病毒样特性。 《生物化学进展》,第55卷,2015年,第2页。 351-390。
- Weller,R.,Yow,H.,Preston,S.,Mazanti,I.,Nicoll,J.(2002)脑血管疾病是从衰老的人脑中消除淀粉样β失败的主要因素,Ann。 纽约学院 科学,977,162-168。
- Nalivaeva,N.,Fisk,L.,Belyaev。 N.,Turner,A.(2008)淀粉样蛋白降解酶作为阿尔茨海默氏病的治疗靶标,Curr。 阿尔茨海默病研究,5,212–224。
- Fisk,L.,Nalivaeva,N.,Boyle,J.,Peers C.,Turner A.(2007)缺氧和氧化应激对人神经母细胞瘤细胞以及大鼠皮质神经元和星形胶质细胞中neprilysin表达的影响,Neurochem。 Res.32,1741-1748。
- Jaunmuktane Z.,Mead S.,Ellis M.,Wadsworth JDF,Nicoll AJ,Kenny J.等人(2015)。 人类传播淀粉样β病理和脑淀粉样血管病的证据。 自然525,247-250。
- 卜XL,向香,金WS,王洁,沉LLL,黄祖L,张K,刘玉华,曾F,刘建辉,孙HL,庄振强,陈申,姚晓琼,B Giunta,单永昌,谭俊杰,陈XW,董ZF,周HD,周XF,宋W和王玉杰。 血液来源的β淀粉样蛋白可诱发阿尔茨海默氏病。 分子精神病学。 2017。
- 于 洛布辛(A.Y.) 洛杉矶埃梅林 Alekseeva。 神经变性的液生物标志物在认知障碍的早期诊断中。 俄罗斯军事医学科学院院刊。 2013年第4号第 15-20。
- Blennow,Kaj和Henrik Zetterberg。 “阿尔茨海默氏病的生物标志物-现状和未来展望。” 内科杂志(2018)。
- Nabers,Andreas等。 “淀粉样蛋白血液生物标志物可以检测到阿尔茨海默氏病。” EMBO分子医学(2018)。