没有可靠的衰老诊断,就不可能开发衰老疗法。 为了理解一个人的死亡或致命疾病的发作似乎是不合理的:通过这种疗法,我们是否减缓了衰老过程。 我们必须立即看到由我们的抗衰老干预措施引起的客观情况。
在临床实践中,还没有“大的衰老诊断”。 即,患者和主治医师不可能在疾病发作之前的分子水平上检测与年龄有关的变化。 我们首先要弥合与年龄有关的变化的所有主要标志,以及衡量这些变化的可用技术水平,以弥合这一差距。
基于当今的SENS计划(通过工程方法实现可忽略的衰老)最能充分描述延长人类寿命的方法,我们将继续介绍SENS-衰老诊断概念。
许多人听说过蛋白质糖基化,糖基化终产物(CNG,AGE)及其对人体的危害。 但是,应该指出的是,向其他分子中添加糖并非总是一种病态。 糖基化本身是活生物体中非常普遍且重要的生理过程。 因此,在细胞中合成的所有蛋白质中有很大一部分会经历酶促糖基化,这对于它们的正常功能是必需的。
基本上,两个聚糖(韧带的碳水化合物部分是有机分子)参与糖基化:N-聚糖(连接至天冬酰胺的酰胺基)和O-聚糖(连接至丝氨酸或苏氨酸的羟基)。 由于老化,我们对N-聚糖更加感兴趣。 据描述,随着年龄的增长,糖链的光谱会发生变化,并在N-糖基化过程中附着在免疫蛋白上。 而且,这种变化在与年龄相关的体内一般炎症增加中起关键作用。 因此,糖基化IgG抗体的水平可以比端粒的长度更准确地预测人的生物学年龄[1]。
此外,另外两种聚糖NGA2F和N2AF被证明是有前途的衰老生物标志物。 作为MARK – AGE欧洲针对衰老生物标志物的研究计划的一部分,该计划于2013年结束,GlycoAgeTest测试用于确定人的生物学年龄。 它基于聚糖数量NGA2F(随年龄增长)和N2AF(其水平随年龄下降)的比率。 MARK – AGE研究中描述的另一种潜在的衰老和与年龄有关的疾病(心血管和糖尿病)的生物标志物是糖蛋白簇蛋白,它参与蛋白质结构的稳定化[2]。
现在我们来考虑这种现象的病理部分。 除了人体调节的糖基化酶外,该过程还有一种非酶形式,即所谓的 美拉德反应,其结果是多种糖基化产物在体内出现。 应该注意的是,非酶糖基化的过程实际上是不受调节的。 尽管存在通过透滑作用“抑制”糖基化的可能性,其中谷胱甘肽,多胺,硫醇,游离氨基酸(例如牛磺酸,赖氨酸)被消耗。 并且还通过乙二醛酶系统灭活甲基乙二醛:乙二醛酶I将甲基乙二醛和还原型谷胱甘肽转化为乳酰谷胱甘肽,然后被乙二醛酶II代谢为D-乳酸。
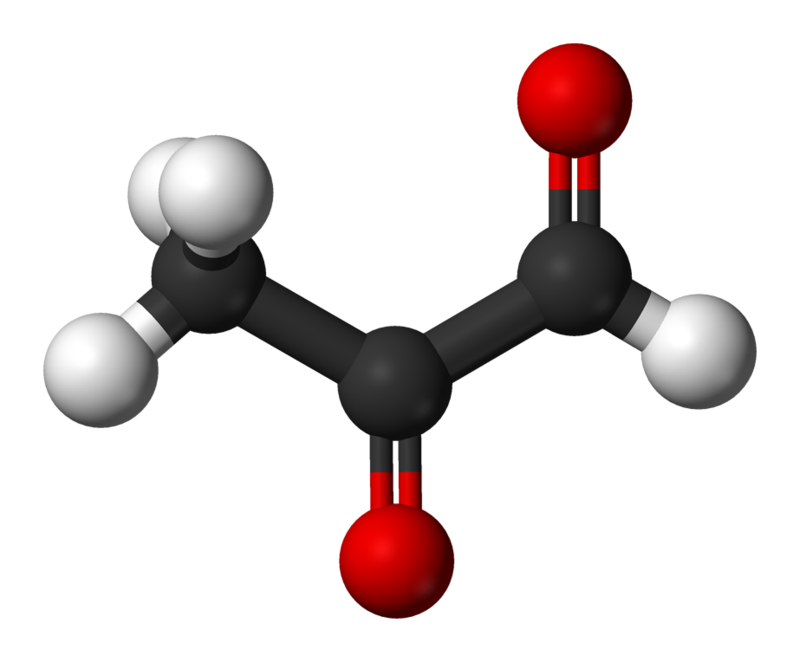 甲基乙二醛结构
甲基乙二醛结构在糖基化产物中,早期的(Amadori产物)和晚期的(或最终的)糖化产物是不同的。 非酶糖基化发生在几个阶段。 这个过程开始于葡萄糖和其他单糖与氨基结合并引发一系列进一步反应的事实。 在糖的醛基和氨基之间的反应开始时,会形成一个不稳定的醛亚胺基(席夫碱),它可以转变为许多其他更稳定的化合物,早期糖基化产物,即所谓的糖基化产物。 Amadori产品。 蛋白质中添加葡萄糖的最早产物之一是Ne –果糖基–赖氨酸,反过来,降解形成各种糖基化终产物(CNG)。 氢咪唑啉酮是经乙二醛,甲基乙二醛和3-脱氧葡萄糖苷(3-DG)修饰的精氨酸残基衍生物,以CNG的形式大量生产。 其他经过充分研究的CNG为Nδ–羧甲基–赖氨酸(CML)和Nδ–羧乙基–赖氨酸(CEL),以及葡萄糖窗格和戊糖苷,它们是蛋白质交联的特征[3]。 最容易定义的CNG类型之一是戊糖苷,戊糖苷从20岁开始累积在人大肌肉的腱(即胶原周转速度减慢的肌腱)中,其浓度线性增加至老年。
直到最近,人们仍认为葡萄糖是形成CNG的主要物质。 但是,确切地确定CNG胞内和胞外形成速率不同的事实表明事实并非如此。 诸如果糖,6-磷酸葡萄糖和3-磷酸甘油醛的糖具有较高的细胞内CNG形成率。 已经描述了甘油醛对主要收缩和细胞骨架蛋白肌动蛋白分子的负面影响,这导致戊糖苷和bithyrosine交联的形成以及肌动蛋白功能的丧失[4]。
 胶原蛋白分子与葡萄糖泛的交联。
胶原蛋白分子与葡萄糖泛的交联。现在人们认为非酶糖基化和CNG与一系列年龄依赖性疾病密切相关,例如糖尿病,类风湿性关节炎,动脉粥样硬化,帕金森氏和阿尔茨海默氏病,肌萎缩性侧索硬化症,白内障和癌症[5]。 在美拉德反应中经受糖基化作用的蛋白质在生物学上发生了交联,同时失去了其特性。 对于长寿命的蛋白质而言,这是一个特别大的问题(例如,根据许多研究,皮肤胶原蛋白分子的半衰期为15年,而软骨的寿命超过100年),它构成了人体所有蛋白质的重要组成部分-约三分之一。 分子之间产生的额外交联破坏了这些蛋白质的功能,导致组织弹性的丧失,并且经常在衰老和病理过程中观察到。 糖基化还会使已经缓慢更新的胶原蛋白变得更长寿-糖基化后,它获得了对内源性胶原酶的生理作用的抵抗力,从而提供了组织更新。
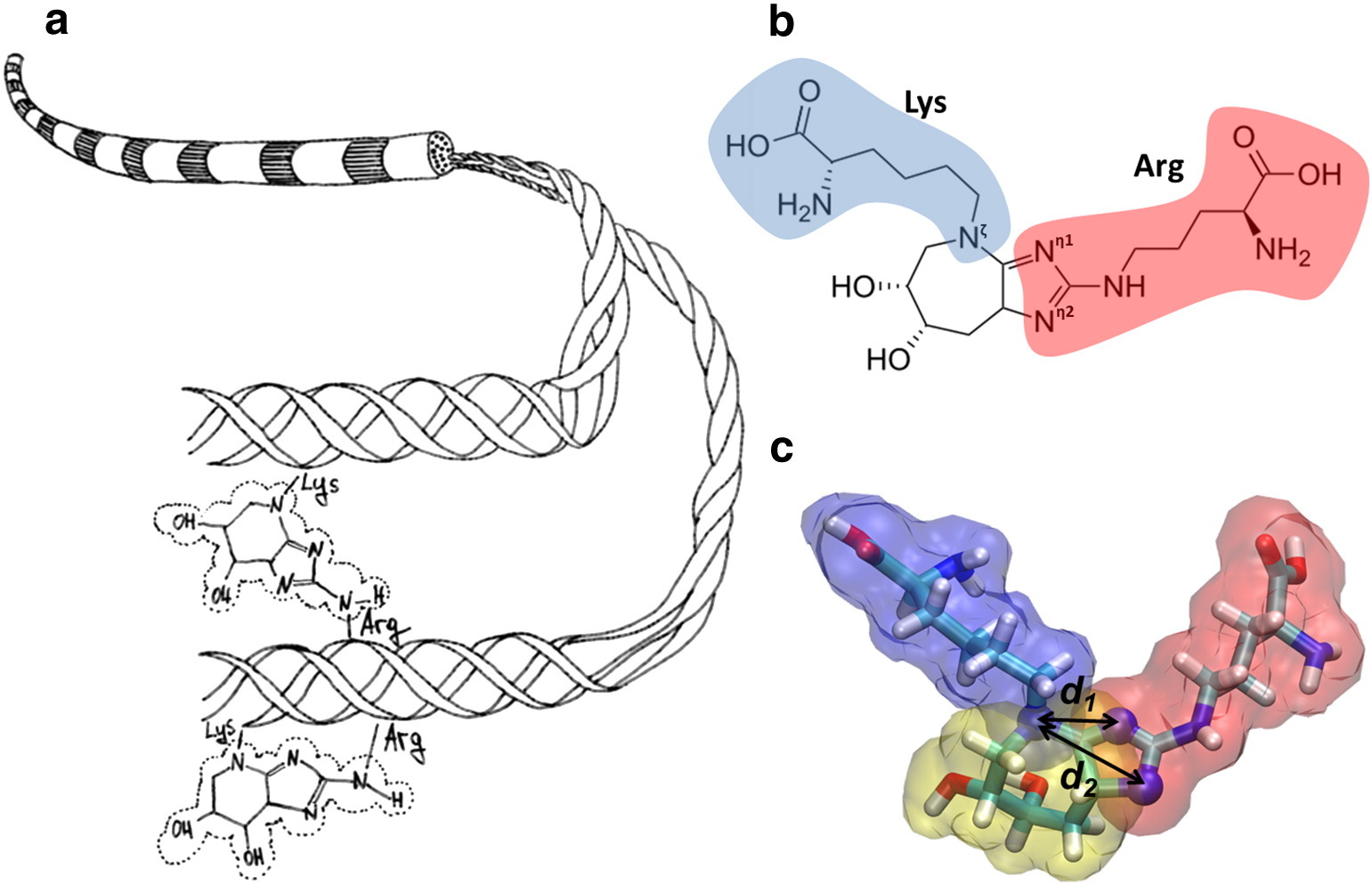 图(a)显示了胶原原纤维和葡萄糖泛的形成的图,其共价结合赖氨酸和精氨酸的侧链。 (b)显示了葡糖胺的化学结构,该结构使赖氨酸(蓝色)与精氨酸(红色)交联。 (c)显示了葡糖烷的分子模型。
图(a)显示了胶原原纤维和葡萄糖泛的形成的图,其共价结合赖氨酸和精氨酸的侧链。 (b)显示了葡糖胺的化学结构,该结构使赖氨酸(蓝色)与精氨酸(红色)交联。 (c)显示了葡糖烷的分子模型。描述了糖化成纤维细胞生长因子β-FGF在纤维化形成中的参与。 纤连蛋白蛋白的arg-gli-asp序列的糖基化导致违反了血管的再生能力和血管病变的进展。 随着年龄的增长,CNG会累积在晶状体和视网膜中。 晶状体是眼晶状体的主要结构蛋白,容易糖基化和交联。 晶状体蛋白的糖基化导致白内障。 糖化血红蛋白用于确定最近3个月的平均血糖水平,但失去了将氧气转移至组织的能力,这会对许多化学过程产生负面影响。
还已知蛋白质糖基化和CNG的形成伴随着自由基活性和脂质过氧化作用的增加,这促进了与年龄有关的疾病的发展。 这是由于以下事实:在蛋白质糖基化过程中,启动了糖的自动氧化过程,同时增加了活性氧(ROS)的产生。 此外,CNG与CNG受体(RAGE)的结合还导致反应性ROS的形成,以及随后与炎症和动脉粥样硬化相关的氧化应激敏感转录因子NF-kB的激活。
反过来,NF-κB的激活会增加RAGE的表达,从而产生一个正反馈循环,从而增强炎症启动子的产生。 此外,CNG-RAGE相互作用会激活NADPH氧化酶(产生超氧化物的酶复合物),从而增加细胞内的氧化应激。 并且,响应于AGE-RAGE的相互作用,NADPH氧化酶引起的氧化应激增加会激活NF-κB。 在这里,我们可以观察到许多“恶性循环”-带有积极反馈的循环。
线粒体呼吸链蛋白的糖基化也有助于此过程:呼吸链的破坏是超氧化物自由基的恒定来源。 另外,在不可分解的CNG糖基化作用下,线粒体和其他结构的形成可能是造成“代谢记忆”现象的原因。 在2型糖尿病患者中,严格的血糖控制不再能防止与心血管疾病相关的并发症的发展。 假定不可分解的CNG在这种现象中起主要作用[6]。
同样,糖基化会引起炎症过程的增加。 因此,在胶原蛋白糖基化过程中,该过程的最终产物积聚在血管外基质中,人体将其视为异物。 因此,在免疫细胞-巨噬细胞-会增加促炎性细胞因子(TNF-α,白介素6等)的分泌的过程中会产生免疫反应,众所周知,它们具有负面影响胰岛素抵抗和动脉粥样硬化的能力[7]。
此外,“交联”蛋白改变了结构(纳米形貌)并增加了细胞外基质的刚性,并通过膜机械受体和细胞骨架以及信号分子,影响基因表达,细胞,组织和整个身体的功能。 而且,由于脯氨酸,胶原蛋白分子传导由细胞和组织产生的微弱的电磁波,并且可能除了机械和化学信号外,还形成了人体的单一生物电信号系统。 有趣的是,通过改变介质的形貌或电磁辐射,您不仅可以控制细胞周期,还可以在不借助Yamanaka因子载体的病毒的情况下将成年体细胞转变为干细胞。
甚至细胞间介质的剪切模量和粘弹性的微小变化也会对细胞产生强烈影响-“旧的”细胞外基质可能会大大限制使用senolytics和干细胞疗法的有效性。 因此,“年轻”成纤维细胞在旧基质中迅速衰老,反之亦然-“旧”细胞失去“年轻”基质中与衰老相关的分泌表型的迹象。
糖化蛋白质和CNG的原因是什么? 人们认为,当今现代人的主要食品是垃圾食品。 产品上炸的棕黑色外壳代表CNG的集合,这是由于产品(油炸肉,土豆等)在高温下进行热处理而形成的。 炸培根被认为是形成的CNG数量的记录保持者。 此外,食用含有许多快速碳水化合物的食品(糖果,含糖饮料等)也会导致蛋白质糖基化和CNG的形成。 相反,由于其中含有萝卜硫素,已知产品有助于抵抗CNG的积累-黑萝卜,萝卜,西兰花。 这并不奇怪,但是与美食家一样,吸烟者会定期为自己提供高剂量的CNG。 烟草烟雾中含有与赖氨酸和精氨酸残基反应形成CNG的糖毒素。 这可能是吸烟者患有呼吸器官慢性炎症的原因[8]。
如上所述,除了外部因素的影响外,CNG的形成通常在生理条件下也是内源性地(即在体内)发生的。 尽管该过程缓慢且微不足道,但随着自由基浓度的增加,胰岛素抵抗,糖尿病和血糖升高,其显着增加。 CNG在体内积累,将一个人拉入病理过程的“沼泽”,然后很难从中摆脱出来。
在SENS作者的形象表达中,蛋白质交联充当结合蛋白质分子的分子“手铐”,从而侵犯了它们的功能。 SENS的作者在开发可以与交联反应并破坏它们而又不破坏分子其他结构特征的药物中看到了解决该问题的方法。 他们认为,此过程中的一个有利情况是,在我们的蛋白质分子结构中发生化学事故时发生的交联具有非常不寻常的化学结构,通常在人体产生的物质中不会发生。 什么应该促进治疗剂的寻找和创造。
另外,SENS的作者确定了解决该问题的许多有前途的方法。 例如寻找或开发酶而不是药物来破坏交联。 以及“一次性”蛋白质的开发将破坏交联,然后在此过程中自身被破坏。 已知此类蛋白质存在其他用途,例如MGMT DNA再生蛋白质[9]。 有人说,在生物体内描述了脱水酶这一事实,有利于寻找酶的方法。 因此,在真菌和细菌中,发现了对糖类低分子量氨基酸化合物起作用的耐糖基化酶羊膜菌病,果糖溶菌素-6激酶frlD和果糖溶菌素6-磷酸去糖酶frlB [10]。 在脊椎动物中,发现了果糖胺-3-激酶(FN3K)及其相关蛋白FN3K-RP,它们能够在ATP依赖性过程中分解细胞内糖基化产物[11]。
据认为,葡糖庚烷对老年人的疾病进程具有最大的影响,因此是抗衰老治疗的优先目标。
不幸的是,未选择葡萄糖窗格作为先前开发的抗交联药物的靶标,例如Alagebrium / ALT-711(Wolffenbuttel等,1998),C36(Cheng等,2007),TRC4149(Pathal等,2008)。 ),而他只需要证明自己在衰老机制中的作用即可。 这些物质旨在中和羧甲基赖氨酸,后者是糖尿病患者体内最常见的美拉德晚期反应产物。
目前,耶鲁大学的大卫·斯皮格尔(David Spiegel)小组正在致力于合成针对含葡萄糖泛蛋白的抗体。 奥布里·德·格雷(Aubrey de Gray)确认了葡萄糖庚烷研究的重要性,并于近期宣布注册Revel,在此基础上,该大学的研究很可能会继续进行。
但是,由于抗体和酶的大小,很可能既不能穿透胶原蛋白原纤维,也不能穿透它们。 此外,服用药物后胶原蛋白的交联被破坏,这将需要第二个疗程。
因此,人工酶样催化剂的尺寸可能比原始酶的尺寸小几倍,这似乎是一个更有趣的选择。 坦普尔大学的克里斯蒂安·沙夫迈斯特研究小组正在开发具有给定催化活性的类似分子螺螺旋低聚体。
如前所述,由于糖化的最终产物会在衰老过程中积聚,因此对其定量可以成为衰老的准确而可靠的生物标记。 然而,由于改变的性质,受器官和系统的限制以及需要进行多次活检,因此体内CNG的检测和细胞间基质的组成和结构的改变的早期诊断都是困难的。 即使在一种生物中,结果也非常不同,这取决于活检的位置和所检查的最终糖基化终产物的类型。
确定皮肤中最终糖基化产物的可用方法,例如自发荧光,即不使用特殊染料(荷兰DiagnOptics BV制造的AGE-READER设备)无法提供准确的数据,许多因素都会影响测量结果,例如水的变化- .
当今定量人体中CNG的最主要,最准确的方法是色谱法与质谱检测相结合。质谱分析可以高度确定地确定蛋白质并确定其在复杂蛋白质混合物中的含量。. ( , .). , –. . ( , ) .
, , , - (). , , . , , (RAGEs). RAGE , Nf-κB (, -, -6 C- ). , . , - , [12].
, - , . 6- Invecchiare in Chianti, 1.013 65 , , , , , , [13]. 2018 , D1-B2, , . [14]
- (, DOGDIC, MODIC GODIC), [15]. , – GOLD MOLD [16].
: , .
:- Krištić J, Vučković F, Menni C, Klarić L, Keser T, Beceheli I, Pučić-Baković M. et al. Glycans are a novel biomarker of chronological and biological ages.Gerontol A Biol Sci Med Sci. 2014 Jul;69(7):779-89.
- Bürkle A, Moreno-Villanueva M, Bernhard J, Blasco M, Zondag G, Hoeijmakers JH6, Toussaint O, Grubeck-Loebenstein B, Mocchegiani E, Collino S, Gonos ES, Sikora E. et al. MARK-AGE biomarkers of ageing. Mech Ageing Dev. 2015 Nov;151:2-12.
- Ahmed N., Thornalley PJ . . 2009. №9, . 642-51.
- . ., . ., . ., . . in vitro , . . 2006, №2, . 51-59.
- .., . : . , 2010, : 56(2), 168-178.
- .. «» . . . 2011. № 4.
- Bernheim J, Rashid G, Gavrieli R, Korzets Z, Wolach B. In vitro effect of advanced glycation end-products on human polymorphonuclear superoxide production. Eur J Clin Invest. 2001. Dec;31(12):1064-9.
- Mullick AE, McDonald JM, Melkonian G, Talbot P, Pinkerton KE, Rutledge JC. Reactive carbonyls from tobacco smoke increase arterial endothelial layer injury. Am J Physiol Heart Circ Physiol. 2002 Aug;283(2):H591-7.
- GlycoSENS: Breaking extracellular crosslinks.
- Monnier VM, Sell DR. Prevention and repair of protein damage by the Maillard reactionin vivo. Rejuvenation Res. 2006;9(2):264–273.
- Szwergold BS1, Bunker RD, Loomes KM. The physiological substrates of fructosamine-3-kinase-related-protein (FN3KRP) are intermediates of nonenzymatic reactions between biological amines and ketose sugars (fructation products). Med Hypotheses. 2011 Nov;77(5):739-44.
- Semba RD, Najjar SS, Sun K, et al. Serum carboxymethyl-lysine, an advanced glycation end product, is associated with increased aortic pulse wave velocity in adults. Am J Hypertens. 2009;22:74–79
- Semba, RD, Bandinelli, S., Sun, K., Guralnik, JM, & Ferrucci, L. (2009). Plasma Carboxymethyl-Lysine, an Advanced Glycation End Product, and All-Cause and Cardiovascular Disease Mortality in Older Community-Dwelling Adults. Journal of the American Geriatrics Society, 57(10), 1874–1880.
- Wendel U, Persson N, Risinger C, Bengtsson E, Nodin B, Danielsson L, Welinder C, Nordin Fredrikson G, Jansson B, Blixt O. A novel monoclonal antibody targeting carboxymethyllysine, an advanced glycation end product in atherosclerosis and pancreatic cancer. PLoS One. 2018 Feb 8;13(2):e0191872.
- Biemel KM, Fried DA, Lederer MO. Identification and quantification of major maillard cross-links in human serum albumin and lens protein. Evidence for glucosepane as the dominant compound. J Biol Chem. 2002 Jul 12;277(28):24907-15. Epub 2002 Apr 26.
- Chellan P, Nagaraj RH. Protein crosslinking by the Maillard reaction: dicarbonyl-derived imidazolium crosslinks in aging and diabetes. Arch Biochem Biophys. 1999 Aug 1;368(1):98-104.