与卡路里限制相关的抗衰老机制和更长的寿命:转基因动物研究的数据。
众所周知,卡路里限制(CR)可延长预期寿命并抑制各种病理生理变化。 CR抑制生长激素/胰岛素样生长因子和mTORC1的信号传导,激活sirtuin并增强线粒体氧化还原调节。 但是确切的机制正在讨论中。 在这篇综述中,我们将根据霍利迪(Holliday)在1989年提出的适应性反应假说,讨论根据动物研究和分子和遗传技术的最新进展进行遗传修饰的动物实验机制。 我们还将根据其在营养或禁食条件下的作用来解释CR的积极作用。
1935年,CR被认为可以延长大鼠的寿命[1]。 CR,也被称为饮食限制或能量限制,被广泛用于衰老研究中,因为它是一种强大且易于再现的饮食控制方法,可以延长寿命。 从酵母,线虫到哺乳动物,已经在多种物种中观察到了CR。 在哺乳动物中,主要使用啮齿动物进行研究,其中CR抑制了各种与年龄有关的病理生理变化,并延长了平均寿命和最大寿命。 但是,CR的有益作用在某些菌株和/或条件下消失了。 最近的评论详细介绍了这些限制[2]。 CR发挥有益作用的程度取决于各种因素,例如啮齿动物的种类,毒株和CR发作的时间。 但是,总的来说,从年轻时开始的长期CR抑制了与年龄有关的病理生理变化,并延长了不同啮齿动物的寿命。 同样重要的是,在没有能量限制的情况下限制单个营养素(例如,葡萄糖,脂质,蛋白质)不会引起这种有益效果[3,4]。
20多年前,发现具有Prop1基因突变的Ames矮小鼠比野生型小鼠活得更长[5]。 这是第一个报道,单个基因突变或遗传修饰可以延长哺乳动物的寿命。 据我们所知,具有单一基因突变或基因修饰的40多只小鼠和大鼠的寿命比野生型动物更长。 在这些小鼠和大鼠中,大约三分之一显示出抑制的生长激素(GH)/胰岛素样生长因子1(IGF1)信号传导。 由于CR还抑制GH / IGF1信号传导,因此CR的有益效果可以基于此。 已提出的调节CR有益作用的其他分子机制包括抑制雷帕霉素复合物1(mTORC1)的机械靶标的活性,自噬激活,NAD +和瑟土因代谢的激活以及线粒体的氧化还原调节增加[6,7]。 但是,这些机制尚未完全理解。
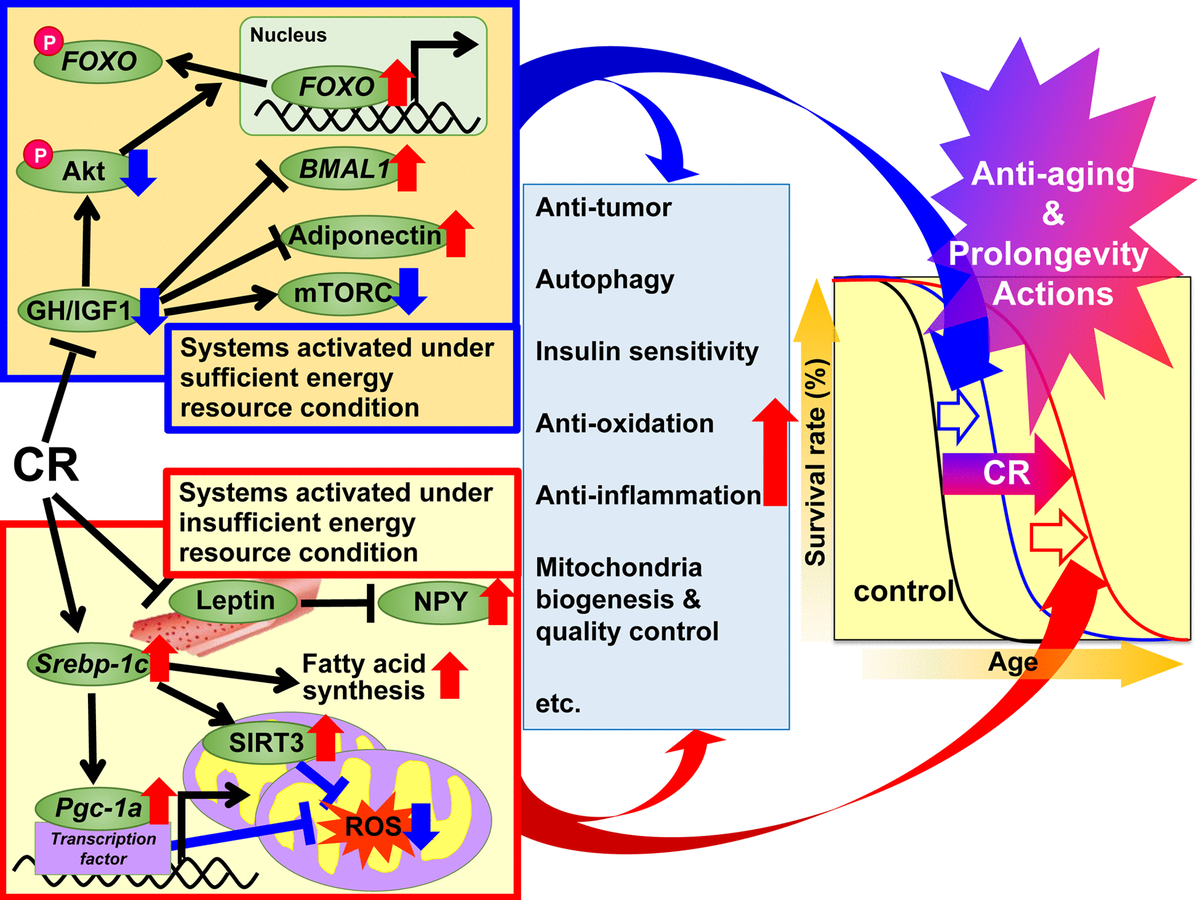 图1。 基于适应性反应假说,提出了热量限制(CR)对抗衰老和延长寿命的作用机制。 建议将CR的监管机制分为两个系统。 第一个系统在足够的能量条件下被激活,这时可以自由使用能量,并且动物生长良好,繁殖能力强,并以甘油三酸酯(TG)的形式将多余的能量存储在白色脂肪组织(WAT)中,以备后用。 该系统包括生长激素(GH)/胰岛素样生长因子1(IGF1),Akt,FOXO,mTORC,脂联素和BMAL1。 当没有充分利用能量的好处时,第二种系统会在能量不足的情况下被激活,动物会抑制生长和繁殖,并利用节省下来的能量来维持生物功能。 该系统包括以下信号通路:SREBP-1c蛋白,sirtuin(SIRT),PGC-1α蛋白,线粒体活性氧(ROS),瘦素和神经肽Y(NPY)。在患有CR的动物中,这些信号对于能源消耗。 此外,各种信号和/或因素可导致与CR相关的有益作用,包括在每个组织或器官中不同程度的抗氧化剂,抗炎,抗肿瘤和其他CR作用,从而导致恢复活力和延长寿命。
图1。 基于适应性反应假说,提出了热量限制(CR)对抗衰老和延长寿命的作用机制。 建议将CR的监管机制分为两个系统。 第一个系统在足够的能量条件下被激活,这时可以自由使用能量,并且动物生长良好,繁殖能力强,并以甘油三酸酯(TG)的形式将多余的能量存储在白色脂肪组织(WAT)中,以备后用。 该系统包括生长激素(GH)/胰岛素样生长因子1(IGF1),Akt,FOXO,mTORC,脂联素和BMAL1。 当没有充分利用能量的好处时,第二种系统会在能量不足的情况下被激活,动物会抑制生长和繁殖,并利用节省下来的能量来维持生物功能。 该系统包括以下信号通路:SREBP-1c蛋白,sirtuin(SIRT),PGC-1α蛋白,线粒体活性氧(ROS),瘦素和神经肽Y(NPY)。在患有CR的动物中,这些信号对于能源消耗。 此外,各种信号和/或因素可导致与CR相关的有益作用,包括在每个组织或器官中不同程度的抗氧化剂,抗炎,抗肿瘤和其他CR作用,从而导致恢复活力和延长寿命。CR的目标和分子机制
GH,IGF1和FOXO1信号传导
GH主要通过GH受体(GHR)上调肝脏中IGF1的产生。 IGF1作用于IGF1受体,然后磷酸化靶细胞中的Akt,丝氨酸/苏氨酸激酶。 然后,Akt的磷酸化形式会磷酸化FOXO的转录因子,从而促进核输出。 因此,GH / IGF1信号转导的抑制会增加FOXO转录因子激活的几个基因的表达。
几种改良的小鼠物种,艾姆斯矮人,斯涅尔矮人和GHR基因敲除(GHR KO),显示出抑制的GH信号传导,并具有较长的寿命。 这些矮小的小鼠具有与CR小鼠相似的表型,包括GH / IGF1信号转导受抑制,甲状腺激素,胰岛素和葡萄糖水平降低,体温降低和肥胖症减少。 但是,GHR KO小鼠和CR小鼠之间肝脏基因的表达谱差异显着[8]。 我们还报告说,CR大鼠的白色脂肪组织(WAT)中的部分基因表达谱与携带GH反义转基因的终生矮大鼠显着不同[9]。
Bonkowski等。 报道CR在野生型小鼠中增加了胰岛素敏感性并增加了预期寿命,但在GHR KO小鼠中却没有[10]。 因此,他们建议增加CR寿命取决于抑制GH / IGF1信号传导。 在携带反义GH转基因的矮小鼠和矮大鼠中,CR进一步增加了预期寿命[11,12]。 这些数据表明,抗衰老作用和增加CR预期寿命可以独立于GH / IGF1信号进行调节,也可以独立进行调节。
哺乳动物中的FOXO转录因子由四种同工型组成,即FOXO1、3、4和6。FOXO1KO小鼠(具有该基因的敲除)具有延长的CR寿命,但没有与CR相关的抗肿瘤作用[13]。 相反,在FOXO3 KO小鼠中,CR的添加抑制了肿瘤的发生,但是没有CR引起的寿命增加[14]。 这些差异可能与CROX诱导的转录因子FOXO的四种同工型的组织和/或细胞中的差异激活模式有关。
蛋白质BMAL1是参与昼夜节律调节的转录因子。 在BMAL1 KO小鼠中(剔除该基因),食物摄入增加,体重下降,衰老表型加快。 在这些相同的小鼠中,CR不会降低胰岛素和IGF1的水平,也不会增加预期寿命。 这表明BMAL1参与了CR的有益作用,并且这种有益作用取决于GH / IGF1信号的传递[15]。
报警器
mTOR激酶,丝氨酸/苏氨酸激酶,已被确定为雷帕霉素的靶分子。 它形成两个单独的多蛋白复合物,称为mTORC1和mTORC2。 已知MTORC1被氨基酸和生长因子(例如胰岛素和IGF1)激活。 mTORC1的激活通过S6 1核糖体蛋白激酶促进蛋白合成,通过甾体调节结合蛋白(SREBP)1促进脂肪酸合成,并通过过氧化物酶体增殖物激活受体(PPARγ)促进脂肪细胞分化。 mTORC1通过EB转录因子(TFEB)抑制自噬和溶酶体生物合成。 对mTORC2的功能了解甚少,但据信它与mTORC1一样包括增加的合成代谢作用和抑制分解代谢作用[16]。
中年后长期给予mTORC1雷帕霉素负调节作用的小鼠预期寿命增加[17]。 根据这一发现,TSC1蛋白过表达的转基因小鼠比野生型小鼠的寿命更长,该蛋白对mTORC1负调控。 此外,具有S6 1核糖体蛋白激酶的基因敲除小鼠和mTOR突变小鼠也比野生型小鼠活得更长[19,20]。
据我们所知,尚未在具有mTORC1功能缺陷的小鼠中研究CR的有益作用。 然而,在具有遗传抑制作用的酵母中,mTOR CR不能延长寿命[21]。 通过抑制mTORC1增强自噬。 在缺乏与自噬相关基因的线虫中,CR不能延长寿命[22]。 根据这些数据,mTOR活性的降低和自噬设备的激活可能与CR的积极作用有关。
西尔图因斯
Sir2被发现是一种新基因,参与酵母中的转录抑制。 此后,据报道它在延长CR的寿命中起着关键作用[23,24]。 已经在哺乳动物中鉴定出七个瑟土因直向同源基因,瑟土因Sirt1-Sirt7。 蛋白质SIRT1、6和7主要位于细胞核中,SIRT2位于细胞核和细胞质中,SIRT 3、4和5主要位于线粒体中。 Sirtuins取决于NAD催化包括组蛋白在内的各种蛋白质的脱乙酰反应[25]。
据报道,在七个哺乳动物的sirtuins中,SIRT1、3和6参与了与年龄有关的病理生理和寿命调节[26]。 SIRT1蛋白在下丘脑神经元中选择性过表达的转基因小鼠比野生型小鼠具有更长的寿命。 [27]。 SIRT6蛋白过表达的转基因雌性小鼠比野生型小鼠具有更长的寿命[28]。 在老年小鼠中,CR可增加SIRT6表达并改善肾功能衰竭6个月。 此外,SIRT6的过表达通过降低炎症相关转录因子NF-κB的活性来抑制细胞衰老,而SIKT6基因敲除可促进细胞衰老[29]。 在SIRT3 KO小鼠中,先前观察到各种与年龄有关的病理[30]。 尽管CR可以防止野生型小鼠出现与年龄有关的听力损失,但在SIRT3 KO小鼠中未观察到这种作用[31]。
转录因子NRF2
NRF2结合抗氧化剂响应的元素,以响应氧化应激诱导靶基因的表达,并增强参与抗氧化剂和排毒响应的基因的表达。 在生理条件下,NRF2与细胞质中的Keap1蛋白结合,并在那里降解。 在包括氧化胁迫在内的胁迫下,Keap1被磷酸化的p62捕获后,NRF2易位至细胞核,与抗氧化剂反应元件结合,并激活抗氧化剂基因的转录[32]。
由于NRF2的表达随着啮齿动物的衰老而降低,因此可以认为活性氧的含量和各种癌症风险都会增加。 但是,CR通过增加抗氧化和解毒相关基因的表达来抑制抗氧化剂能力的衰老,这与年龄有关。 在线虫中,Skn-1(NRF2的同源物)对于CR的作用以延长其寿命是必不可少的。 NRF2基因敲除小鼠显示参与抗氧化反应和排毒的基因表达减少,导致加速了肿瘤发生。 使用NRF2 KO小鼠已经研究了NRF2在CR的有益作用中的作用。 结果表明,NRF2对于CR的抗肿瘤作用很重要,但不参与与预期寿命和增加胰岛素敏感性CR相关的作用[33]。
神经肽Y(NPY)
在哺乳动物中,下丘脑弓状核中的神经元从激素循环水平感知能量状态。 CR相关的负能量平衡和随后的脂肪减少会增加生长素释放肽和脂联素水平的循环,并降低血液瘦素,胰岛素和IGF1的水平。 这些激素变化激活了下丘脑弓状核中的NPY神经元。 这些神经元中的大多数会合成Agrp蛋白,从而削弱弓形核中POMC神经元的活性。 原发性神经元活性的变化会抑制分泌下生长激素,促性腺激素和促甲状腺激素释放激素的下丘脑继发神经元,并激活分泌促肾上腺皮质激素释放激素的神经元。 下丘脑的变化抑制了GH / IGF1信号传导,甲状腺功能和生殖,并激活了肾上腺糖皮质激素功能。 这些改变的神经元分泌特征大多数在患有CR的小鼠和大鼠中观察到[34]。
在基因敲除的NPY KO小鼠中,添加CR不会延长预期寿命,不会诱导对肝脏氧化应激的耐受性,并且不会改变神经元分泌的状况。 但是,CR降低了血液中胰岛素和IGF1的水平,增加了血液脂联素和皮质酮的水平,并降低了肝脏中与β氧化有关的基因的表达。 因此,NPY应该是与GF / IGF1独立的CR作用相关的关键因素[35]。
线粒体DNA突变(mtDNA)
据信mtDNA突变的积累是与年龄有关的疾病的关键发病因素之一。 PolgA D257A / D257A小鼠在mtDNA聚合酶γ中携带一个突变,并且在各种组织中显示出与年龄相关的mtDNA突变积累和年龄表型的早期发展[36]。 在PolgA小鼠中,D257A / D257A CR不能延长寿命,不影响骨骼肌mtDNA缺失的积累,并且不能改善心脏功能,这有助于肌肉减少症。 这些数据表明,mtDNA突变的积累可以抑制CR的有益作用[37]。
我们的新结果:脂肪组织的CR重塑
与糖尿病,高脂血症和高血压相关的内脏肥胖,统称为“代谢综合征”,是发展成威胁生命的动脉粥样硬化疾病(包括心肌梗塞和脑梗塞)的已知危险因素。 最初被认为仅与能量功能有关的脂肪组织,最近已被描述为一种内分泌器官,可分泌各种被称为脂肪因子的生物活性分子。 与小的脂肪细胞相比,积聚甘油三酸酯(TG)的大型脂肪细胞过度增加了炎症性脂肪因子的分泌,包括肿瘤坏死因子-α(TNF-α)和白介素-6(IL-6),并且降低了脂联素的分泌。 TG。 这些脂肪因子的分泌状况直接与年龄相关的疾病有关,包括胰岛素抵抗,高血压和动脉粥样硬化[38]。 另外,最近已经报道了脂肪组织和脂肪因子是调节寿命的关键因素。 例如,与野生型小鼠相比,脂肪细胞中具有胰岛素受体敲除作用的小鼠显示出肥胖的减少,线粒体生物发生的增加以及更长的寿命[39]。 肝脏中脂连蛋白过表达的转基因小鼠的存活率高于对照组[40]。 转录因子PPARγ和CCAAT /增强子结合蛋白α(C /EBPα)和β(C /EBPβ)参与脂肪细胞的分化。 在C / EBP基因座处具有C /EBPβ基因分解的小鼠显示出增强的线粒体生物发生和更长的寿命[41]。 相比之下,PPARγKO敲除小鼠的寿命短于对照组[42]。
据报道,CR可增加任何年龄小鼠的脂联素活性形式。 脂联素的这种CR相关调节取决于GH / IGF1信号传导[43、44]。 我们按时间顺序分析了CR相关的变化,并获得了以下结果。 CR早期阶段后,增加了脂肪酸生物合成(FA)和线粒体生物发生中涉及的基因和/或蛋白质的表达。 与CR相关的变化主要发生在脂肪组织中,而不是其他组织或器官中。 此后,发生了形态学变化,包括脂肪细胞大小的减少和肝脏中代谢的变化[45]。 为了阐明与GH / IGF1信号无关的脂肪组织中CR相关的代谢变化,我们比较了野生型大鼠与随意给予转基因大鼠(AL)的野生型大鼠脂肪组织中CR的基因表达谱。 我们的结果表明,CR增强了与脂肪酸生物合成有关的基因的表达,特别是在脂肪酸生物合成的主要转录因子调控基因SREBP-1中,与GH / IGF1无关[9]。
因此,我们随后将CR的效果与各种参数进行了比较,包括敲除SREBP-1c KO小鼠和野生型小鼠之间的寿命。 SREBP-1c KO小鼠的寿命略短于野生型小鼠。在具有延长寿命的野生型小鼠中,CR增加了参与脂肪酸生物合成和线粒体生物发生的蛋白质的表达,并抑制了氧化应激。这些变化大多数主要在脂肪组织中观察到,而在其他组织中则没有观察到。相反,在SREBP-1c KO小鼠中未观察到CR相关的寿命延长和脂肪组织改变。据报道,PGC-1α蛋白是CR诱导的线粒体生物发生的关键调控因子[46]。我们观察到SREBP-1c与Pgc-1α基因的启动子结合,表明SREBP-1c直接调节Pgc-1α的转录[47]。此外,对脂肪组织蛋白质组的分析结果表明,CR激活了丙酮酸/苹果酸循环[48]。实际上,据报道CR可以激活脂肪组织中从头开始的脂肪酸生物合成,但不能激活肝脏中[45]。这些数据表明,SREBP-1c KO小鼠在CR条件下不能有效利用脂肪。因此,脂肪组织不仅可以充当用于储存能量的组织,而且还可以起到在CR条件下通过SREBP-1c将葡萄糖转化为能量更高的脂肪酸的作用。但不在肝脏中[45]。这些数据表明,SREBP-1c KO小鼠在CR条件下不能有效利用脂肪。因此,脂肪组织不仅可以充当用于储存能量的组织,而且还可以起到在CR条件下通过SREBP-1c将葡萄糖转化为能量更高的脂肪酸的作用。但不在肝脏中[45]。这些数据表明,SREBP-1c KO小鼠在CR条件下不能有效利用脂肪。因此,脂肪组织不仅可以充当用于储存能量的组织,而且还可以起到在CR条件下通过SREBP-1c将葡萄糖转化为能量更高的脂肪酸的作用。CR
1989年,霍利迪(Holliday)从进化论的角度,从进化论的角度解释了CR的抗衰老和预期寿命的影响,这些微生物开发了适应性反应系统,以在粮食短缺时期最大化生存[49,50]。基于这种进化的观点,我们将CR的有益作用分为两个系统: “在足够的能源条件下激活的系统”和“在不足的能源条件下运行的系统”。第一种是体内激活的,通过提供丰富的营养为动物提供自由的能量利用。换句话说,当有大量食物可自由使用时,动物会生长良好,繁殖更多,并将多余的能量(如TG)存储在脂肪组织中以备后用。但不是很多,以至于他们肥胖。第二个系统在自然环境中被激活,由于食物短缺,该系统不允许自由使用能源。换句话说,当自由使用能量无益时,动物会抑制生长和繁殖,而利用从生长和繁殖中节省下来的能量来维持生物功能。适应自然环境变化是动物生存的重中之重。动物会抑制生长和繁殖,并利用从生长和繁殖中节省的能量来维持生物学功能。适应自然环境变化是动物生存的重中之重。动物会抑制生长和繁殖,并利用从生长和繁殖中节省的能量来维持生物学功能。适应自然环境变化是动物生存的重中之重。基于自适应反应假说和上述最新发现,我们提出了一系列CR有益效应的机制。由于实验性CR条件可以模拟能量不足的条件,因此我们假设CR抑制“在能量充足条件下激活的系统”并激活“能量不足条件下激活的系统”,并相加诱导抗衰老作用并延长使用寿命。第一组系统包括GH / IGF1,FOXO,mTORC,脂联素和BMAL1信号,CR似乎可以抑制这些合成代谢反应。第二套系统包括信号SREBP-1c /线粒体,SIRT和NPY,CR可能会激活这些反应,以最佳地利用不足的能源。此外,各种信号和/或因素可通过抗氧化剂,抗炎剂,在各种组织中的抗肿瘤作用和其他作用。关于饮食干预的范例,不仅应用了CR,而且还应用了间歇性能量限制(IER)和营养时间限制(TRF)[2]。IER通常每隔一天或每周2-3天禁食。TRF在肥胖症研究中比在生物医学研究中更受欢迎,通常涉及每天数小时限制食物(高脂肪)的摄入。IER或TRF引起的有益效果与CR引起的有益效果部分相似。然而,据我们所知,没有研究使用严格的研究计划(包括营养计划)来比较这三种饮食干预措施。因此,将来可能需要对CR,IER和TRF进行比较研究。前景展望
使用猴子进行的研究表明,CR的有益作用也可能在人类和其他哺乳动物中发生[51]。当前的CR研究集中在两个主题上,即CR分子机制的识别以及CR模拟制剂的开发。我们认为,如果不了解CR的分子机制,可能很难开发出像CR一样的新药。为了开发适用于人类的此类药物,需要进一步研究CR的分子机制,尤其是在灵长类动物中。在本报告中,我们建议根据Cheka的有益作用的分子机制进行分类和讨论,具体取决于它们是否在丰富或不足的能源条件下工作。 CR收益的分子机制的进一步研究也应考虑在内涉及的信号/因子在每个组织或器官中有助于抗氧化,抗炎,抗肿瘤和其他CR作用的程度,从而导致恢复活力和预期寿命的延长。针对上述两种系统之一的转基因动物研究表明,在不同来源的小鼠中,CR诱导作用的程度不同,将CR与IER或TRF因子的有益作用进行比较的研究不仅有助于阐明CR的进一步分子机制,而且还有与预期寿命有关的那些。从而导致年轻化并增加预期寿命。针对上述两种系统之一的转基因动物研究表明,在不同来源的小鼠中,CR诱导作用的程度不同,将CR与IER或TRF因子的有益作用进行比较的研究不仅有助于阐明CR的进一步分子机制,而且还有与预期寿命有关的那些。从而导致年轻化并增加预期寿命。针对上述两种系统之一的转基因动物研究表明,在不同来源的小鼠中,CR诱导作用的程度不同,将CR与IER或TRF因子的有益作用进行比较的研究不仅有助于阐明CR的进一步分子机制,而且还有与预期寿命有关的那些。与预期寿命有关。与预期寿命有关。由Alexey Rzheshevsky编写。资料来源:
Hoshino S,Kobayashi M,HigamiY。热量限制的抗衰老和延寿作用的机制:转基因动物研究的证据。老龄化(纽约州奥尔巴尼)。2018年9月16日