今天,衰老的(旧)细胞被称为细胞,在这种细胞中,细胞周期在各种因素(应力或分裂资源的耗尽)的影响下停止了。 结果,这样的单元不分裂并且不被更新。
剑桥大学在“癌症与衰老中的细胞衰老”会议上对细胞衰老做出了以下定义:“
细胞衰老是指由各种分子触发因素(包括致癌基因的激活以及过度的细胞分裂)导致的持续增殖停止。 此外,衰老细胞的特征在于许多基质调节剂和炎性调节剂(所谓的“与衰老的血清型表型有关”)的分泌,这会影响包括免疫功能在内的邻近细胞的功能。 许多令人信服的事实表明,细胞衰老是抑制肿瘤生长的有效机制。 同时,细胞衰老可能会导致组织和整个生物体衰老 。”
由于各种原因,可以区分三种类型的细胞衰老。
上个世纪60年代初的第一个发现是细胞复制性衰老。 在已经着名的工作中,美国老年学家L. Hayflick和P. Moorhead在培养的人类成纤维细胞的实验中证实,细胞不会无限期分裂,并且存在细胞分裂的极限(后来称为Hayflick极限或极限)[1]。 十年后,苏联生物学家Aleksey Olovnikov对这种现象做出了合理的解释,将细胞分裂的限制与DNA端粒的末端部分的逐渐缩短联系在一起。 这是由于以下事实:在大多数体细胞中,端粒酶在缩短后能够增加端粒的活性并不活跃。 端粒缩短至临界水平后,发生DNA损伤反应(DDR),其结果是细胞周期停止,细胞衰老。 众所周知,不利于健康和长寿的外部因素(肥胖,缺乏运动,压力)对端粒缩短也有负面影响[2]。 同样,在患有神经退行性疾病(例如阿尔茨海默氏病)的患者中观察到端粒长度减少的加速[3]。
对于大多数细胞,据信Hayflick极限约为50分裂,此后细胞停止分裂。 为了区分整个身体的衰老和细胞的衰老,Hayflick和Moorhead为科学革命引入了一个特殊的术语,指的是细胞衰老-衰老(与衰老相反)。
除复制性衰老外,细胞衰老还可能由其他因素引起,这些因素过早地诱导了细胞衰老,而与端粒长度无关。 这些因素构成了第二和第三类型的细胞衰老。
因此,致癌基因如RAS和RAF的激活导致细胞衰老,称为致癌基因诱导的细胞衰老(OIS)。 这种细胞衰老形式与肿瘤抑制有关。 具有复制和OIS衰老的细胞的基因组比较研究表明,尽管与增殖细胞相比,这两个物种之间的基因表达存在一些一般变化,但也存在显着差异[4]。 已知与活性氧(ROS)相关的DNA损伤在OIS衰老机制中起着重要作用。 ERK激酶也积极参与OIS的发生,刺激细胞周期进程所需的蛋白质降解。 DNA损伤反应(DDR)在这种类型的细胞衰老中的作用尚未阐明。 已知突变致癌基因(例如H-Ras G12V)具有激活p38 MAPK激酶和NF-kB转录因子相关的细胞衰老的分子途径的能力,而与DNA损伤无关。 不论DNA损伤如何,致癌Ras基因也可以通过p19ARF和细胞衰老促进p53的上调。 [5]。 因此,即使在没有DNA损伤的情况下,也不排除对细胞OIS衰老的刺激。
细胞衰老的第三种类型,也与端粒长度无关,是应力诱导的过早衰老(SIPS)。 它是响应各种压力因素而产生的:电离和紫外线辐射,ROS水平的升高,化学治疗药物。 与OIS老化相反,SIPS的出现完全取决于对DNA损伤(DDR)的响应。 从表型上看,SIPS和复制性细胞衰老在很大程度上相似,但在蛋白质表达水平上可能有所不同。 SIPS在人体整体衰老中的作用尚不完全清楚-抗氧化剂表达的增加和ROS的抑制是SIPS发生的主要因素,并未延长寿命[6]。
今天正在积极研究终止衰老细胞中细胞周期的分子机制。 众所周知,DNA损伤的程度以不同的方式影响细胞周期。 因此,中等程度的DNA损伤会导致生长暂时停止,广泛的DNA损伤会导致程序性细胞死亡,持续的DNA损伤会导致细胞老化。 决定从暂时性的生长暂停到不可逆转的停滞过渡的分子决定因素(主要因素)是复杂的,尚未完全描述。 众所周知,DNA损伤最初会激活p53-p21途径,从而终止细胞周期。 然后,如果DNA损伤无法修复,则细胞要么凋亡,要么衰老。 在第二种情况下,p16 INK4a蛋白发挥了关键作用,它通过pRb-E2F信号通路(视网膜母细胞瘤蛋白,pRb是转录因子E2F)和染色质结构的改变来调节细胞周期阻滞的长期保存[7]。
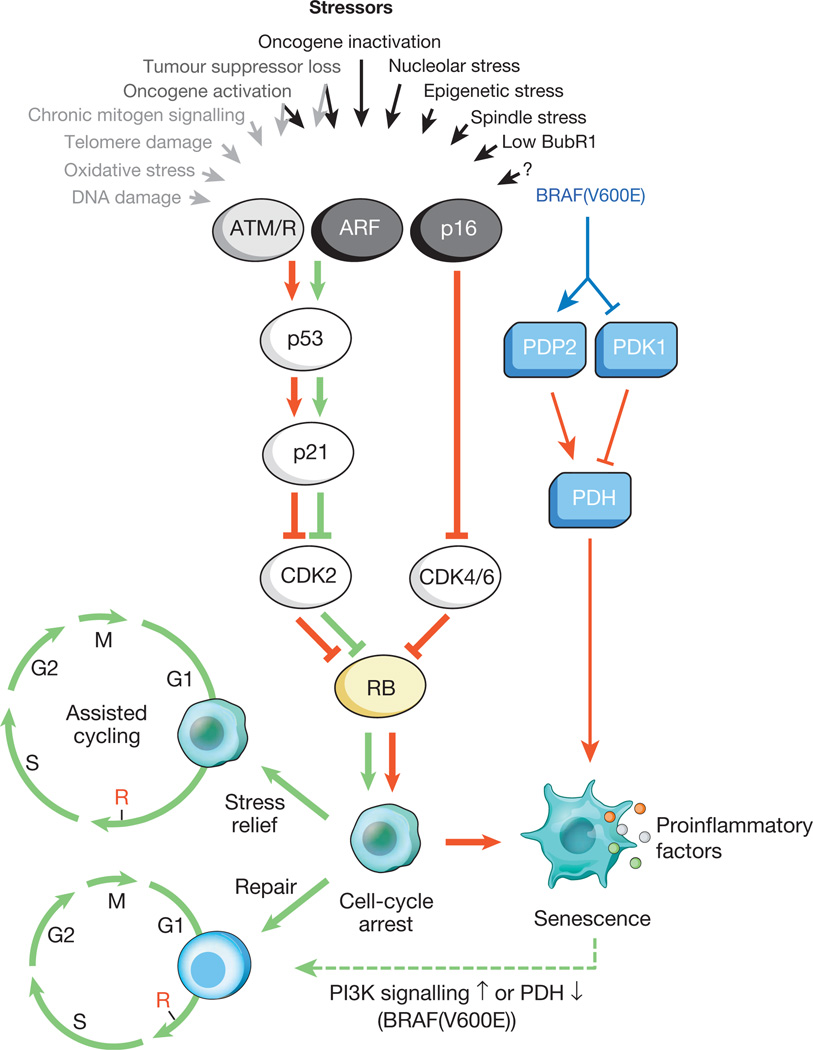
图1。
引起细胞衰老和主要效应途径的刺激多种细胞内和外部应激可以激活细胞衰老程序。 这些应激源捕获各种细胞信号转导级联,并最终激活p53和p16 INK4a。 灰色文本和箭头表示激活通过DDR的p53信号传导的压力类型(ROS(ROS)引起DNA损伤反应(DDR),破坏基因转录和DNA复制,并缩短端粒)。 活化的p53诱导p21,通过抑制细胞周期蛋白E-Cdk2导致暂时的细胞周期停滞。 p16 INK4a也抑制细胞周期进程,但通过靶向细胞周期蛋白D-Cdk4和细胞周期蛋白D-Cdk6复合物来抑制。 p21和p16 INK4a均起着防止Rb失活的作用,从而导致S期开始所必需的E2F靶基因的持续抑制。 在严重的压力下(红色箭头),暂时受阻的细胞进入细胞周期的阻滞阶段。 容易受到轻微损坏的细胞可以成功恢复并恢复正常循环。 因此,取决于压力的类型和水平,老年期的p53-p21途径可以与p16 INK4a拮抗或协同作用。 BRAF(V600E)通过代谢效应子途径与衰老相关。 BRAF(V600E)通过诱导PDP2并抑制PDK1的表达来激活PDH,从而促进了从糖酵解到氧化磷酸化的转变,从而引起老化的氧化还原应激。 无论衰老相关的诱导压力如何,经历衰老的细胞都会诱导炎性转录本(彩色圆点代表各种SASP因子)。 红色和绿色箭头分别表示促进衰老和“抗衰老”的活动。 绿色虚线箭头表示“年龄变化”机制。已知衰老细胞会主动影响其微环境(围绕它们的组织),并分泌多种活性分子:促炎性细胞因子,趋化因子,生长因子,蛋白酶(总共约40种不同类型的分子)。 这些物质合并为一个组-与细胞衰老相关的衰老相关的分泌表型(SASP)。 众所周知,SASP因子在胚胎发育中积极参与组织重塑。 而且,在他们的影响下,母亲的身体和胚胎都得以重建。 SASP的进化性质被认为与许多防御机制有关:肿瘤抑制,创伤恢复和组织再生。
SASP的简化生理作用可描述如下。 分泌的促炎分子在要去除的衰老细胞周围形成炎症的焦点。 是什么将免疫系统的细胞吸引到这个地方以消除衰老的细胞。 SASP基质金属蛋白酶(MMP-1,MMP-10,MMP-3)和丝氨酸蛋白酶可重塑细胞外基质,以促进免疫系统细胞渗透到衰老细胞中。 最后,分泌的生长因子刺激邻近细胞的增殖,从而取代远端衰老的细胞。
描述了SASP机制在年轻健康的身体中应如何正常工作。 但是随着年龄的增长和偏差的出现,其有效性会大大降低,这会导致组织中衰老细胞的积累,从而导致SASP促炎因子的分泌延长。 伴有慢性炎症灶的发生。 另外,已知延长的SASP活性充当对正常细胞的感染。 衰老细胞分泌的活性分子进入细胞外空间,并作用于邻近的正常细胞,引发细胞周期停滞和增殖停滞。 这大大加速了组织中细胞衰老的发展。
此外,衰老细胞对SASP因子的长期分泌与年龄相关性病理的发展有关。 因此,衰老细胞对基质金属蛋白酶的分泌增加会刺激冠心病,骨质疏松和骨关节炎的发展。 衰老的平滑肌细胞通过分泌大量促炎性细胞因子参与动脉粥样硬化的发展。 衰老的T细胞长时间分泌促炎因子TNF-α参与与骨功能障碍有关的过程。 另外,已知促炎性IL-6水平的升高与胰岛素抵抗,糖尿病,动脉粥样硬化和肝病有关。 为了提及与系统性慢性炎症和衰老相关的所有这些过程,其中SASP因素起关键作用,引入了一个特殊术语-发炎。 此外,已经描述了SASP在致癌中的双重作用-抑制肿瘤和促进肿瘤的活性[8]。
关于上述细胞衰老在年轻人和老年人中的双重作用,一些科学家将细胞衰老视为进化性拮抗多效性的一个例子,该现象仍被幽默地表述为“立即使用-以后付款”。 根据这一理论,已经在进化中根深蒂固以增加年轻生物的存活的过程可能对年长的个体产生累积的有害影响。 因此,与衰老细胞相关的机制与妊娠,受伤后的恢复以及对肿瘤的保护有关。 在晚些时候,相同的机制会引起全身性炎症,组织变性和病理发展[9]。
在衰老的身体细胞中,SENS概念的作者强调了与脂肪组织相关的两种类型:前脂肪细胞和内脏脂肪组织细胞。 这绝非偶然,因为今天已知内脏脂肪具有代谢活性,并释放出许多活性分子-脂肪因子。 反过来,这又与许多与年龄相关的疾病(胰岛素抵抗,糖尿病,心血管疾病)的发展有关。 SENS的作者还关注与年龄有关的免疫系统退化。 他们认为,这是由于衰老的细胞使人体超负荷,以及答案是过度生产破坏衰老细胞的T-杀伤剂,而其他类型的免疫细胞却因此受到了损害。 是什么使衰老的身体容易受到各种感染的影响。
SENS作者从两个方向看到了解决衰老细胞积累问题的方法。 首先是对老细胞有毒性或导致其凋亡但对健康正常细胞无害的药物的开发。 第二个方向是寻找免疫系统的刺激物,以选择性地寻找并杀死衰老的靶细胞。 根据SENS开发人员的说法,选择性攻击这些异常细胞的最可能方法是使用在其表面上发现的独特分子。 实际上,不同类型的细胞在其表面上具有差异。 因此,第一步是识别和定向特定于要去除的衰老细胞的细胞表面标记。 这种策略不是抽象的,但是已经形成了某些癌症治疗的基础,这些癌症可以阻止细胞生长并吸引免疫细胞破坏它们[10]。
研究表明,衰老细胞实际上会随着年龄的增长而在各种组织中积累[11]。 还描述了消除在快速衰老的小鼠模型中积累的衰老细胞可防止出现三种主要的衰老表型(白内障,肌肉减少症,皮下脂肪减少)[12]。 在这方面,很明显,需要鉴定可靠且有效的细胞衰老生物标志物。 首先要追踪潜在的镇静药物的作用。
最常将衰老相关的β-半乳糖苷酶SA-β-Gal用作衰老细胞的生物标志物。 β-半乳糖苷酶是一种溶酶体水解酶,可从含有β-半乳糖苷的化合物(乳糖,硫酸角蛋白硫酸盐,鞘脂等)中分解出末端β-半乳糖。 早在1995年,就有文献描述SA-β-Gal在衰老细胞中的表达显着增加。 免疫组织化学方法用于确定其在衰老组织中的含量。 作为确定细胞中SA-β-gal活性的另一种方法,使用流式细胞术,以5-十二烷酰基氨基荧光素二β-D-D-吡喃半乳糖苷为底物。
但是,将SA-β-Gal用作细胞衰老的生物标记物有其自身的局限性,因为该酶会产生假阳性,不仅在衰老细胞中而且在“年轻”细胞中的表达都增加,由于种种原因,它们的增殖受到限制。 因此,如今建议将SA-β-Gal与其他细胞衰老标记一起使用。
2017年,以色列细胞学使用ImageStreamX细胞仪基于流式细胞仪开发了一种新的,更高效的技术。 该方法可以检测组织中的SA-β-Gal,效率超过80%。 为了提高分析效率,科学家与SA-β-Gal一起确定了更多的细胞衰老生物标志物-蛋白质HMGB1和γH2AX。 HMGB1是一种来自核非组蛋白HMG的蛋白质,在衰老细胞中它离开细胞核并进入细胞外空间。 γH2AX是组蛋白H2AX的磷酸化形式,是早期DNA损伤和细胞衰老的公认标记。 此外,以色列科学家采用的一种新方法可以通过增加细胞大小来确定衰老细胞。 根据研究人员的说法,他们的技术可用于快速确定新药物化合物的有效性,这些化合物将专门设计用于消除组织中的衰老细胞。 [13]。
与细胞衰老相关的异染色质灶(SAHF)也可能是衰老的另一个生物标志。 SAHF是在衰老细胞核中形成的特殊异染色质结构。 它们的形成与不可逆的异染色质化相关,该异染色质化与位于该位点的细胞周期中涉及的基因(MCM3,PCNA,细胞周期蛋白A)的失活有关。 用特殊的DAPI染料染色后,可以在显微镜下看到SAHF。 另外,已经描述了衰老细胞中早幼粒细胞白血病蛋白(PML)表达的增加,这也可能是细胞衰老的另一个标志[14]。
美国研究人员将人类外周血T细胞中的p16 INK4a蛋白描述为细胞衰老的生物标记。如上所述,p16 INK4a活跃于停止衰老细胞的细胞周期。 p16 INK4a的表达在衰老细胞中增加,并且事实证明,它与吸烟和缺乏身体活动显着相关。此外,p16 INK4a的表达与血浆IL-6的浓度有关,血浆IL-6是与年龄有关的炎症的标志物。根据科学家的说法,p16 INK4a表达是确定细胞衰老的一种容易测量的外周血生物标志物[15]。附录1.细胞衰老的生物标志物。1.与细胞衰老相关的β-半乳糖苷酶(衰老相关的β-半乳糖苷酶,SA-β-Gal)。2.蛋白HMGB1(高迁移率族蛋白B1)。3.磷酸化的组蛋白γH2AX。4.与细胞衰老异染色质病灶(SAHF)相关。5.蛋白质早幼粒细胞白血病(PML)。6.蛋白质p16 INK4a。作者:Alexey Rzheshevsky。参考文献1. L.HayflickP.S.Moorhead. The serial cultivation of human diploid cell strains. Exp Cell Res. 1961 Dec;25:585-621.
2. Epel ES, Blackburn EH, Lin J, Dhabhar FS, Adler NE, Morrow JD, Cawthon RM. Accelerated telomere shortening in response to life stress. Proc Natl Acad Sci US A. 2004 Dec 7;101(49):17312-5.
3. Panossian LA, Porter VR, Valenzuela HF, Zhu X, Reback E, Masterman D, Cummings JL, Effros RB. Telomere shortening in T cells correlates with Alzheimer's disease status. 神经生物学衰老。 2003 Jan-Feb;24(1):77-84.
4. Nelson DM1, McBryan T, Jeyapalan JC, Sedivy JM, Adams PD. A comparison of oncogene-induced senescence and replicative senescence: implications for tumor suppression and aging. Age (Dordr). 2014 Jun;36(3):9637.
5. Palmero I, Pantoja C, Serrano M. p19ARF links the tumour suppressor p53 to Ras. Nature. 1998 Sep 10; 395(6698):125-6.
6. Pérez VI1, Van Remmen H, Bokov A, Epstein CJ, Vijg J, Richardson A. The overexpression of major antioxidant enzymes does not extend the lifespan of mice. Aging Cell. 2009 Feb;8(1):73-5.
7. Narita M, Nũnez S, Heard E, Narita M, Lin AW, Hearn SA, Spector DL, Hannon GJ, Lowe SW. Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence. Cell. 2003 Jun 13; 113(6):703-16.
8. .., .., .., .. « » : SASP ? Acta Naturae, 2018, 10(1). .4-15.
9. Shankar J. Chinta, Georgia Woods, Anand Rane, Marco Demaria, Judith Campisi, and Julie K Andersen. Cellular senescence and the aging brain. Exp Gerontol. 2015 Aug; 68: 3–7.
10. ApoptoSENS: Removing dysfunctional cells.
11. Jeyapalan JC, Ferreira M, Sedivy JM, Herbig U. Accumulation of senescent cells in mitotic tissue of aging primates. Mech Ageing Dev. 2007 Jan;128(1):36-44.
12. Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, Kirkland JL, van Deursen JM. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 2011 Nov 2;479(7372):232-6.
13. Anat Biran, Lior Zada, Paula Abou Karam, Ezra Vadai, Lior Roitman, Yossi Ovadya, Ziv Porat, and Valery Krizhanovsky. Quantitative identification of senescent cells in aging and disease. Aging Cell. 2017 Aug; 16(4): 661–671.
14. Bruno Bernardes de Jesus and Maria A. Blasco. Assessing Cell and Organ Senescence Biomarkers. Circ Res. 2012 Jun 22; 111(1): 97–109.
15. Yan Liu, Hanna K. Sanoff, Hyunsoon Cho, Christin E. Burd, Chad Torrice, Joseph G Ibrahim, Nancy E. Thomas, and Norman E. Sharpless. Expression of p16INK4a in peripheral blood T-cells is a biomarker of human aging. Aging Cell. 2009 Aug; 8(4): 439–448.