我们已经
告诉过您有关循环microRNA的信息,但是还有另外一件很酷的事情-细胞外循环DNA(英语无细胞DNA,循环DNA)。 它于1948年开业。 现在,对她的兴趣增强了,这实际上是问题。
细胞外DNA(cfDNA)存在于多种体液中:血浆和血清,尿液,唾液,滑膜,腹膜和脑脊液中。
我们将考虑cfDNA在两种液体中的特征:血液和尿液。 很显然,它更便于诊断。
体内cfDNA的来源
众所周知,cfDNA在血液中作为凋亡小体,微泡,核小体,外泌体,核蛋白与血液蛋白的复合物的一部分循环,并可能以游离形式循环。
据信血液中cfDNA的原因是细胞死亡,红细胞成熟,细胞分泌DNA以及细菌和病毒的过程。 我们立即注意到,细菌和病毒的DNA是最后一个来源,对循环DNA总量的贡献很小,而且感染期间外源DNA的水平不超过几十pkg / ml。 然而,根据现代数据,健康人体内cfDNA的正常水平是血浆中3-44 ng / ml,血清中50-100 ng / ml。
体内cfDNA的很大一部分很可能是由凋亡,坏死和netosis期间的细胞死亡导致的。 在成年人中,每天约有1000亿个细胞通过程序性细胞死亡(凋亡)死亡,其结果是每天约1 g的DNA降解。
在凋亡过程中,核DNA被一种特殊的酶DNase裂解。 之后,出现具有多个核小体长度的DNA片段(180-200 bp,bp-核苷酸对),应将其作为凋亡小体的一部分由巨噬细胞处理(凋亡后进行特殊包装)。 众所周知,DNA中的核苷酸对(腺嘌呤-胸腺嘧啶和鸟嘌呤-胞嘧啶)重复了30亿次。 核小体是染色质中的特殊结构,由组蛋白组成,DNA链缠绕了一个半圈。
然后奇怪的事情发生了。 由于未知原因,死细胞的部分DNA避免与巨噬细胞相遇并进入血液。 在不同的时间,进行了实验,以确认cfDNA的凋亡性质[1,2]。
当健康供体的cfDNA通过凝胶电泳分离时,检测到对应于180-200 bp片段长度的条带。 长度是此数字的倍数,对应于凋亡过程中染色质的核小体切割。 母亲血液中胎儿DNA的检测也表明凋亡是cfDNA的来源[3]。
通常,坏死对cfDNA的外观影响较小,从而增加了严重损伤时其数量。 血浆中坏死的cfDNA以更长的片段形式检测-长度超过10,000 bp。 使用PCR(聚合酶链反应),可以区分坏死导致的cfDNA长片段和细胞凋亡导致的短片段。
除凋亡和坏死外,还有另一种鲜为人知的细胞死亡类型,它是cfDNA的来源-netosis(NETosis)。
发生中毒时,中性粒细胞会喷射出特殊的网络状结构,即细胞外中性粒细胞陷阱(NET,Neutrophil Extracellular Trap),其任务是灭活进入人体的病原体:病毒,真菌和细菌。 在这种情况下,中性粒细胞死亡,将DNA,组蛋白,各种蛋白质和酶投入细胞外空间。 众所周知,NET过程有时是病理性质的,导致血栓形成,心血管疾病和自身免疫性疾病以及癌症的发展。
最近,在2018年,发现在感染HIV的情况下,嗜中性粒细胞活跃,NET机制和netosis发生。 结果,嗜中性粒细胞,CD4 +和CD8 + T细胞,B细胞和单核细胞的网络捕获的免疫细胞大量死亡,并伴有心血管疾病的发展[4]。
cfDNA的另一个潜在来源是正常细胞和肿瘤细胞的DNA分泌。 早在1972年,就获得了淋巴细胞将DNA主动释放到细胞外培养基中的证据[5]。
细胞将DNA释放到细胞外介质中这种现象的存在表明存在通过细胞膜转移DNA的特殊机制。 在研究过程中,人们发现,在钙离子和镁离子缺乏的背景下,胰蛋白酶,链霉蛋白酶和纤溶酶的活跃作用会导致淋巴细胞释放DNA。 过量的钙离子会抑制DNA从细胞中的排出[6]。
根据喀山国立大学的俄罗斯生物化学家的说法,血液中cfDNA的另一种可能来源可能是完全未知的细胞质DNA形式,不同于核和线粒体DNA-与人类二倍体淋巴细胞膜相关的DNA(与二倍体人类淋巴细胞细胞质相关的DNA) )[7]。
尽管事实上这种类型的DNA是在1971年发现的,但仍未进行探索,尽管在PNAS和《自然》杂志上,同一位作者的作品也很少。
根据Abramova Z.I. 等人,cfDNA的某些部分可以由这种细胞质DNA形成,如cfDNA的某些片段的特征所表明的,不同于核和线粒体[6]。
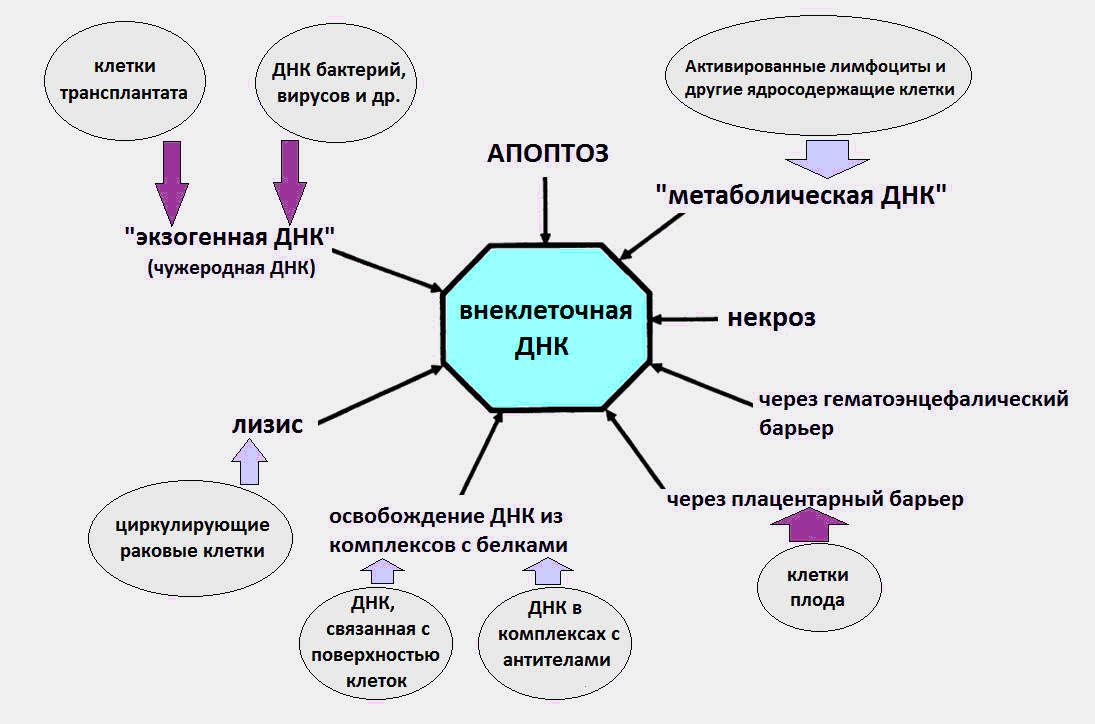 图1 cfDNA进入循环 的 各种方式。
图1 cfDNA进入循环 的 各种方式。关于cfDNA生物学各个方面的更多细节(免疫调节作用,在细胞表面接收cfDNA等),请参见Kozlov V.A教授的详细评论。 (临床免疫学研究所SB RAMS)[8]。
细胞外DNA作为多种病理学的生物标志物
逻辑表明,cfDNA的水平应随大规模细胞死亡所伴随的病理而改变。 大量研究表明,随着自身免疫疾病(系统性红斑狼疮,系统性硬皮病,类风湿性关节炎等)的发展,cfDNA水平显着增加,并且具有某些自身免疫病理学特征的cfDNA特征[8-10]。
还已知在急性心肌梗塞中,伴随着坏死和凋亡类型的心脏细胞死亡,cfDNA的水平也增加。 这具有潜在的诊断价值,因为发生并发症的患者的水平要高于那些康复程度较高的患者[11]。
在患有急性中风的患者中,血浆中cfDNA的浓度在24小时内测量,与中风的严重程度相关,甚至可以作为神经影像学方法未发现可见变化的患者的死亡率和预后的严重程度的预测指标[12,13] 。
已知cfDNA的特征是存在大量鸟嘌呤-胞嘧啶(GC)序列,与腺嘌呤-胸腺嘧啶DNA片段相比,它们更耐核酸酶破坏。 因此,cfDNA中基因组特定的富含GC的序列(核糖体重复序列的转录区域)的含量比核DNA中此重复序列的含量高出几倍[14]。
在伴随细胞死亡激活的慢性病理(冠心病,动脉高血压,自身免疫病理)中,血液fcDNA中这些富含GC的标记序列的含量增加了10倍以上[15]。 这使得可以将富含GC的核糖体DNA的参数用作cfDNA的一部分,作为慢性发生的病理过程的生物标记。
在抗击癌症中,任务是尽早发现肿瘤。 在这里,cfDNA作为肿瘤发生的生物标志物极为重要。
在做出诊断之前很久就在患者血液中检测到了肿瘤fcDNA的点突变[16]。
关于肿瘤中的cfDNA水平,使用线粒体DNA作为ccDNA的标记物,寻找致癌基因中ccDNA特异性突变,例如致癌基因KRAS,HER2,BRCA1,APC,PIK3CA,BRAF等,研究特征性遗传和表观遗传变化在肿瘤情况下,cfDNA,例如Alu运动成分的低甲基化,可以在Vasilieva等人,Gonzalez-Masia等人的著作中找到cfDNA的“完整性指数”和其他方面的使用。 [17,18]。
已经确定,cfDNA的特征是在活性氧(ROS)的作用下比核DNA具有更强的氧化态。
因此,正常情况下以及针对各种病理情况,核DNA组成中众所周知的DNA氧化标记物8-ohodG的含量为每百万个核苷酸1到10个不等,cfDNA中该标记的含量为百万分之300或更多[19]。
在肿瘤和心血管疾病中,伴随着氧化应激,cfDNA中8-ohdG的含量急剧增加,并且可以达到每百万个核苷酸3000个8-oxodG的值[20]。
通常认为,cfDNA中8-ohdG的水平是体内总氧化应激的敏感标志。
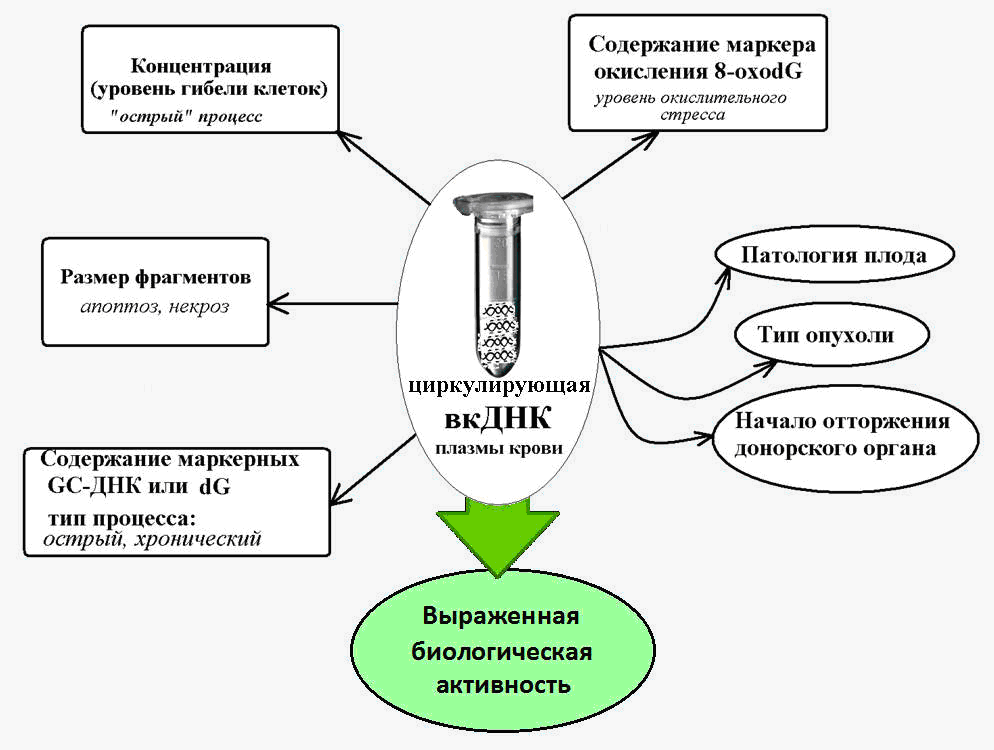 图 2. 循环细胞外DNA-在各种病理条件下的标志物,伴随着细胞死亡的增加。
图 2. 循环细胞外DNA-在各种病理条件下的标志物,伴随着细胞死亡的增加。细胞外DNA作为移动元素
三年前,cfDNA在内部过程中的作用研究取得了重大且非常重要的突破。 2015年,一组研究人员做出了令人振奋的发现,表明cfDNA就像移动遗传元件一样,能够入侵核DNA并引起基因组突变[21]。 这一切都非常令人惊讶。
在较早的工作中,已经表明血液中的肿瘤DNA可能具有整合入核DNA的能力。 将小鼠成纤维细胞置于结肠癌患者的血浆中,然后在小鼠细胞的DNA中检测K-ras癌基因和凋亡相关的p53蛋白基因,并对细胞本身进行癌基因转化(在健康小鼠中引起癌症)[22 ]。 这表明血浆中的DNA被放置在其中的细胞吸收并整合。 这种所谓的现象-血液中循环的vcDNA从健康细胞摄取致癌基因的现象-可能是转移的过程,被称为“基因转移”。
在另一项工作中,提供了有关携带男性胎儿的女性大脑中Y染色体特异性DYS14基因片段的吸收和整合的数据[23]。
在2015年的一项研究中,科学家追踪了在体外实验中(即在活生物体外部,在细胞培养物中)从癌症患者和健康人身上获得的荧光标记cfDNA如何轻松插入鼠类成纤维细胞的核DNA中。 此外,人cfDNA在小鼠细胞核中定位了几分钟,而几乎100%的小鼠细胞核显示了30分钟的荧光信号。
小鼠细胞整个基因组的测序表明其中存在人类DNA片段,包括Alu的特征性移动元件。 此外,作者发现了由DNA损伤引起的γ-H2AX病灶的诱导,以及caspase-3活性的增加以及ATM,p53,p21,GADD-34和DNA连接酶基因的表达。 所有这些都表明基因组的不稳定性增加,对DNA损伤的响应的激活和细胞凋亡。
然后作者测试了体内外源vcDNA对活生物体的作用。 给小鼠静脉内注射人cfDNA,然后在小鼠的心脏,肺,肝和脑中发现其片段,并在注射7天后处死。
而且,施用于小鼠的人类DNA颗粒能够穿过血脑屏障并穿透大脑。 与培养中的细胞一样,静脉内施用cfDNA可以诱导γ-H2AX,促凋亡的caspase-3并激活对DNA损伤的反应。 据科学家称,这是对DNA损伤的反应,在cfDNA整合入核中起着核心作用。
核DNA将细胞外引入视为双链断裂,并开始“修补”自身,将循环中的DNA整合到其组成中:“作为对DNA损伤的响应的激活过程,通过恢复过程的一部分,通过末端的非同源连接,将几种异质cfDNA和染色质破碎成长链结体。”
结果,作者得出了一个自相矛盾的结论:“由于细胞外循环DNA对核DNA的破坏无处不在且不断发生,可能是与年龄异常和机体最终死亡相关的衰老的主要原因。 因此,DNA可能扮演着维持生命基础,破坏生命本身的悖论角色。”
不用说,这个结论与当今关于衰老的所有观念大相径庭。
逻辑表明,这种假设将对应于以下依赖性:一个物种的寿命越长,这种形式的DNA个体越少和/或对该物种的危险性就越小。
但是,在完成这样的比较研究之前,仍然可以假设,在长寿命物种(人类)和短寿命(小鼠)中,cfDNA的产生量可能相当。 相反,在老年人中发现这些分子浓度增加的原因很可能是衰老过程的结果,而不是其原因。
尽管这是可以加强病因的后果。 阅读Belikov的文章。
此外,该发现的作者建议将cfDNA归因于另一类移动遗传元件。 然后,也许在动物界的无脊椎动物和脊椎动物代表中,广泛参与水平基因转移等过程的进化将得到解释。 多亏了这些,根据最新数据之一,人类基因组可以借用其他物种的数十个基因[24]。
一个非常重要的问题仍然悬而未决:cfDNA如何准确进入细胞? 现有的假设包括这样的建议,即含有DNA的颗粒可以通过膜中的孔,以及各种类型的内吞作用,蛋白聚糖依赖性巨胞饮作用或与膜蛋白相互作用时穿透细胞。
肥胖,炎症,X射线和各种压力的细胞外DNA
一年后,日本研究人员发现了另一个有趣的发现。 他们能够描述cfDNA在炎症和胰岛素抵抗中的积极参与,而cfDNA在肥胖人群中由于脂肪细胞的死亡而出现在血液中。 在这些过程中与cfDNA相互作用的关键因素是先天免疫分子Toll样受体9(TLR9)[25]。
俄罗斯科学院理论与实验生物物理研究所的俄罗斯科学家对此颇有兴趣。 他们发现,X射线照射和抗糖尿病药物二甲双胍可导致大鼠cfDNA(核和线粒体)的尿排泄增加。
他们的数据表明,在实验之前,老年大鼠尿液中的核cfDNA含量高40%,线粒体fcDNA含量高50%。
照射后12小时,幼鼠尿中i-fccDNA和mt-fcDNA的含量分别比对照组增加了200%和460%,而老年鼠尿中的i-fccDNA和mt-fcDNA的含量分别增加了250%和720%。
将二甲双胍施用于其他大鼠后6小时,年幼大鼠尿液中i-cfDNA和mt-fcDNA的量分别增加了25%和55%,以及老年大鼠尿液中的i-cfDNA和mt-fcDNA的含量分别增加了50%和160%。
这组作者说,这些数据表明X射线和二甲双胍会导致大鼠尿液(尤其是老尿液)中cfDNA的显着增加,这是由于组织中活跃的细胞死亡所致。 这些结果还表明,二甲双胍可能起到镇静作用,引发含有结构和功能障碍的旧细胞死亡[26]。
去年10月,科学家追踪了18-36岁年轻人中cfDNA水平与精神压力和体育锻炼的关系。 结果显示,在急性心理社会实验室压力(TSST)后,cfDNA增加了两倍;在跑步机上运动后,cfDNA增加了五倍(实现了跑步机的疲惫)。
还记录了体力消耗后血液中cfDNA较短片段的增加,该片段具有凋亡特征。
两种应力负荷后,细胞外线粒体DNA表现出相同的增加。 此外,在这项工作中用作不同细胞起源标记的cfDNA甲基化谱图在不同的压力测试中也存在显着差异。
为了进行甲基化分析,科学家选择了活跃参与胚胎发育的HOXA5基因,因为其甲基化在不同类型细胞中的特异性。因此,它的特征是肌肉细胞中的甲基化过度,海马细胞系和培养的神经元中脑细胞的甲基化不足以及血细胞中的甲基化差异。这组作者说,cfDNA中HOXA5基因的甲基化在受到社会心理压力后立即减少,而在受到生理压力后增加,这表明活性核DNA释放的各种细胞来源。[27]。细胞外DNA与衰老
现在最主要的。让我们检查cfDNA的水平和特定特征与衰老之间的关系。证明这种关系的第一批作品发表于2011-13年。来自坦佩雷大学的芬兰微生物学家和免疫学家研究了90岁以上的长肝脏,Vitality 90+研究的参与者以及年轻人(22-37岁)的cfDNA值。他们的工作结果表明,长肝脏中的cfDNA浓度明显高于年轻肝脏。 cfDNA也存在特征差异:在老年人中,低分子量片段代表更多,在年轻人中,高分子量片段代表更长,即更长。在以下研究中,同一组研究表明,cfDNA水平与90岁以上人群的炎症标志物(与C反应蛋白,血清淀粉样蛋白A(SAA)等水平呈正相关)和死亡率之间有着明确的关系。以及总水平和甲基化水平较低的cfDNA水平与全身炎症反应和衰老性衰弱(脆弱)的发展有关[28-30]。关于cfDNA和衰老的两项最新研究表明,该DNA具有特征性的表观遗传变化。在其中一个小组中,一组科学家分析了23至61岁健康人的cfDNA中流动遗传元件LINE-1和Alu的甲基化如何随年龄变化。LINE-1元件的长度约为6000 bp,而cfDNA的高分子量片段的大小则超过10000 bpLINE-1是指后元素,即使用逆转录进行繁殖的移动元件,即遗传信息从RNA到DNA的转移。 LINE-1是当今已知的基因组中唯一保留了在基因组中复制和移动其拷贝的能力的移动元件。而且,这是人类活动结构中最多的:LINE-1的拷贝在DNA中占据了很大的比例-占整个基因组的五分之一。第二个元素Alu不能自行繁殖并向基因组中插入新的插入物,并且在此过程中取决于LINE-1元素的遗传装置(有关逆转录基因组元素的更多详细信息,请参见《流行力学》中的文章“ 逆转录病毒:DNA的第五列 ”)。研究结果表明,随着年龄的增长,反烟元素LINE-1和Alu的甲基化显着降低,吸烟者的这一过程明显加剧。正如今天所发现的,能够将其拷贝插入基因组的LINE-1和Alu元素的活性在人类遗传疾病和癌症中发挥了重要作用。已知有超过100种LINE-1介导的插入物(插入物)导致人类遗传疾病,并且已经发现了数种LINE-1插入物会中断肿瘤抑制基因并引发癌症[31]。在第二项研究中,科学家证实了cfDNA中LINE-1和Alu元素的甲基化随年龄的增长而降低。此外,在研究的4个组中(健康长肝100多岁,不健康长肝100岁以上,老年人(71岁)和年轻人(25岁)),年轻人和健康长肝不健康长肝具有相似的特征:“在我们的研究中,我们经常注意到,与老年人和不健康的长肝脏不同,在年轻和健康的长肝脏之间,cfDNA图谱在全球和地方具有更大的相似性。因此,我们的研究表明,fcDNA谱分析不仅可以用作年龄的生物标志物,而且可以用作整体健康状况的预测指标。” [32]。因此,细胞外循环DNA证明与健康状态和衰老过程中机体发生的过程密切相关:氧化应激,炎症和与年龄有关的病理。现代研究方法(例如实时定量PCR)允许将cfDNA用作衰老相关过程的非常敏感的生物标记。研究表明,cfDNA分析在诊断癌症,移植学,心血管和肾脏疾病,纤维化,产前诊断(怀孕期间),受伤和败血症以及运动医学方面具有巨大的潜在价值。cfDNA可以表现出可移动元件的特性并整合到核DNA中,从而通常影响与突变和衰老相关的病理发展的数据,也无疑是令人感兴趣的。所有这些都需要进一步的研究和完善。该审查由以下人员准备:Alexey Rzheshevsky和一位小米哈伊尔·巴廷(Mikhail Batin)参考文献- Jahr S, Hentze H, Englisch S, Hardt D, Fackelmayer FO, Hesch RD, Knippers R. DNA fragments in the blood plasma of cancer patients: quantitations and evidence for their origin from apoptotic and necrotic cells. Cancer Res. 2001 Feb 15;61(4):1659-65.
- Deligezer U1, Yaman F, Erten N, Dalay N. Frequent copresence of methylated DNA and fragmented nucleosomal DNA in plasma of lymphoma patients. Clin Chim Acta. 2003 Sep;335(1-2):89-94.
- Bishoff FZ, Dang D., Horne C., Marquez-Do D., Brincley WR, Levis DE Fetal DNA in maternal plasma circulates as apoptotic bodies: elucidations of structural nature of fetal DNA for non-invasive prenatal genetic diagnosis // Am. J. Hum. Genet. 2003. V. 73. P. 189.
- Sivanandham R, Brocca-Cofano E, Krampe N, Falwell E, Venkatraman SMK, Ribeiro RM, Apetrei C, Pandrea. Neutrophil extracellular trap production contributes to pathogenesis in SIV-infected nonhuman primates. J Clin Invest. 2018 Nov 1;128(11):5178-5183.
- Rogers JC, Boldt D., Kornfeld S. Excretion of deoxyribonuclein acid by lymphocytes stimulated with phytohemagglutinin or antigen // Proc. Nat. Acad. Sci. USA. 1972. V. 69, No 7. P. 1685–1689.
- ., .. . 2007. . .149, .23-32.
- Lerner RA, Meinke W., Goldstein DA Membrane-associated DNA in the cytoplasm of diploid human lymphocytes // Proc. Nat. Acad. Sci. USA. 1971. V. 68, No 6. P. 1212–1216.
- .. . . 2013;15(5):399-412.
- Galeazzi M, Morozzi G, Piccini M, Chen J, Bellisai F, Fineschi S, Marcolongo R. Dosage and characterization of circulating DNA: present usage and possible applications in systemic autoimmune disorders. Autoimmun Rev 2003;2:50-5.
- Leon SA, Revach M, Ehrlich GE, Adler R, Petersen V, Shapiro B. DNA in synovial fluid and the circulation of patients with arthritis. Arthritis Rheum 1981;24:1142-50.
- Destouni A, Vrettou C, Antonatos D, Chouliaras G, Traeger-Synodinos J, Patsilinakos S, et al. Cell-free DNA levels in acute myocardial infarction patients during hospitalization. Acta Cardiol 2009;64:51-7.
- Rainer TH, Wong LKS, Lam W, Yuen E, Lam NYL, Metreweli C, Lo YMD. Prognostic Use of Circulating Plasma Nucleic Acid Concentrations in Patients with Acute Stroke. Clin Chem 2003; 49:562-9.
- Lam NY, Rainer TH, Wong LK, Lam W, Lo YM. Plasma DNA as a prognostic marker for stroke patients with negative neuroimaging within the first 24 h of symptom onset. Resuscitation 2006; 68:71-8.
- .., .., .., .., .., .., .., .., .., .., — , , 2008, : 54(1), 78-93.
- Bulicheva, N. et al. Effect of cell-free DNA of patients with cardiomyopathy and rDNA on the frequency of contraction of electrically paced neonatal rat ventricular myocytes in culture. Ann NY Acad Sci. 2008. V. 1137. P. 273-277.
- Lecomte, T. Circulating free tumor DNA and colorectal cancer/ T. Lecomte, N. Ceze, E.
- Dorval, P. Laurent-Puig // Gastroenterol Clin Biol. 2010. V. 34. № 12. P. 662- 681.
- ., .. . . 2013.-N 6.-.673-681
- Gonzalez-Masia, JA et al. Circulating nucleic acids in plasma and serum (CNAPS): applications in oncology. Onco Targets Ther. 2013. V. 8. № 6. P. 819-32.
- Ermakov, AV et al. Oxidized extracellular DNA as a stress signal in human cells. Oxid Med Cell Longev. 2013. V. 2013. P. 649-747.
- Loseva, P. et al. Extracellular DNA oxidation stimulates activation of NRF2 and reduces the
- production of ROS in human mesenchymal stem cells. Expert Opin. Biol. Th. 2012. V.12. № 1. P. 85-97.
- Mittra I, Khare NK, Raghuram GV, et al. Circulating nucleic acids damage DNA of healthy cells by integrating into their genomes. J Biosci. 2015;40(1):91–111.
- Garcia‐Olmo DC, Dominguez C, Garcia‐Arranz M, Anker P, Stroun M, Garcia‐Verdugo JM, Garcia‐Olmo D (2010) Cell‐free nucleic acids circulating in the plasma of colorectal cancer patients induce the oncogenic transformation of susceptible cultured cells. Cancer Res. 70, 560–567
- Chan W, Gurnot C, Montine TJ, Sonnen JA, Guthrie KA, Lee Nelson J (2012) Male Microchimerism in the Human Female Brain. PLoS ONE 7, e45592.
- Crisp A, Boschetti C, Perry M, et al.: Expression of multiple horizontally acquired genes is a hallmark of both vertebrate and invertebrate genomes. Genome Biol. 2015;16:50. 10.1186/s13059-015-0607-3
- Sachiko Nishimoto, Daiju Fukuda et al. Obesity-induced DNA released from adipocytes stimulates chronic adipose tissue inflammation and insulin resistance. Sci Adv. 2016 Mar; 2(3): e1501332.
- Gaziev A, Abdullaev S, Minkabirova G, Kamenskikh K. X-rays and metformin cause increased urinary excretion of cell-free nuclear and mitochondrial DNA in aged rats. J Circ Biomark. 2016 Oct 25; 5:1849454416670782.
- Hummel EM, Hessas E, Müller S, Beiter T, Fisch M, Eibl A, Wolf OT, Giebel B, Platen P, Kumsta R, Moser DA Transl Psychiatry. 2018 Oct 29;8(1):236.
- Jylhävä J1, Kotipelto T, Raitala A, Jylhä M, Hervonen A, Hurme M. Aging is associated with quantitative and qualitative changes in circulating cell-free DNA: the Vitality 90+ study.
- Mech Ageing Dev. 2011 Jan-Feb;132(1-2):20-6.
- Jylhävä J1, Jylhä M, Lehtimäki T, Hervonen A, Hurme M. Circulating cell-free DNA is associated with mortality and inflammatory markers in nonagenarians: the Vitality 90+ Study. Exp Gerontol. 2012 May;47(5):372-8.
- Jylhävä J1, Nevalainen T, Marttila S, Jylhä M, Hervonen A, Hurme M. Characterization of the role of distinct plasma cell-free DNA species in age-associated inflammation and frailty. Aging Cell. 2013 Jun;12(3):388-97.
- Lars Erichsen,a Agnes Beermann et al. Genome-wide hypomethylation of LINE-1 and Alu retroelements in cell-free DNA of blood is an epigenetic biomarker of human aging. Saudi J Biol Sci. 2018 Sep; 25(6): 1220–1226.
- Teo YV, Capri M, Morsiani C, Pizza G, Faria AMC, Franceschi C, Neretti N. Cell-free DNA as a biomarker of aging. Aging Cell. 2019 Feb;18(1):e12890.