视觉装置的问题是神经生物学的重要组成部分。 大量文献和四个诺贝尔奖致力于这一问题,但是在这种情况下,人们不得不注意到教科书中描述的哺乳动物视觉装置无法应对这一任务。 本文的目的是说明为什么您不应对此视而不见的一系列原因。 实际上,将会呈现出视觉秘密的肖像,范围从哺乳动物视觉信息流开始时的各种小细节到忽视它们的威胁,最后在理解路径末端的一堆问题上最终导致了一系列问题。
视觉系统设备
在任何关于视觉的教科书中,我们都看到三个阶段。 第一阶段:光进入视网膜,并转换为感光器的神经兴奋-视网膜的感觉神经元。 此外,眼睛可以使对比度和亮度正常化,聚焦图像。
第二阶段:视网膜中的过程,将感光细胞的神经激发图转换成平行的信息流,其中每个元素编码其自身的视觉信息。 视网膜中轴突形成视神经的神经节细胞比感光细胞小得多,发生信息的第一次压缩。 一个神经节细胞可能负责将信号从中央的几个编码到视网膜外围的成千上万个感光体。 (图1)神经节细胞分为两种主要类型,具体取决于视神经从哪条路径进入大脑半球皮层。 一种在数量上占优势的类型(在人群中占80%)可提供很高的视敏度和色彩感知力,稳定的图像对比度对他们而言很重要。 由于历史原因,它们被称为PC细胞或矮细胞,因为来自它们的信号会穿过侧面曲柄体的细小细胞(小细胞)层。 第二种类型的MC细胞,其信号穿过侧向曲柄体的大细胞(大细胞)层。 它们对运动的感觉负责,因为它们对闪烁或运动的图像具有更高的灵敏度。


 图1.测量感受野的性质。 (A)神经元的反应(一系列动作电位或“粘附”)是通过曲轴中间体(LGN)中电极对麻醉动物的细胞外记录来控制的。 刺激被传递到与神经元相对应的视野部分。 (B)不同类型神经元的条件响应表。 每列显示一种类型的神经元的响应。 每行显示对一种刺激的响应。 例如,在运动方向(第二列)上具有选择性的神经元仅在刺激从左到右移动通过接受场时才做出反应。 具有标准受体场“中心/环境”的神经元可以耐受刺激的大小和运动。 非标准类型的神经元表现出更加坚定的刺激要求。
图1.测量感受野的性质。 (A)神经元的反应(一系列动作电位或“粘附”)是通过曲轴中间体(LGN)中电极对麻醉动物的细胞外记录来控制的。 刺激被传递到与神经元相对应的视野部分。 (B)不同类型神经元的条件响应表。 每列显示一种类型的神经元的响应。 每行显示对一种刺激的响应。 例如,在运动方向(第二列)上具有选择性的神经元仅在刺激从左到右移动通过接受场时才做出反应。 具有标准受体场“中心/环境”的神经元可以耐受刺激的大小和运动。 非标准类型的神经元表现出更加坚定的刺激要求。这两种类型的单元都有中心/环境类型的组织:一种可视信息的通用编码策略。 (图2)从神经节细胞获得最大能量反应的最佳刺激是在视网膜上或多或少地出现圆形和小斑点,并且在周围背景(明亮或暗点)上突出程度越强,细胞反应就越有活力。
第三阶段:信号在大脑中得到处理。 从普遍接受的角度来看,大脑处理的主要过程始于初级视觉皮层。 发生另一次重要的编码,神经元不仅响应视网膜表面上的暗点和亮点,而且对定向的对比边界,直线的定向部分及其末端变得选择性敏感。 当神经元精确地响应造影剂边界时,无论其位置如何,只要它们在细胞的负责区域内,刺激的结构都会更为复杂。 视觉皮层中的这种“复杂”处理被用作静态图像感知的第二抽象层次,其中无论边界的位置如何,识别都达到了新的更普遍的边界感知层次。 结果是:首先,视网膜将简单的信号传输到大脑皮层。 其次,初级视觉皮层的神经元使用这些简单的信号来检测对比的边界和线条。 第三,这些基本的构建块用于定义整个对象的边界并创建视觉感知。
可能没有人认为这种观点会变成花岗岩的基本教条。 边缘检测已被视为似乎是哺乳动物观察进化如何找到有效图像感知问题的完美解决方案的唯一方法。 在本文中,将对这种观点提出质疑,并对视觉的本质提出不舒服的问题。 在视觉研究的历史中,已经多次提出了这些建议,因此没有提出简单的答案。 因此,现在的主要任务是集中精力解决这些问题,将对现代视觉装置理解的怀疑原因归纳在一起。
所有哺乳动物的视网膜都会向大脑发送非标准信号
彻底研究灵长类动物从眼睛到大脑皮层的视觉流动的路径,可以肯定地证实,与其他哺乳动物一样,许多平行通道对灵长类动物的视觉流动起功能性作用[1-4]。 (图2)其中一些通道甚至忽略了主要的视觉皮层,并立即转到更高层次的部门[5]。 在对猫和猴子的解剖学的经典研究中提到了很多这样的问题[6-10],但是在视觉皮层研究中,神经生物学的先驱者忽略了这一点。 激进地使用Occam剃刀原理使皮质神经元的属性具有意义,因为它们仅基于来自“中心/环境”组织的神经节细胞的输入而建立了识别线或边界的功能。 丢弃具有非标准组织的神经节细胞,其视网膜中的灵长类动物数量相对较少。 它们在视觉感知中的作用将在下面描述,从神经生物学的从业者的角度来看,值得注意的是,通过将电极任意引入视神经中,遇到非标准神经节细胞轴突的可能性非常小。 由于非标准细胞很少见,因此大多数实验者选择沿着阻力最小的途径,创建将视觉刺激投射到视网膜上的方法,最适合研究中心/环境细胞,从而将非标准细胞转变为实验数据中的统计“爆发”。
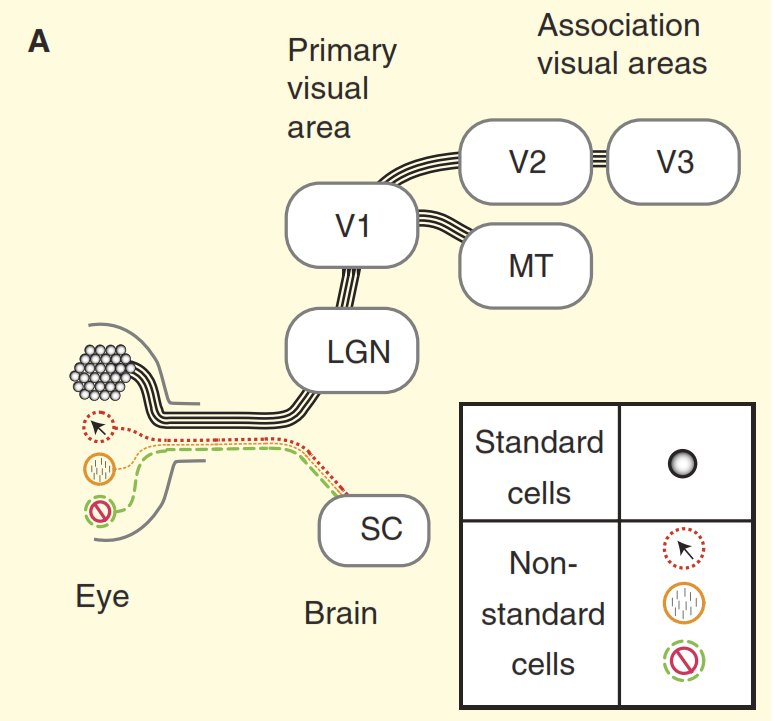
 图2.视觉系统的感知。
图2.视觉系统的感知。
(A)以猕猴为例,教科书中关于灵长类动物视觉系统设计的观点。 视网膜充满大量标准神经节细胞,它们的轴突形成视神经。 视网膜还包含少数对光有其他反应的非标准神经节细胞,但传统上认为它们仅投射到中脑的自主神经中枢,即上双眼顶(SC)。 同心细胞突入丘脑的中继核,即中间曲柄体(LGN),继而将信号传输至初级视觉皮层(V1)。 并且标准细胞通过中间曲柄体(LGN)将信号传输到初级视觉皮层(V1),然后再传输到视觉皮层的较高部分(V2,V3,MT)。
(B)灵长类动物视觉系统的更真实的视图。 一些非标准神经节细胞直接将信号毒化到中间曲柄体(LGN),然后再污染初级视觉皮层。 另外,上二极管不是死角方向,信号从那里到达中间曲柄体(LGN)甚至更远。 但这还不是全部,从中间曲柄(LGN)开始,视觉流不再是单向的,并且其反向分量比直接的分量更强大。第二个问题在图3中进行了说明。该图的上部图形显示了“中心/环境”单元的响应。 视觉神经生物学家非常熟悉基本的反应方案:标准的中心/环境神经节细胞显示出响应线对空间频率的曲线-当晶格带的宽度与中心/细胞的感受野的中心部分完全重合时,会出现最大响应环境。” 但现在考虑在同一实验中获得的视神经中非标准细胞之一的反应(图3b)。 这次,该细胞属于所谓的锥细胞型神经节细胞,是非标准细胞类型的复合集合,通常将其概括(如果有的话)称为“蓝色途径”。 该细胞具有“对比抑制”类型的组织[6,7,12,13],在该实验中,其反应几乎完全与标准细胞“中心/环境”的反应相反。 当考虑调整猴子和猫的视力差异时,“通过对比抑制”的神经节细胞表现相同[12,13]。
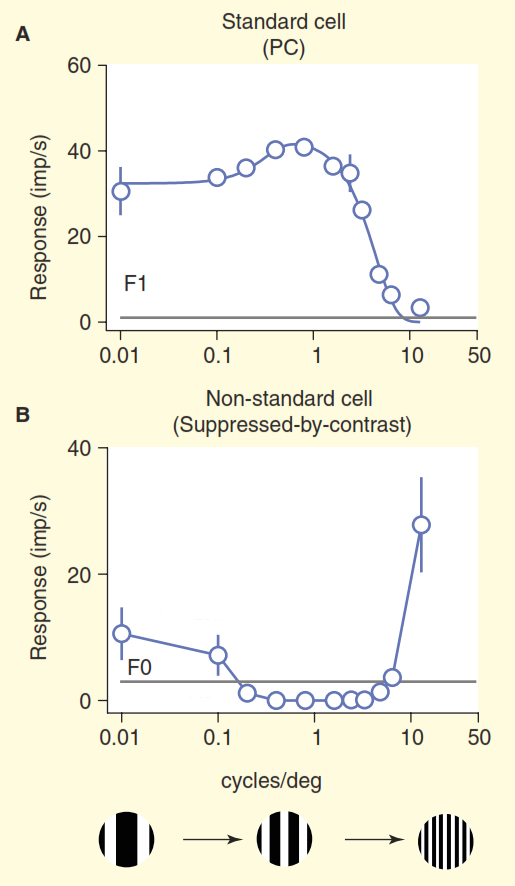 图3.标准和非标准接收场的比较。 用具有可变空间频率的漂移光栅来刺激细胞(此处的频率表示为每个视角下光栅中黑白两个波段的总宽度)。 标准的“中心/环境”神经节细胞(A)的行为符合预期:当晶格带的宽度接近感受野中心的宽度时,该细胞会产生强烈的反应。 只要能够区分黑白条纹,带有“对比度抑制”(B)的非标准单元将保持沉默而不是引起。
图3.标准和非标准接收场的比较。 用具有可变空间频率的漂移光栅来刺激细胞(此处的频率表示为每个视角下光栅中黑白两个波段的总宽度)。 标准的“中心/环境”神经节细胞(A)的行为符合预期:当晶格带的宽度接近感受野中心的宽度时,该细胞会产生强烈的反应。 只要能够区分黑白条纹,带有“对比度抑制”(B)的非标准单元将保持沉默而不是引起。我们只能假设这些单元格在其负责区域中识别出单调填充,例如晴朗的蓝天,因为当光栅的白色和黑色条的宽度减小到人眼分辨率以下时,它们会合并为纯灰色。 在标准视觉模型中没有真正理解这些细胞的视觉信息编码。
使用非标准单元格,所有非灵长类动物都能很好地看到
在考虑灵长类动物时,公认的视觉模型的拥护者可以指相对较少数量的非标准细胞,但这不适用于兔子,猫,大鼠和小鼠的视网膜[7,8,14-16]。 另外,灵长类动物视网膜中非标准细胞的绝对数量(约100,000)接近于大鼠或猫视网膜中的细胞总数[17]。 猫,兔子,大鼠和小鼠的视力比灵长类动物低,但这还不是全部。 所有这些生物的视野使您能够成功应对野外生存。 任何对此表示怀疑的人,都可以尝试在不使用捕鼠器的情况下偷偷溜到野兔上或捉老鼠(普通猫的简单任务)。
 图4.低细节的视觉感知。
图4.低细节的视觉感知。
尽管细节很少,但熟悉图像中人物的观察者仍会认出他们。 当使图像模糊时,为人保留了足够的有用视觉信息。 从左到右:查尔斯王子,伍迪·艾伦,比尔·克林顿,萨达姆·侯赛因,理查德·尼克松,戴安娜王妃。很清楚,即使仅出于医学原因,神经科学家为何集中在灵长类动物的视网膜上。 但是,当试图理解视觉时,这种选择性的专注导致了这样一个事实,即实验者将自我感知的结果带入并转移到研究结果的解释中。 密集的灵长类神经节细胞非常适合检测树上的可食用水果,或阅读最新一期的《纽约时报》,但没有特别的理由考虑进行视力增强等工作。 在一般的进化图像中,这种极高的视敏度可以被认为是一种特殊的利基适应,用于在远距离检测高对比度的物体。 视网膜上的大多数哺乳动物都没有中央凹(视网膜中央凹)-在灵长类动物中具有很高的视敏度的特殊区域-但没有百万个密集神经节细胞的视力仍能正常运作。 证据如图4所示,人们无需通常的视力即可轻松识别[18]。 在非灵长类哺乳动物中,对视觉刺激的编码已在兔子中得到了很好的研究[19-23]。 兔子的眼睛很大,并且光学系统比许多类型的灵长类动物好,并且它们的视网膜中还具有标准的中心/环境神经节细胞。 然而,这些标准细胞仅占视网膜神经节细胞总数的四分之一,由大约十二种功能和解剖学类型代表[14,21]。 显然,这十二种细胞中的每一种都在其自身的视觉刺激下因进化而被监禁。 但是,这一事实的重要性在于,来自非标准神经节细胞的通道在流入兔子大脑的视觉流中占主导地位。 这些信息不是什么新鲜事:这项创新证明了所有哺乳动物的视网膜都会向大脑传输各种编码视觉通道[4、13、24、25],并且这种多样性应包含在视觉设备的任何真实视图中。
众所周知的例子是选择性响应刺激运动方向的细胞。 其中一种类型直接向与眼球运动相关的脑干核发送信号[26]。 但是这些细胞的另一种类型还不是很广为人知,其信号不仅传递到中脑,而且还通过外侧曲柄到达初级视觉皮层[19]。 这样的细胞并不罕见,但是在描述视觉装置时,教科书中没有提及它们。 来自非标准神经节细胞的信号明确到达视觉皮层,但是如何使用呢?
第二种非标准细胞类型(在兔子,猫和小鼠中识别出)是所谓的局部边缘检测器。 像选择性响应运动方向的细胞一样,它们也曾经被认为是稀有的神经节细胞,但是现在我们知道这是由于使用电极时出现的错误:它们可能占所有神经节细胞的15%[23]。 来自这些细胞的信号也到达初级视觉皮层,但是它们的响应远远超出了标准的视觉响应[8,22,23]。 这些细胞对移动缓慢的小型目标(例如掠食者或掠食性动物)反应最佳。 但是,如果有许多小物体,例如在带纹理的字段上,则单元将停止响应。 换句话说,细胞只对一个小的运动物体起反应,但仅当它是孤独的时候。
局部边缘检测器显然是兔子中视网膜神经节细胞数量最多的一种,但是它没有包含在标准视觉模型中。 这些单元格可以构成远距离的运动分析系统吗? 视觉皮层如何处理这些细胞发出的信号? 其他哺乳动物物种如何用标准神经节细胞和局部边缘检测器,或者甚至还有视觉信息的另一种压缩来感知世界,还有待发现?
视觉皮层比教科书所识别的要聪明
即使我们假设整个视觉流仅由标准视网膜细胞编码,在这一时间点上,众所周知,根据最初提出的使用“简单”,“复杂”,“超复杂”神经元的方法,初级视觉皮层中的处理并不仅仅发生。还有神经元“具有最终抑制作用”。 有关这一事实的讨论在专业文献中有很大的空间[27-30]。
问题始于另一个显而易见的事实,即大脑皮层中几乎所有神经元都是非线性的,这使人们对使用线性假设的分级方案在解释其功能时的有效性产生怀疑[31,32]。
其次,细胞的三种基本类型的概念-“简单”,“复杂”和“超复杂”-是通过解剖学方法识别的主要视觉皮层丰富的细胞类型的粗略抽象[33,34]。 第三,视觉皮层的神经元不仅依赖于传入的视觉流,而且还依赖于邻居的各种上下文信号,因此,对日常照片中由实验人员人工创建的相同刺激的反应会有所不同[27,35]。
视觉皮层神经元的反应甚至没有及时固定:去除视网膜的一小部分会导致盲点的出现,使剩下的神经元无需工作即可改变其职责范围并处理最接近盲点的视网膜工作区域的视觉信息[36]。从解剖学的观点来看,以上都不是令人惊讶的。单个神经元最多只有10%的输入来自视觉流[37],其余来自邻近神经元或位于大脑皮层远处的神经元,那里对视觉神经元的了解仍然很少,并且对其功能的解释也是一项艰巨的任务。因此,很明显,视觉装置的标准视图陷入了教条沼泽中。要采取什么措施才能摆脱困境?第1步:复习基础知识
最新的好消息是,视网膜细胞成像技术在过去5年中经历了不起眼的革命,因此现在可以轻松地对其进行大量可视化,并以三维图像的形式实现前所未有的分辨率。查找突触和细胞相对位置的问题很容易解决;现在不仅可以通过“目测”对其进行分类,还可以使用客观分类方法进行分类[15,16]。形态学类型与视网膜细胞生理学类型的对应程度显示出直接的关系(在[24]中讨论)。因此,视网膜神经节细胞的结构类型准确地确定了视觉流中功能通道的数量。在迄今为止研究的所有哺乳动物视觉系统中,解剖学数据表明,功能通道的数量约为十二个。在猴和猫的视网膜中,这些通道中大约一半的功能是众所周知的。在兔子中,这一比例约为三分之一;尽管老鼠和大鼠的视网膜在遗传研究上具有明显优势,但在很大程度上仍未开发。因此,用现代方法武装回到1970年代未完成的事业可能是有用的[38]。任务是完成神经节细胞功能的确定,这是视觉信息压缩的第一阶段-从一开始就消除盲点-并在其余视觉系统中更新目标。逐步修正激励
经过半个多世纪的研究,为什么视觉生理学知识远远落后于解剖学知识,并且可以采取什么措施来改善这种情况?除了使用电极进行研究的选择性问题外,主要问题仍然是寻找正确刺激的方法选择。与神经科学的先驱者所提出的相比,要理解为什么视觉系统中要使用初级视皮层的视网膜神经节细胞和神经元-它们对可见环境特征的调节是什么?经典的研究技术是,实验人员在随机移动投影到视网膜上的刺激物以寻找电极所接触的细胞的作用区域时,听取来自随机浸入视神经或大脑皮层的电极的放大信号。快速有效的方法,但存在主观性和可重复性不足的问题。简单的晶格刺激和线性系统分析对于标准细胞非常有效[38,39],但是,如前所述,这种方法不适合研究原代视觉皮层的非标准细胞和非线性神经元。确定正确刺激集的新尝试很有趣[40],但迄今为止尚未达成共识。另一种选择是基于逆相关策略[41-43],其中多次出现由实验者随机选择的刺激,并且单元响应用于计算逆平均。因此,实验者可以构建导致最活跃的细胞反应的平均刺激的表示。这种方法的最大优点是,它并不意味着根据测试刺激对细胞进行任何特定的调整。出于理论和分析的原因,通常将测试刺激选择为“随机”:棋盘闪烁或其他形式的视觉噪声。此策略从概念上讲是优雅的,但在很大程度上仅限于具有标准中心/环境组织的单元格分析,因为非标准单元(根据定义)已调整为视觉信息的非常非随机特征。另一种选择是使用更激进的方法。该策略是搜索细胞的响应与在日常环境中在视频上捕获并显示在监视器屏幕上的图像的反相关性[27,44]。这个想法是,研究人员期望细胞出现重要刺激时会发出来自细胞的信号。这种方法的有效性已经通过实验证明,但是问题仍然在于,应该如何考虑二维图像的自然性,该方法将如何考虑非线性和上下文的影响,以及如何解释结果。新的一般视觉理论?
对大脑中信号周围世界的逆向比较可以看作是经验主义,达到了极端。但是与其他实验者相比,神经科学的理论家能提供什么呢?从形式上讲,它们有机会成功超越当前流行的风格,这仅仅是对实验结果的重新表述。尽管付出了四分之一个世纪的努力,但大部分工作仍无法通过时间的考验,也无法在新的实验事实中得到证实。尽管准确而紧凑的实验结果表述很重要,但它们很少导致新知识的合成,并且对数据进行数学评估的便利性的期望会给实验带来无形的限制。前面给出了一个具体示例:如果实验方法仅限于以刺激形式呈现可变宽度的光栅,则在实验数据中,具有“对比抑制”类型的神经节细胞仅表现为“爆发”,研究者对此无话可说。那么理论家将如何提供帮助?他们应该处理真实神经系统在计算上不舒服的方面。例如,实验生理学家非常了解感觉系统只有在实验者强迫它们是线性的情况下才是线性的[27,38,45]。视觉理论的广泛覆盖范围对于处理诸如理解视觉系统中冗余和稀疏编码的优点,在无脊椎动物和脊椎动物的视觉研究之间架起桥梁的必要性等工作[46,47]。问题是对视网膜视觉信息压缩的第一阶段的重新思考是否会产生结果[46,48-50]。视觉流的功能通道的多样性,以其所熟悉的感觉-视觉的形式,为我们提供了多种多样的多样性,以前曾被强调。结果,主要任务仍然是找出我们如何简单地“看到”以及总体上我们如何理解这一点?参考文献1. Casagrande VA (1994). A third parallel visual pathway to primate area V1. Trends Neurosci. 17, 305–310.
2. Hendry SHC, and Reid RC (2000). The koniocellular pathway in primate vision. Ann. Rev. Neurosci. 23, 127–153.
3. White AJR, Solomon SG, and Martin PR (2001). Spatial properties of koniocellular cells in the lateral geniculate nucleus of the marmoset Callithrix jacchus. J. Physiol. 533, 519–535.
4. Dacey DM, Peterson BB, Robinson FR, and Gamlin PD (2003). Fireworks in the primate retina: in vitro photodynamics reveals diverse LGN-projecting ganglion cell types. Neuron 37, 15–27.
5. Sincich LC, Park KF, Wohlgemuth MJ, and Horton JC (2004). Bypassing V1: a direct geniculate input to area MT. Nat. Neurosci. 7, 1123–1128.
6. Rodieck RW (1967). Receptive fields in the cat retina: a new type. Science 157, 90–92.
7. Stone J. and Hoffmann K.-P. (1972). Very slow-conducting ganglion cells in the cat's retina: a major, new functional type? Brain Res. 43, 610–616.
8. Cleland BG, Levick WR, Morstyn R., and Wagner HG (1976). Lateral geniculate relay of slowly-conducting retinal afferents to cat visual cortex. J. Physiol. 255, 299–320.
9. DeMonasterio FM (1978). Properties of ganglion cells with atypical receptive-field organization in retina of macaques. J. Neurophysiol. 41, 1435–1449.
10. Yukie M., and Iwai E. (1981). Direct projection from the dorsal lateral geniculate nucleus to the prestriate cortex in macaque monkeys. J. Comp. Neurol. 201, 81–97.
11. Hubel DH, and Wiesel TN (1977). Ferrier lecture. Functional architecture of macaque monkey visual cortex. Proc. R. Soc. Lond. Ser. B Biol. Sci. 198, 1–59.
12. Troy JB, Einstein G., Schuurmans RP, Robson JG, and Enroth-Cugell CH (1989). Responses to sinusoidal gratings of two types of very nonlinear retinal ganglion cells of cat. Visual Neurosci. 3, 213–223.
13. Tailby C., Solomon SG, Dhruv NT, Majaj NJ, Sokol SH, and Lennie P. (2007). A new code for contrast in the primate visual pathway. J. Neurosci. 27, 3904–3909.
14. Rockhill RL, Daly FJ, MacNeil MA, Brown SP, and Masland RH (2002). The Diversity of ganglion cells in a mammalian retina. J. Neurosci. 22, 3831–3843.
15. Badea TC, and Nathans J. (2004). Quantitative analysis of neuronal morphologies in the mouse retina visualized by using a genetically directed reporter. J. Comp. Neurol. 480, 331–351.
16. Kong JH, Fish DR, Rockhill RL, and Masland RH (2005). Diversity of ganglion cells in the mouse retina: Unsupervised morphological classification and its limits. J. Comp. Neurol. 489, 293–310.
17. Wassle H. (2004). Parallel processing in the mammalian retina. Nat. Rev. Neurosci. 5, 747–757.
18. Sinha P. (2002). Recognizing complex patterns. Nat. Neurosci. 5 Suppl, 1093–1097.
19. Levick WR, Oyster CW, and Takahashi E. (1969). Rabbit lateral geniculate nucleus: sharpener of directional information. Science 165, 712–714.
20. DeVries SH, and Baylor DA (1997). Mosaic arrangement of ganglion cell receptive fields in rabbit retina. J. Neurophysiol. 78, 2048–2060.
21. Roska B., and Werblin F. (2001). Vertical interactions across ten parallel, stacked representations in the mammalian retina. Nature 410, 583–587.
22. Zeck GM, Xiao Q., and Masland RH (2005). The spatial filtering properties of local edge detectors and brisk-sustained retinal ganglion cells. Eur. J. Neurosci. 22, 2016–2026.
23. van Wyk M., Taylor WR, and Vaney DI (2006). Local edge detectors: a substrate for fine spatial vision at low temporal frequencies in rabbit retina. J. Neurosci. 26, 13250–13263.
24. Masland RH (2001). Neuronal diversity in the retina. Curr. Opin. Neurobiol. 11, 431–436.
25. Dacey DM, Liao HW, Peterson BB, Robinson FR, Smith VC, Pokorny J., Yau KW, and Gamlin PD (2005). Melanopsinexpressing ganglion cells in primate retina signal colour and irradiance and project to the LGN. Nature 433, 749–754.
26. Simpson JI (1984). The accessory optic system. Ann. Rev. Neurosci. 7, 13–41.
27. Carandini M., Demb JB, Mante V., Tolhurst DJ, Dan Y., Olshausen BA, Gallant JL, and Rust NC (2005). Do we know what the early visual system does? J. Neurosci. 25, 10577–10597.
28. Olshausen BA, and Field DJ (2004). Sparse coding of sensory inputs. Curr. Opin Neurobiol. 14, 481–487.
29. Simoncelli EP, and Olshausen BA (2001). Natural image statistics and neural representation. Ann. Rev. Neurosci. 24, 1193–1216.
30. Olshausen BA, and Field DJ (2005). How close are we to understanding v1? Neural. Comput. 17, 1665–1699.
31. Ferster D., and Miller KD (2000). Neural mechanisms of orientation selectivity in the visual cortex. Ann. Rev. Neurosci. 23, 441–471.
32. Anderson JS, Lampl I., Gillespie DC, and Ferster D. (2001). Membrane potential and conductance changes underlying length tuning of cells in cat primary visual cortex. J. Neurosci. 21, 2104–2112.
33. Lund JS, and Yoshioka T. (1991). Local circuit neurons of macaque monkey striate cortex: III. Neurons of laminae 4B, 4A, and 3B. J. Comp. Neurol. 311, 234–258.
34. Cauli B., Audinat E., Lambolez B., Angulo MC, Ropert N., Tsuzuki K., Hestrin S., and Rossier J. (1997). Molecular and physiological diversity of cortical nonpyramidal cells. J. Neurosci. 17, 3894–3906.
35. Zipser K., Lamme VA, and Schiller PH (1996). Contextual modulation in primary visual cortex. J. Neurosci. 16, 7376-7389.
36. Gilbert CD, Sigman M., and Crist RE (2001). The neural basis of perceptual learning. Neuron 31, 681–697.
37. Douglas RJ, and Martin KA (2004). Neuronal circuits of the neocortex. Ann. Rev. Neurosci. 27, 419–451.
38. Troy JB, and Shou T. (2002). The receptive fields of cat retinal ganglion cells in physiological and pathological states: where we are after half a century of research. Prog. Ret. Eye Res. 21, 263–302.
39. Lennie P., and Movshon JA (2005). Coding of color and form in the geniculostriate visual pathway. J. Opt. Soc. Am. 22, 2013–2033.
40. Victor JD (2005). Analyzing receptive fields, classification images and functional images: challenges with opportunities for synergy. Nat. Neurosci. 8, 1651–1656.
41. Srinivasan MV, Jin ZF, Stange G., and Ibbotson MR (1993). 'Vector white noise': a technique for mapping the motion receptive fields of direction-selective visual neurons. Biol. Cybern. 68, 199–207.
42. Meister M., and Berry MJ (1999). The neural code of the retina. Neuron 22, 435–450.
43. Kara P., Reinagel P., and Reid RC (2000). Low response variability in simultaneously recorded retinal, thalamic, and cortical neurons. Neuron 27, 635–646.
44. Ringach DL, Hawken MJ, and Shapley R. (2002). Receptive field structure of neurons in monkey primary visual cortex revealed by stimulation with natural image sequences. J. Vision 2, 12–24.
45. Schwartz O., and Simoncelli EP (2001). Natural signal statistics and sensory gain control. Nat. Neurosci. 4, 819–825.
46. Horridge A. (2000). Seven experiments on pattern vision of the honeybee, with a model. Vision Res. 40, 2589-2603.
47. Srinivasan MV (2006). Honeybee vision: in good shape for shape recognition. Curr. Biol. 16, R58–60.
48. Marr D. (1982). Vision: A Computational Investigation in the Human Representation and Processing of Visual Information (New York: WH Freeman).
49. Barlow HB (1997). The knowledge used in vision and where it comes from. Phil.Trans. Roy. Soc. Lond. B 352, 1141–1147.
50. Riesenhuber M., and Poggio T. (2000). Models of object recognition. Nat. Neurosci. 3, 1199–1204.