当前,人类衰老被定义为体内生物功能的生理性下降,并不断适应内部和外部损害。 内分泌系统在细胞相互作用,新陈代谢,生长和衰老的组织中起着重要作用。 从蠕虫到误食的多项研究表明,抑制生长激素/胰岛素样生长因子-1 /胰岛素(GH / IGF-1 /胰岛素)途径的活性可能有助于延长人类寿命,而人类的结果却是矛盾的。 在这篇综述中,我们讨论了IGF-1系统在调节寿命方面的潜在作用,并假设在受卡路里限制的百岁老人和哺乳动物中观察到的内分泌和代谢适应可能是由于细胞生长缓慢而延长预期寿命的生理策略/代谢,更好地利用生理储备,使细胞代谢从细胞增殖转变为再生作用,并减少衰老细胞的积累。
进入。衰老被定义为体内生物功能的生理性下降,对内部和外部损害的适应性逐渐下降或丧失。 在人类中,衰老的表型是非常异质的,并且可以描述为复杂的镶嵌图,这是由于一些随机事件和环境事件,一生中积累的遗传和表观遗传变化相互作用而产生的。 尽管衰老具有巨大的复杂性,但其分子基础却受少数负责维持和恢复机体的高度进化保守的生物学机制所限制(1)。
在过去的30年中,老年病学中讨论最多的主题之一是生长激素(GH)/胰岛素样生长因子-1(IGF-1)/胰岛素系统在调节长寿中的作用。 积累的数据表明,该途径在许多与年龄有关的疾病的发病机理中起着重要作用,包括癌症,痴呆症,心血管疾病和代谢性疾病(2-4)。
在动物模型中,抑制GH / IGF-1 /胰岛素系统已显示可显着延长寿命。 但是,在人类中,数据是矛盾的(5、6)。
这篇综述描述了IGF-1系统和寿命调节的最新研究进展,假设在卡路里限制期间百岁老人和哺乳动物中观察到的内分泌和代谢适应可能是由于预期寿命延长而延长预期寿命的生理策略细胞生长/代谢,更好地控制信号传递和生理储备能力,并减少衰老细胞的积累。
IGF-1系统和动物模型的耐用性
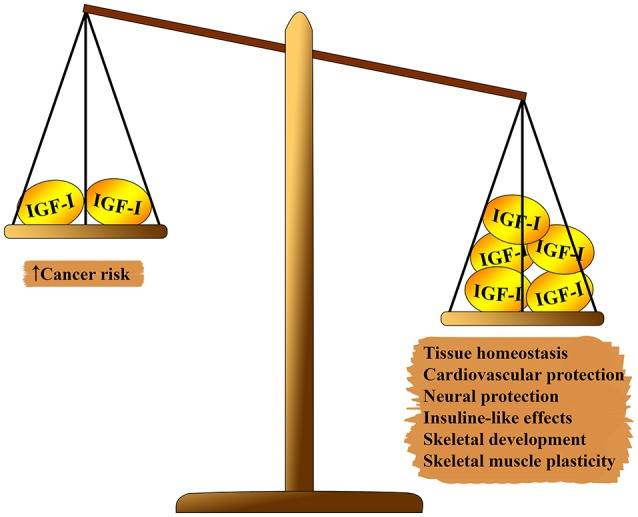 图1 IGF-1对人体的多效作用。 在体重秤的一侧,它的价值超过:组织动态平衡,心脏保护和神经保护作用,类胰岛素作用,参与骨骼形成和肌肉再生。 平衡的另一方面:致癌的风险。
图1 IGF-1对人体的多效作用。 在体重秤的一侧,它的价值超过:组织动态平衡,心脏保护和神经保护作用,类胰岛素作用,参与骨骼形成和肌肉再生。 平衡的另一方面:致癌的风险。IGF-1系统对生物衰老具有多种作用(见图1)。 IGF-1在胎儿发育,其在儿童和青少年时期的生长以及成人组织的稳态中起着重要作用。 此外,IGF-1显然具有抗动脉粥样硬化作用,神经保护作用和胰岛素样作用(高浓度),并调节骨代谢和肌肉再生。 但是,由于IGF-1具有很强的增殖活性,主要是由于细胞周期调节,细胞凋亡和细胞存活(7-9),因此它是几种类型肿瘤发展中的主要危险因素。 这些作用大多数是通过与胰岛素受体底物(IRS)-1和-2的相互作用以及PI3K / AKT /哺乳动物雷帕霉素靶途径(mTOR)的调节介导的(见图2)。
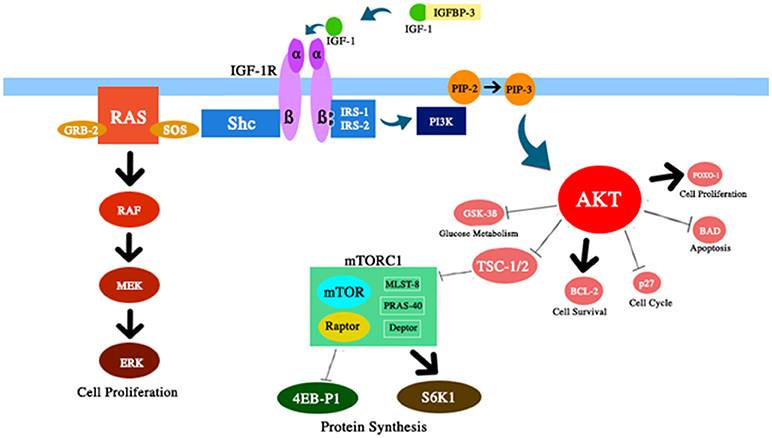 图2 本次讨论中讨论的IGF-1 / PI3K / AKT / mTOR路径的几个组成部分的示意图。 IGF-1增强AKT活性,并对细胞存活和增殖,葡萄糖代谢和蛋白质合成产生相应影响。
图2 本次讨论中讨论的IGF-1 / PI3K / AKT / mTOR路径的几个组成部分的示意图。 IGF-1增强AKT活性,并对细胞存活和增殖,葡萄糖代谢和蛋白质合成产生相应影响。
一些临床前研究报告说,控制GH / IGF-1 /胰岛素信号通路的基因突变可以显着增加无脊椎动物和脊椎动物模型的寿命(5、6)。
无脊椎动物模型。在无脊椎动物中,胰岛素/ IGF样级联受到几种能够与一种常见的胰岛素/ IGF-1样受体相互作用的肽的调控。
在线虫秀丽隐杆线虫中,胰岛素/ IGF样途径由daf-2,age-1基因(编码催化亚基PI3K),akt-1,akt-2,pdk-1,sgk-1(丝氨酸-苏氨酸激酶)编码的几种蛋白质组成),daf-16,skn-1和daf-18(PTEN,磷酸酶参与AKT信号通路的抑制)。 研究表明,daf-2,age-1,akt-1,akt-2,pdk-1,sgk-1基因的活性降低会抑制该途径,据报道,具有这些突变的动物的衰老速度更慢,寿命更长高达300%。 相反,刺激胰岛素/ IGF样途径会降低线虫的寿命(10、11)。
在果蝇果蝇中,胰岛素/ IGF样信号传导由dINR(胰岛素受体样蛋白/ IGF-1),CHICO胰岛素受体底物,PI3K Dp110 / p60和PK3 PI3K靶组成。 据报道,这些基因突变的果蝇可显着提高预期寿命(12、13)。
令人惊讶的是,不同组织中相同的分子机制不会以相同的方式影响衰老。 线虫和果蝇的几项研究表明,神经和脂肪组织中胰岛素/ IGF样信号的减少在调节寿命中起主要作用(14、15)。 尽管已经在无脊椎动物模型中显示出这种级联对于调节寿命很重要,但是在脊椎动物中,胰岛素/ IGF样信号传导对寿命的影响要复杂得多,因为它们具有功能特异性的胰岛素和IGF分子,IGF结合蛋白(IGFBP) ),IGFBP,GH蛋白酶,多种受体以及几种具有不同组织特异性表达的细胞内信号传递机制(16)。
脊椎动物模型设计了几种具有不同靶标的GH / IGF-1突变小鼠。 最新模型如下所述。
小鼠Snell和Ames。Snell和Ames小鼠是分别在PIT-1和PROP-1基因中具有突变的两种小鼠品系(17、18)。 由于PIT-1和PROP-1蛋白对于产生GH,催乳激素和甲状腺刺激激素的垂体细胞的分化都是必需的,因此两种纯合突变小鼠都缺乏这三种激素(18)。 这些模型显示出预期寿命的显着增加(比野生型小鼠高42–70%),胰岛素敏感性增加和较低的肿瘤发生频率(19、20)。 当Ames小鼠的卡路里受到限制时,它们的寿命会增加更多(21)。 尽管这些动物缺乏三种激素,但已显示出长寿的增加主要取决于GH的缺乏(22)。
点亮/点亮的鼠标点燃/点燃的小鼠患有GH缺乏症,并且其编码GH释放激素受体(GHRHR)的基因发生突变。 这些动物是矮人,脂肪组织增加,肿瘤发生率降低,预期寿命增加了23–25%(19)。
GH-释放激素敲除(GHRH-KO)鼠标。敲除小鼠的GH释放激素(GHRH-KO)的寿命比野生型动物长43%(雌性)和51%(雄性),并且具有Ames小鼠的许多表型特征,例如对Ames小鼠的敏感性增加胰岛素,血浆甘油三酸酯和胆固醇水平降低,脂肪组织增加,血浆瘦素和脂联素水平升高(23)。
GH受体敲除小鼠(GHR-KO)GH受体敲除小鼠(GHR-KO)的血清GH水平升高,而IGF-1水平非常低。 也有报道说,这种小鼠的寿命比野生型小鼠长38-55%(24),并显示出氧化应激的降低,以及致命性肿瘤的发生和延迟(25)。 在df / KO小鼠中,观察到了类似的结果,它们杂交了两股misha,即GHR-KO和Ames矮人,它们缺乏GH和GH受体,并继续增加了预期寿命(26)。 与野生的Ames兄弟姐妹和矮人小鼠不同,卡路里限制不会增加GHR-KO小鼠的寿命,这表明GH / IGF-1轴和卡路里限制可能具有相似或部分重叠的机制来延长寿命(27) 。
GH受体拮抗作用(GHA)并非所有抑制GH / IGF-1系统的动物模型都显示出预期寿命的增加。 小鼠的GHA品系就是这样的例子之一。 通过替换一个氨基酸产生的GHA能够以与GH相同的亲和力结合GH受体,但不会引起细胞内信号传导。 GHA小鼠的预期寿命没有明显增加(28)。
IGF-1R + /-/-小鼠尽管大多数具有失活的IGF-1受体(IGF-1R-/-)的小鼠在出生时死亡,但对IGF-1受体的突变等位基因(IGF-1R±)杂合的动物显示出非常低的血清IGF-1水平,女性的预期寿命缩短了10%,预期寿命延长了33%,男性约为16%。 但是,在这项研究中,野生型对照存活了19个月,这损害了对结果的解释(29)。 在另一条IGF-1R±品系中评估寿命的更近期研究表明,预期寿命略微增加了5-10%,但仅在女性中有所提高(30,31)。 另外,主要的背景应变似乎会影响几种小鼠模型的寿命延长程度(32)。
特定于大脑的IGF1-R +/-特定于大脑的IGF1-R +/-突变小鼠的寿命比野生型小鼠长9%,这强调了神经系统在调节寿命方面的相应作用(33)。
肝脏特异性IGF-1干扰小鼠(LI-IGF-1-/-)。由于IGF-1基因失活,IGF-1产生受损的小鼠(LI-IGF-1-/-)的血清IGF-1水平非常低,血清GH水平较高。 LI-IGF-1-/-小鼠的肥胖症明显减少,因此,其体重比野生型小鼠低25%。 与对照小鼠相比,只有雌性LI-IGF-1-/-小鼠的预期寿命增加了16%(34)。
帕帕-/-小鼠。Pappa小鼠具有与妊娠相关的血浆蛋白A,PAPP-A,PAPPA(IGF结合蛋白的特异性蛋白酶)的基因敲除。 与野生型对照相比,该小鼠品系的平均寿命延长了38%。 Pappa-/-小鼠是矮人,但它们的血清葡萄糖,胰岛素,IGF-1和GH水平与野生型对照无差异,这表明PAPPA主要作用于自分泌或旁分泌水平。 除了增加预期寿命外,Pappa-/-小鼠还显示出较低的肿瘤发生率,以及与年龄相关的退行性病变(35、36)。
IRS中断(IRS1-/-)鼠标。IRS-1和-2是胰岛素以及IGF-1信号传导的重要介体。 IRS1-/-小鼠具有胰岛素抵抗性,主要在肌肉组织中存在胰岛素信号传递缺陷,比野生型动物短约30%,只有雌性动物的寿命比野生型动物长18%(37 ) )
IRS2-/-小鼠也具有胰岛素抵抗性,但与IRS1-/-小鼠不同,它们在更多组织,包括肝脏,脂肪组织和骨骼肌中显示胰岛素信号缺陷。 这些小鼠患有糖尿病,并且其寿命比野生型小鼠和IRS2±小鼠的寿命短得多。 与野生型小鼠相比,IRS2 +/-小鼠具有更高的胰岛素敏感性和更长的预期寿命(+ 18%)。 此外,据报道,大脑特异性小鼠IRS2±和IRS2-/-具有胰岛素抵抗性,其寿命分别比野生型对照长18%和14%(38)。
KLOTHO修饰小鼠。KLOTHO蛋白可能通过破坏受体/配体相互作用来抑制胰岛素和IGF-1信号传导。 据报道,具有KLOTHO过表达的小鼠大小正常,雄性出现胰岛素抵抗,雄性和雌性寿命均显着增加(分别为+18和+30%)(39、40)。
P66shc中断的鼠标(P66shc-/-)。P66shc是一种蛋白,通过激活MAPK途径介导受体后的IGF-1信号传导。 P66shc-/-小鼠具有正常的表型,但比野生型对照组的寿命长28%(41)。 但是,这些数据在最近的研究中并未得到证实(42)。
GH / IGF-1 /胰岛素信号传导在衰老和长寿中的作用已在所有这些动物模型中进行了深入研究。 在无脊椎动物中,IGF-1 /胰岛素途径的抑制作用对预期寿命的影响是明显且显着的,在小鼠模型中,这种作用被削弱并且在某些情况下无法再现,例如在IGF-1R±和P66shc-/-品系中老鼠。 但是,这些模型中的大多数模型在长寿小鼠中表现出一些共同特征,例如循环IGF-1和胰岛素水平降低和胰岛素敏感性提高,这可能会降低癌症发病率,改善抗逆性并延长寿命。 。 可以破坏IGF-1系统的遗传变化可以使动物长期保持健康,并可以延缓或缓解某些与年龄有关的疾病。 在此过程中,神经和脂肪组织起重要作用。
此外,还需要其他数据来确定生命周期中的最佳时间点,以干预抑制IGF-1系统以获得对生命周期的积极影响。 在igf f / f C57Bl / 6小鼠中,从5个月或更早的年龄开始循环IGF-1缺乏,仅雌性动物的预期寿命增加了15%,与对照组相比,生命末期的病理器官数量减少了。 此外,晚期IGF-1缺乏(15个月)降低了患癌症的风险,但对预期寿命没有积极影响(43)。 这些数据强调了IGF-1缺乏对于早期增加寿命的重要性。 另一方面,毛等。 [44]最近报道,向18个月大的CB6F1小鼠晚期施用针对IGF-1受体的单克隆抗体可将女性预期寿命延长9%,并改善某些健康状况。
长寿人群中的IGF-1系统
百岁老人被认为是研究长寿生物学决定因素的最佳人类模型,这些因素已经达到了人类预期寿命的最极端值(45)。
几项研究将长肝中的循环胰岛素和IGF-1水平与年轻对照中的胰岛素进行了比较(46)。
代谢性年龄相关的重塑是整个人群中发生的生理过程。 衰老通常与葡萄糖耐量降低有关,这与胰岛素抵抗增加有关(47),但长寿的人是一个例外。 发现(48)在意大利南部,胰岛素抵抗随着年龄的增长而增加,而90岁以上的人群的胰岛素抵抗则下降。 确实,长寿的受试者比年轻的受试者表现出更高的胰岛素敏感性和更好的β细胞功能。 这种差异也不取决于主要的人体测量和代谢因素。 在100岁的患者中,2小时的血浆葡萄糖浓度低于老年人(平均年龄78岁)。 在长肝中,在正常血糖摄取过程中,胰岛素介导的葡萄糖消耗量高于老年对照组,这在这个长寿组中维持了糖耐量和胰岛素作用(49、50)。 在其他长肝人群中也观察到相似的结果,证实了对胰岛素的最佳敏感性(51、52)。
另外,长肝显示出胰岛素不仅对葡萄糖代谢,而且对脂肪组织的保存作用。 实际上,胰岛素输注通常与抑制脂解有关,因此与血浆中游离脂肪酸和甘油三酸酯的浓度显着降低有关。 在长肝中,脂解过程中胰岛素的抑制活性高于对照组(平均年龄78岁)(50)。 , , , , ( 53, 54).
IGF-1 ( 46 ). . ( 55 ) IGF-1 / IGFBP-3 . , IGF-1, . Bonafè et al. ( 56 ) , IGF-1 (G / A, 1013) IGF-1 . Arai et al. ( 57) IGF-1 . IGF-1, IGFBP-3 ( 58 ).
, , IGF . , . , , IGF-1 IGF-1. , : (1) (1 5-10 000 ), (2) - ( 95% 1 ), ( 3) ( 45, 59). - , .
, . , , ( 51, 60, 61) () ( 62 ). , , ( 60, 63). , , , , , «». . , , (, ) ( 60 ).
IGF-1 / .
IGF-1, (KIRA), , . IGF-1 . , IGF-1 ( 51 ).
Suh et al. ( 64 ) IGF-1 . IGF-1 35% , . IGF-1. , IGF-1 IGF-1 IGF-1 .
. 421 , , , . , ( ) ( 65 ). IGF-1 / IGFBP-3 ( 66 ). , IGF-1 IGFBP-3 ( 67). , 24- GH 28% ( 68 ).
, , , , , Long Life Family Study. , , ( 69 ). IGF-1 ( 70 ).
GH / IGF-1 / , . , , IGF-1 IGFBP-3 ( 71 ). , <60 , , / IGF-1, ( 72 ). , / IGF-1, ( 73). 3 (G3R) GH . d3 / d3 10 ( 74 ).
IGF-1
衰老生物学中最令人信服的观察之一是限制卡路里的能力,以预防或延缓某些与年龄有关的疾病,并增加哺乳动物的预期寿命(75-78)。 这种现象的生物学机制尚不完全清楚,但是有人提出了能量代谢,内分泌系统和氧化损伤的相应变化的潜在参与。
热量限制会引起许多激素变化。 在啮齿动物中,没有饥饿的热量限制会与限制水平成比例地抑制IGF-1和胰岛素的循环水平,增加胰岛素敏感性以及对压力和毒性的抵抗力,并降低患癌的风险(79、80)。 有趣的是,如前所述,在热量限制期间在野生型小鼠中观察到的大多数这些特征类似于由于GH / IGF-1 /胰岛素信号传导的遗传损伤而在长寿小鼠中报告的特征。
在人体中进行的随机临床试验表明,除非降低蛋白质摄入量,否则热量限制不会降低血清IGF-1(81、82)。 但是,最近的一项荟萃分析评估了营养限制对公认的健康衰老生物标志物的作用,结果表明血液中人IGF-1水平降低了(83)。
在饮食限制期间,还观察到其他激素变化,例如胰岛素水平,甲状腺激素和瘦素水平的降低,以及脂联素和胰岛素敏感性的提高(85、86)。
这种激素适应可以通过以下几种机制在延长生命中发挥重要作用:
1)降低代谢率,细胞增殖和氧化应激。 实际上,IGF-1是有效的生长因子,而甲状腺激素是基本代谢率和氧化代谢的有效刺激剂。 此外,转录模式表明,成年人长期适度的卡路里限制会减缓衰老过程,将细胞代谢从生长转变为维持和恢复(84)。
2)减少衰老细胞的积累。 细胞衰老已被证明是衰老的关键介质(87)。 随着时间的流逝,蛋白质体内平衡会下降,损伤会不断累积。 有趣的是,一些衰老相关的疾病可以通过削弱衰老细胞的积累来延缓(88、89)。 通常,mTOR途径被多种信号激活,包括营养素,IGF-1和胰岛素(图2)。 据报道,热量限制后,这种途径的失控延长了某些生物的寿命。 显然,这种作用是继自噬(一种细胞保护性消化过程)增加之后产生的。 实际上,自噬是一种细胞加工过程,可以去除陈旧或受损的细胞成分,从而防止衰老细胞的积聚(90、91)。
3)抵抗炎症。 对动物和人类的饮食干预都可以减缓衰老过程,弱化其炎症状态(83,92)。 营养限制的抗炎活性的机制尚不清楚。 可以认为,这种作用是由于脂肪量和促炎性脂肪因子的减少,以及在饮食干预期间观察到的肠屏障完整性的改善(93、94)。
有趣的是,在热量限制期间在受试者体内观察到的内分泌生物化学特征与百岁老人的内分泌生物化学特征相当,这证实了内分泌系统在调节预期寿命中的潜在作用。 除了增加胰岛素敏感性和降低血浆/血清IGF-1水平外,一些研究还显示,与年轻受试者相比,长寿人群中循环脂联素水平升高,循环瘦素和甲状腺激素水平降低。
脂肪组织是内分泌器官,其产生参与相关过程的几种细胞因子,例如能量代谢,脂质和葡萄糖体内稳态以及炎症反应的调节。 内脏脂肪组织在代谢性疾病的发展中起主要作用(95)。 衰老与脂肪量增加和脂肪组织的重新分布有关,其特征在于周围皮下脂肪的损失和内脏脂肪的积累。 在老年人中,已经描述了脂肪因子分泌,合成和功能的变化,这可能是由于脂肪细胞的功能,增殖,大小和数量的不平衡所致(86)。 脂联素是一种胰岛素敏感,抗炎和抗动脉粥样硬化的细胞因子。 脂联素以几种形式在血液中循环:三聚体,六聚体,高分子量多聚体(HMW)和球状脂联素(蛋白水解切割的形式)。 据信,多聚体HMW是脂联素的一种更有效的形式,可预防胰岛素抵抗和糖尿病(96)。 循环脂联素与代谢综合征的各个方面独立且负相关,包括胰岛素抵抗,体重,血压和血脂。 瘦素主要在皮下产生,在内脏白色脂肪组织中产生的程度较小。 该细胞因子调节食物摄入,能量消耗和动脉粥样硬化。 瘦素通过降低食欲和刺激新陈代谢促进体重减轻,并具有促炎特性(97)。
几项研究报告说,长肝脏比年轻对照组的血浆脂联素水平更高,瘦素浓度更低(53、98-102)。 所有形式的脂联素在长肝中均显着增加,但多聚体HMW显着更高(99)。 在长肝中,高脂联素浓度与BMI,肾或心血管功能无关,并且与良好的代谢表型有关(高水平的HDL-C,较低的糖化血红蛋白,胰岛素,HOMA-IR和甘油三酸酯)(98,99)。 在长寿受试者(95岁以上)的后代中也发现脂联素水平升高(103)。
甲状腺激素水平的降低显然是长肝脏的特征。 Mariotti等。 (104)报道健康的百岁老人与其他对照组相比,血清TSH和FT3水平较低,血清rT3水平较高。 在另一名意大利长肝人群中,有60%的被调查者的总T4值低于正常范围(105)。 Baranovskaya等。 报告指出,百岁老人的血清T3水平低于早期的老年妇女和年轻妇女(52)。 我们最近在672名意大利患者(52-113岁)中表征了甲状腺功能。 注意到与年龄相关的FT3水平和FT3 / FT4比值下降,而FT4和TSH随着年龄增长而增加(106)。 在中国百岁老人的家庭中,甲状腺功能的下降(高TSH和低FT3浓度)似乎与年龄有关,并且这种表型是遗传性的(107)。
Corsonello等。 (108)发现相伴的亲戚(后代或侄女/侄子)的疾病,FT3,FT4和TSH水平低于年龄匹配的对照,而不是长肝的亲戚。 在另一个意大利人口中,与相同年龄的对照组相比,长肝后代的血浆FT4水平较低(60岁)。
通常,长肝很瘦(109)并遵守健康的饮食习惯(110)。 与受热限制期间的受试者相似,长肝脏观察到细胞生长/代谢变慢,信号传递控制得更好和自噬增加。 通过对百岁老人及其后代整个基因组中DNA甲基化的分析,我们确定了表观遗传调控的基因和可能与衰老和长寿有关的途径。 我们的结果表明,这些种群的特征是更好地保留了DNA甲基化状态,减慢了细胞的生长/代谢,并通过表观遗传机制更好地控制了信号传递(111)。 由于线粒体肥大,长肝保留了其生物能功能,可以弥补功能缺陷(112)。 此外,健康的长肝具有较高的自噬水平,与年轻的心肌梗死患者和健康对照相比,血清beclin-1水平较高证明了这一点(113)。 在长寿家庭中,自噬活动也有所增加(114)。
相应的现象与发炎状态有关,发炎状态受卡路里限制后会减弱(115、116),长肝脏发炎率很高(117-119)。 随着年龄的增长,处于轻度和慢性炎症病理状态(与年龄有关的炎症),并且许多疾病的患病率增加,例如心血管疾病,动脉粥样硬化,肿瘤,认知障碍,骨关节炎和糖尿病(120、121)。 因此,限制卡路里后慢性炎症状态的减弱是有益的作用。 百年纪念百岁老人有发炎的迹象,但似乎同时也避免了其有害作用。 这种明显的悖论可以用以下事实来解释:长肝在促炎和抗炎因子之间具有复杂而特殊的平衡,与老年人相比,其导致缓慢,有限和平衡的炎症发展,老年人的特征是对慢性炎症的反应无效(120) (121)。
这些数据表明,在限制卡路里的饮食中,长寿肝脏和哺乳动物发现长寿和延缓年龄相关疾病的一般机制。
作者的意见。临床前模型使用一致的数据提供了对衰老过程的更深入了解,该数据考虑了GH / IGF-1 /胰岛素系统在调节预期寿命中的作用。 尽管众所周知,胰岛素敏感性的提高和胰岛素水平的降低与存活率的提高有关,但有证据表明,GH / IGF-1轴的减弱可对延长人类的预期寿命产生有益的影响。 然而,仍然未知寿命更长,更健康的IGF-1的最佳水平是多少。 此外,在涉及长寿受试者的大多数研究中,尚未评估IGF-1受体敏感性和受体后途径的激活。 因此,不可能通过简单剂量的循环IGF-1水平来确定IGF-1受体信号传导激活的实际状态。 这使得很难确定针对该系统的药理或环境策略以延长预期寿命并促进健康的衰老。 对这些方面的全面理解仍然是确定旨在减缓人类衰老的干预措施以及用于康复医学的主要问题。 未来的研究应评估IGF-1受体信号转导的功能状态,包括通过转录概况分析和有关长寿受试者中IGF-1调控基因的功能网络分析。
结论关于限制饮食后长肝脏和受试者之间的内分泌特征,已经描述了惊人的相似性。 在这两个模型中观察到的内分泌和代谢适应性可能是增加寿命的生理策略,这是由于细胞生长/代谢变慢,自然生理储备的丧失较慢,细胞代谢从细胞增殖到再生活动的过渡以及减少衰老细胞的积累。 显然,这些机制至少部分是由GH / IGF-1 /胰岛素系统的调节介导的。
参考文献- Franceschi C,Valensin S,Bonafe M,Paolisso G,Yashin AI,Monti D等。网络与衰老的重塑理论:历史背景和新观点。 Exp Gerontol。 (2000)35:879-96。 10.1016 / S0531-5565(00)00172-8。
- Bartke A,Darcy J. GH和老龄化:陷阱和新见解。 最佳实践临床内分泌代谢物。 (2017)31:113–25。 10.1016 / j.beem.2017.02.005
- Vitale G,Salvioli S,Franceschi C.氧化应激和老化的内分泌系统。 Nat Rev Endocrinol。 (2013)9:228–40。 10.1038 / nrendo.2013.29
- Vitale G,Cesari M,Mari D.内分泌系统的老化及其对肌肉减少症的潜在影响。 Eur J Intern Med。 (2016)35:10-15。 10.1016 / j.ejim.2016.07.017
- 柴板JT的Reddy SSK。 衰老的内分泌学:长寿的关键“伟大的期望”。 内科实践。 (2017)23:1107-16。 10.4158 / EP171793.RA
- Junnila RK,List EO,Berryman DE,Murrey JW,Kopchick JJ。 GH / IGF-1轴在衰老和长寿。 Nat Rev Endocrinol。 (2013)9:366-76。 10.1038 /任天堂.2013.67
- Yakar S,Adamo ML。 胰岛素样生长因子1生理学:小鼠模型的教训。 Endocrinol Metab临床北部。 (2012)41:231-47。 10.1016 / j.ecl.2012.04.008 [PMC免费文章] [PubMed] [CrossRef] [Google Scholar]
- Higashi Y,Sukhanov S,Anwar A,Shai SY,Delafontaine P.IGF-1,氧化应激和动脉粥样硬化防护。 趋势内分泌代谢。 (2010)21:245-54。 10.1016 / j.tem.2009.12.005 [PMC免费文章] [PubMed] [CrossRef] [Google Scholar]
- Belfiore A,Malaguarnera R,Vella V,Lawrence MC,Sciacca L,Frasca F等人。生理和疾病中的胰岛素受体亚型:更新的观点。 Endocr版本 (2017)38:379-431。 10.1210 / er.2017-00073 [PMC免费文章] [PubMed] [CrossRef] [Google Scholar]
- Kenyon C,Chang J,Gensch E,Rudner A,Tabtiang RAC ... elegans突变体的寿命是野生型的两倍。 自然(1993)366:461-4。 10.1038 / 366461a0 [PubMed] [CrossRef] [Google Scholar]
- Kimura KD,Tissenbaum HA,Liu Y,Ruvkun G.Daf-2是一种胰岛素受体样基因,可调节秀丽隐杆线虫的寿命和滞育。 科学(1997)277:942-6。 10.1126 / science.277.5328.942 [PubMed] [CrossRef] [Google Scholar]
- Tatar M,Kopelman A,Epstein D,Tu MP,Yin CM,Garafalo RS等。突变果蝇胰岛素受体同源物,可延长寿命并损害神经内分泌功能。 科学(2001)292:107-10。 10.1126 / science.1057987 [考研] [CrossRef] [Google学术搜索]
- Clancy DJ,Gems D,Harshman LG,Oldham S,Stocker H,Hafen E等人。通过失去果蝇胰岛素受体底物蛋白CHICO延长寿命。 科学(2001)292:104-6。 10.1126 / science.1057991 [PubMed] [CrossRef] [Google Scholar]
- Libina N,Berman JR,Kenyon C.秀丽隐杆线虫DAF-16在寿命调节中的组织特异性活性。 Cell(2003)115:489-502。 10.1016 / S0092-8674(03)00889-4 [PubMed] [CrossRef] [Google Scholar]
- Broughton S,Part L.胰岛素/ IGF样信号,中枢神经系统和衰老。 生物化学杂志(2009)418:1-12。 10.1042 / BJ20082102 [PubMed] [CrossRef] [Google Scholar]
- Reindl KM,马萨诸塞州谢里登。 鱼类和其他脊椎动物中生长激素-胰岛素样生长因子系统的外围调节。 Comp Biochem Physiol A摩尔积分生理学。 (2012)163:231–45。 10.1016 / j.cbpa.2012 / 08 / 08.003 [PubMed] [CrossRef] [Google Scholar]
- Snell GD。 矮人,家鼠的新孟德尔隐性特征。 Proc Natl Acad Sci美国。 (1929)15:733-4。 10.1073 / pnas.15.9.733 [PMC免费文章] [PubMed] [CrossRef] [Google Scholar]
- Berryman D,Christiansen JS,Johannsson G,Thorner MO,Kopchick JJ。 GH / IGF-1轴在寿命和健康中的作用:动物模型的经验教训。 生长激素IGF Res。 (2008)18:455-71。 10.1016 / j.ghir.2008.05.005 [PMC免费文章] [PubMed] [CrossRef] [Google Scholar]
- Flurkey K,Papaconstantinou J,Miller RA,Harrison DE。 具有生长激素产生缺陷的突变小鼠的寿命延长,免疫和胶原衰老延迟。 Proc Natl Acad Sci美国。 (2001)98:6736-41。 10.1073 / pnas.111158898 [PMC免费文章] [PubMed] [CrossRef] [Google Scholar]
- 布朗博格HM,博格KE,梅里斯卡CJ,巴特克A.矮小鼠和衰老过程。 自然(1996)384:33。 10.1038 / 384033a0 [PubMed] [CrossRef] [Google Scholar]
- Bartke A,Wright JC,Mattison JA,Ingram DK,Miller RA和Roth GS。 延长长寿命小鼠的寿命。 自然(2001)414:412。 10.1038 / 35106646 [考研] [CrossRef] [Google学术搜索]
- Panici JA,Harper JM,Miller RA,Bartke A,Spong A,Masternak MM。 早期生命生长激素治疗可缩短寿命长的突变小鼠的寿命并降低其抗细胞应激能力。 FASEB J.(2010)24:5073–9。 10.1096 / fj.10-163253 [PMC免费文章] [PubMed] [CrossRef] [Google Scholar]
- Sun LY,Spong A,Swindell WR,Fang Y,Hill C,Huber JA等。生长激素释放激素的破坏延长了寿命,并调节了小鼠对热量限制的反应。 Elife(2013)2:e01098。 10.7554 / eLife.01098 [PMC免费文章] [PubMed] [CrossRef] [Google Scholar]
- Coschigano KT,Clemmons D,Bellush LL,Kopchick JJ。 评估GHR / BP基因破坏小鼠的生长参数和寿命。 内分泌学(2000)141:2608-13。 10.1210 / endo.141.7.7586 [PubMed] [CrossRef] [Google Scholar]
- Ikeno Y,Hubbard GB,Lee S,Cortez LA,Lew CM,Webb CR等人。生长激素受体/结合蛋白敲除小鼠中致命性肿瘤疾病的发生率降低和延迟发生。 J Gerontol生物科学与生物学。 (2009)64:522–9。 10.1093 / gerona / glp017 [PMC免费文章] [PubMed] [CrossRef] [Google Scholar]
- Gesing A,Wiesenborn D,Do A,Menon V,Schneider A,Victoria B等。缺少生长激素和生长激素受体的长寿小鼠:一种用于衰老研究的新动物模型。 J Gerontol生物科学与生物学。 (2017)72:1054-61。 10.1093 / gerona / glw193 [PMC免费文章] [PubMed] [CrossRef] [Google Scholar]
- Bonkowski女士,Rocha JS,Masternak MM,Al Regaiey KA,BartkeA。靶向破坏生长激素受体会干扰卡路里限制的有益作用。 Proc Natl Acad Sci美国。 (2006)103:7901-5。 10.1073 / pnas.0600161103 [PMC免费文章] [PubMed] [CrossRef] [Google Scholar]
- Coschigano KT,Holland AN,Riders ME,List EO,Flyvbjerg A,Kopchick JJ。 小鼠生长激素受体的缺失(而非拮抗作用)可导致体重,胰岛素和类胰岛素生长因子I水平大大降低,并延长寿命。 内分泌学(2003)144:3799-810。 10.1210 / en.2003-0374 [PubMed] [CrossRef] [Google Scholar]
- Holzenberger M,Dupont J,Ducos B,Leneuve P,GéloënA,Even PC等。IGF-1受体调节小鼠的寿命和抗氧化性。 自然(2003)421:182-7。 10.1038 / nature01298 [考研] [CrossRef] [Google学术搜索]
- Bokov AF,Garg N,Ikeno Y,Thakur S,Musi N,DeFronzo RA等。Igf1r +/-小鼠中IGF-1R信号的降低是否会改变衰老? Plos ONE(2011)6:e26891。 10.1371 / journal.pone.0026891 [PMC免费文章] [PubMed] [CrossRef] [Google Scholar]
- Xu J,Gontier G,Chaker Z,Lacube P,Dupont J,Holzenberger M.IGF-1R +/-突变的长寿效应取决于遗传背景特异性受体的激活。 老化细胞(2014)13:19-28。 10.1111 / acel.12145 [PMC免费文章] [PubMed] [CrossRef] [Google Scholar]
- 穆维L,辛克莱A,塞尔曼C.小鼠的寿命调节和遗传背景的混杂影响。 J Genet Genomics(2014)41:497-503。 10.1016 / j.jgg.2014.06.002 [PMC免费文章] [PubMed] [CrossRef] [Google Scholar]
- Kappeler L,De Magalhaes Filho C,Dupont J,Leneuve P,Cervera P,PérinL等。大脑IGF-1受体通过神经内分泌机制控制哺乳动物的生长和寿命。 PLOS生物学。 (2008)6:e254。 10.1371 / journal.pbio.0060254tt [PMC免费文章] [PubMed] [CrossRef] [Google Scholar]
- Svensson J,SjögrenK,FäldtJ,Andersson N,Isaksson O,Jansson JO等。 肝脏衍生的IGF-1调节小鼠的平均寿命。 PLoS ONE(2011)6:e22640 10.1371 / journal.pone.0022640 [PMC免费文章] [PubMed] [CrossRef] [Google Scholar]
- Conover CA, Bale LK. Loss of pregnancy-associated plasma protein A extends lifespan in mice. Aging Cell (2007) 6:727–9. 10.1111/j.1474-9726.2007.00328.x [PubMed] [CrossRef] [Google Scholar]
- Conover CA. Role of PAPP-A in aging and age-related disease. Exp Gerontol. (2013) 48:612–3. 10.1016/j.exger.2012.06.017 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Selman C, Lingard S, Choudhury AI, Batterham RL, Claret M, Clements M, et al.. Evidence for lifespan extension and delayed age-related biomarkers in insulin receptor substrate 1 null mice. FASEB J. (2008) 22:807–18. 10.1096/fj.07-9261com [PubMed] [CrossRef] [Google Scholar]
- Taguchi A, Wartschow LM, White MF. Brain IRS2 signaling coordinates life span and nutrient homeostasis. Science (2000) 317:369–72. 10.1126/science.1142179 [PubMed] [CrossRef] [Google Scholar]
- Kuro M, Matsumura Y, Aizawa H, Kawaguchi H, Suga T, Utsugu T, et al. Mutation of the mouse Klotho gene leads to a syndrome resembling ageing. Nature (1997) 390:45–51. 10.1038/36285 [PubMed] [CrossRef] [Google Scholar]
- Kurosu H, Yamamoto M, Clark JD, Pastor JV, Nandi A, Gurnani P, et al.. Suppression of aging in mice by the hormone Klotho. Science (2005) 309:1829–33. 10.1126/science.1112766 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Migliaccio E, Giorgio M, Mele S, Pelicci G, Reboldi P, Pandolfi PP, et al. The p66 Shc adaptor protein controls oxidative stress response and life span in mammals. Nature (1999) 402:309–13. 10.1038/46311 [PubMed] [CrossRef] [Google Scholar]
- Ramsey JJ, Tran D, Giorgio M, Griffey SM, Koehne A, Laing ST, et al.. The influence of Shc proteins on life span in mice. J Gerontol A Biol Sci Med Sci. (2014) 69:1177–85. 10.1093/gerona/glt198 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ashpole NM, Logan S, Yabluchanskiy A, Mitschelen MC, Yan H, Farley JA, et al.. IGF-1 has sexually dimorphic, pleiotropic, and time-dependent effects on healthspan, pathology, and lifespan. Geroscience (2017) 39:129–45. 10.1007/s11357-017-9971-0 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mao K, Quipildor GF, Tabrizian T, Novaj A, Guan F, Walters RO, et al.. Late-life targeting of the IGF-1 receptor improves healthspan and lifespan in female mice. Nat Commun. (2018) 9:2394. 10.1038/s41467-018-04805-5 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Passarino G, Mari D, Monti D. Centenarians as a 21st century healthy aging model: a legacy of humanity and the need for a world-wide consortium (WWC100+). Mech Ageing Dev. (2017) 165(Pt. B):55–8. 10.1016/j.mad.2017.06.002 [PubMed] [CrossRef] [Google Scholar]
- Vitale G, Barbieri M, Kamenetskaya M, Paolisso G. GH/IGF-I/insulin system in centenarians. Mech Ageing Dev. (2017) 165:107–114. 10.1016/j.mad.2016.12.001 [PubMed] [CrossRef] [Google Scholar]
- Ferrannini E, Vichi S, Beck-Nielsen H, Laasko M, Paolisso G, Smith U. For European Group for the Study of Insulin Resistance (EGIR). Insulin action and age. Diabetes (1996) 45:947–53. 10.2337/diab.45.7.947 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Barbieri M, Rizzo MR, Carella C, Rotondi M, Bonafè M, et al. Low insulin resistance and preserved beta-cell function contribute to human longevity but are not associated with TH-INS genes. Exp Gerontol. (2001) 37:149–56. 10.1016/S0531-5565(01)00148-6 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Gambardella A, Ammendola S, D'Amore A, Balbi V, Varricchio M, et al.. Glucose tolerance and insulin action in healty centenarians. Am J Physiol. (1996) 270:E890–4. 10.1152/ajpendo.1996.270.5.E890 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Gambardella A, Ammendola S, Tagliamonte MR, Rizzo MR, Capurso A, et al.. Preserved antilipolytic insulin action is associated with a less atherogenic plasma lipid profile in healthy centenarians. J Am Geriatr Soc. (1997) 45:1504–9. 10.1111/j.1532-5415.1997.tb03203.x [PubMed] [CrossRef] [Google Scholar]
- Vitale G, Brugts M, Ogliari G, Castaldi D, Fatti L, Varewijck A, et al.. Low circulating IGF-I bioactivity is associated with human longevity: findings in centenarians' offspring. Aging (2012) 4:580–89. 10.18632/aging.100484 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Baranowska B, Wolinska-Witort E, Bik W, Baranowska-Bik A, Martynska L, Broczek K, et al.. Evaluation of neuroendocrine status in longevity. Neurobiol Aging (2007) 28:774–83. 10.1016/j.neurobiolaging.2006.03.014 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Manzella D, Barbieri M, Rizzo MR, Gambardella A, Varricchio M. Baseline heart rate variability in healthy centenarians: differences vs. aged subject. Clin. 科学 (1999) 97:579–84. 10.1042/cs0970579 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Tagliamonte MR, Rizzo MR, Carella C, Gambardella A, Barbieri M, et al. Low plasma Insulin like growth factor-1 concentrations predict worsening of insulin mediated glucose uptake in the elderly. J. Am. Geriatr. Soc。 (1999) 47:1312–8. 10.1111/j.1532-5415.1999.tb07431.x [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Ammendola S, Del Buono A, Gambardella A, Riondino M, Tagliamonte MR, et al.. Serum levels of insulin-like growth factor-I (IGF-I) and IGF-binding protein-3 in healthy centenarians: relationship with plasma leptin and lipid concentrations, insulin action, and cognitive function. J Clin Endocrinol Metab. (1997) 82:2204–9. 10.1210/jcem.82.7.4087 [PubMed] [CrossRef] [Google Scholar]
- Bonafè M, Barbieri M, Marchegiani F, Olivieri F, Ragno E, Giampieri C, et al.. Polymorphic variants of insulin-like growth factor I (IGF-I) receptor and phosphoinositide 3-kinase genes affect IGF-I plasma levels and human longevity: cues for an evolutionarily conserved mechanism of life span control. J Clin Endocrinol Metab. (2003) 88:3299–304. 10.1210/jc.2002-021810 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Hirose N, Yamamura K, Shimizu K, Takayama M, Ebihara Y, et al.. Serum insulin-like growth factor-1 in centenarians: implications of IGF-1 as a rapid turnover protein. J Gerontol A Biol Sci Med Sci. (2001) 56:M79–82. 10.1093/gerona/56.2.M79 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Takayama M, Gondo Y, Inagaki H, Yamamura K, Nakazawa S, et al.. Adipose endocrine function, insulin-like growth factor-1 axis, and exceptional survival beyond 100 years of age. J Gerontol A Biol Sci Med Sci. (2008) 63:1209–18. 10.1093/gerona/63.11.1209 [PubMed] [CrossRef] [Google Scholar]
- Herr M, Jeune B, Fors S, Andersen-Ranberg K, Ankri J, Arai Y, et al.. Frailty and associated factors among centenarians in the 5-COOP countries. Gerontology (2018) 64:521–31. 10.1159/000489955 [PubMed] [CrossRef] [Google Scholar]
- Bucci L, Ostan R, Cevenini E, Pini E, Scurti M, Vitale G, et al.. Centenarians' offspring as a model of healthy aging: a reappraisal of the data on Italian subjects and a comprehensive overview. Aging (Albany. NY). (2016) 8:1–11. 10.18632/aging.100912 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Gueresi P, Miglio R, Monti D, Mari D, Sansoni P, Caruso C, et al.. Does the longevity of one or both parents influence the health status of their offspring? Exp Gerontol. (2013) 48:395–400. 10.1016/j.exger.2013.02.004 [PubMed] [CrossRef] [Google Scholar]
- Horvath S, Pirazzini C, Bacalini MG, Gentilini D, Di Blasio AM, Delledonne M, et al.. Decreased epigenetic age of PBMCs from Italian semi-supercentenarians and their offspring. Aging (2015) 7:1159–70. 10.18632/aging.100861 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Caselli G, Pozzi L, Vaupel JW, Deiana L, Pes G, Carru C, et al.. Family clustering in Sardinian longevity: a genealogical approach. Exp Gerontol. (2006) 41:727–36. 10.1016/j.exger.2006.05.009 [PubMed] [CrossRef] [Google Scholar]
- Suh Y, Atzmon G, Cho MO, Hwang D, Liu B, Leahy DJ, et al.. Functionally significant insulin-like growth factor I receptor mutations in centenarians. Proc Natl Acad Sci USA. (2008) 105:3438–42. 10.1073/pnas.0705467105 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Deelen J, van den Akker EB, Trompet S, van Heemst D, Mooijaart SP, Slagboom PE, Beekman M. Employing biomarkers of healthy ageing for leveraging genetic studies into human longevity. Exp Gerontol. (2016) 82:166–74. 10.1016/j.exger.2016.06.013 [PubMed] [CrossRef] [Google Scholar]
- van der Spoel E, Rozing MP, Houwing-Duistermaat JJ, Slagboom PE, Beekman M, de Craen AJ, et al.. Association analysis of insulin-like growth factor-1 axis parameters with survival and functional status in nonagenarians of the Leiden Longevity Study. Aging (2015) 7:956–63. 10.18632/aging.100841 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Rozing MP, Westendorp RG, Frölich M, de Craen AJ, Beekman M, Heijmans BT, et al.. Human insulin/IGF-1 and familial longevity at middle age. Aging (2009) 1:714–22. 10.18632/aging.100071 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- van der Spoel E, Jansen SW, Akintola AA, Ballieux BE, Cobbaert CM, Slagboom PE, et al.. Growth hormone secretion is diminished and tightly controlled in humans enriched for familial longevity. Aging Cell (2016) 15:1126–31. 10.1111/acel.12519 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sebastiani P, Sun FX, Andersen SL, Lee JH, Wojczynski MK, Sanders JL, et al.. Families enriched for exceptional longevity also have increased health-span: findings from the long life family study. Front Public Health (2013) 1:38. 10.3389/fpubh.2013.00038 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sebastiani P, Thyagarajan B, Sun F, Honig LS, Schupf N, Cosentino S, et al.. Age and sex distributions of age-related biomarker values in healthy older adults from the long life family study. J Am Geriatr Soc. (2016) 64:e189–94. 10.1111/jgs.14522 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Teumer A, Qi Q, Nethander M, Aschard H, Bandinelli S, Beekman M, et al.. Genomewide meta-analysis identifies loci associated with IGF-I and IGFBP-3 levels with impact on age-related traits. Aging Cell (2016) 15:811–24. 10.1111/acel.12490 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Deelen J, Uh HW, Monajemi R, van Heemst D, Thijssen PE, Böhringer S, et al.. Gene set analysis of GWAS data for human longevity highlights the relevance of the insulin/IGF-1 signaling and telomere maintenance pathways. Age (2013) 35:235–49. 10.1007/s11357-011-9340-3 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- van Heemst D, Beekman M, Mooijaart SP, Heijmans BT, Brandt BW, Zwaan BJ, et al.. Reduced insulin/IGF-1 signalling and human longevity. Aging Cell (2005) 4:79–85. 10.1111/j.1474-9728.2005.00148.x [PubMed] [CrossRef] [Google Scholar]
- Ben-Avraham D, Govindaraju DR, Budagov T, Fradin D, Durda P, Liu B, et al.. The GH receptor exon 3 deletion is a marker of male-specific exceptional longevity associated with increased GH sensitivity and taller stature. Sci Adv. (2017) 3:e1602025. 10.1126/sciadv.1602025 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- McKiernan SH, Colman RJ, Lopez M, Beasley TM, Aiken JM, Anderson RM, et al.. Caloric restriction delays aging-induced cellular phenotypes in rhesus monkey skeletal muscle. Exp Gerontol. (2011) 46:23–9. 10.1016/j.exger.2010.09.011 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Colman RJ, Anderson RM, Johnson SC, Kastman EK, Kosmatka KJ, Beasley TM, et al. Calorie restriction delays disease onset and mortality in rhesus monkeys. Science (2009) 325:201–4. 10.1126/science.1173635 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Willcox DC, Willcox BJ, Todoriki H, Curb JD, Suzuki M. Caloric restriction and human longevity: what can we learn from the Okinawans? Biogerontology (2006) 7:173–7. 10.1007/s10522-006-9008-z [PubMed] [CrossRef] [Google Scholar]
- Mattison JA, Roth GS, Beasley TM, Tilmont EM, Handy AM, Herbert RL, et al.. Impact of caloric restriction on health and survival in rhesus monkeys from the NIA study. Nature (2012) 489:318–21. 10.1038/nature11432 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Dunn SE, Kari FW, French J, Leininger JR, Travlos G, Wilson R, et al.. Dietary restriction reduces insulin-like growth factor I levels, which modulates apoptosis, cell proliferation, and tumor progression in p53-deficient mice. Cancer Res. (1997) 57:4667–72. [PubMed] [Google Scholar]
- Berrigan D, Perkins SN, Haines DC, Hursting SD. Adult-onset calorie restriction and fasting delay spontaneous tumorigenesis in p53-deficient mice. Carcinogenesis (2002) 23:817–22. 10.1093/carcin/23.5.817 [PubMed] [CrossRef] [Google Scholar]
- Redman LM, Veldhuis JD, Rood J, Smith SR, Williamson D, Ravussin E, et al.. The effect of caloric restriction interventions on growth hormone secretion in nonobese men and women. Aging Cell (2010) 9:32–9. 10.1111/j.1474-9726.2009.00530.x [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Fontana L, Villareal DT, Das SK, Smith SR, Meydani SN, Pittas AG, et al.. Effects of 2-year calorie restriction on circulating levels of IGF-1, IGF-binding proteins and cortisol in nonobese men and women: a randomized clinical trial. Aging Cell (2016) 15:22–7. 10.1111/acel.12400 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Lettieri-Barbato D, Giovannetti E, Aquilano K. Effects of dietary restriction on adipose mass and biomarkers of healthy aging in human. Aging (2016) 8:3341–55. 10.18632/aging.101122 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mercken EM, Crosby SD, Lamming DW, JeBailey L, Krzysik-Walker S, Villareal DT, et al.. Calorie restriction in humans inhibits the PI3K/AKT pathway and induces a younger transcription profile. Aging Cell (2013) 12:645–51. 10.1111/acel.12088 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Kojima T, Takayama M, Hirose N. The metabolic syndrome, IGF-1, and insulin action. Mol Cell Endocrinol. (2009) 299:124–8. 10.1016/j.mce.2008.07.002 [PubMed] [CrossRef] [Google Scholar]
- Redman LM, Ravussin E. Endocrine alterations in response to calorie restriction in humans. Mol Cell Endocrinol. (2009) 299:129–36. 10.1016/j.mce.2008.10.014 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Garagnani P, Vitale G, Capri M, Salvioli S. Inflammaging and 'Garb-aging'. Trends Endocrinol Metab. (2017) 28:199–212. 10.1016/j.tem.2016.09.005 [PubMed] [CrossRef] [Google Scholar]
- Qian M, Liu B. Pharmaceutical Intervention of Aging. Adv Exp Med Biol. (2018) 1086:235–54. 10.1007/978-981-13-1117-8_15 [PubMed] [CrossRef] [Google Scholar]
- Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, et al.. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature (2011) 479:232–6. 10.1038/nature10600 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Derous D, Mitchell SE, Wang L, Green CL, Wang Y, Chen L, et al.. The effects of graded levels of calorie restriction: XI. Evaluation of the main hypotheses underpinning the life extension effects of CR using the hepatic transcriptome. Aging (2017) 9:1770–824. 10.18632/aging.101269 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Madeo F, Tavernarakis N, Kroemer G. Can autophagy promote longevity? Nat Cell Biol. (2010) 12:842–6. 10.1038/ncb0910-842 [PubMed] [CrossRef] [Google Scholar]
- Cevenini E, Monti D, Franceschi C. Inflamm-ageing. Curr Opin Clin Nutr Metab Care. (2013) 16:14–20. 10.1097/MCO.0b013e32835ada13 [PubMed] [CrossRef] [Google Scholar]
- Meydani SN, Das SK, Pieper CF, Lewis MR, Klein S, Dixit VD, et al.. Long-term moderate calorie restriction inhibits inflammation without impairing cell-mediated immunity: a randomized controlled trial in non-obese humans. Aging (2016) 8:1416–31. 10.18632/aging.100994 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ott B, Skurk T, Hastreiter L, Lagkouvardos I, Fischer S, Büttner J, et al.. Effect of caloric restriction on gut permeability, inflammation markers, and fecal microbiota in obese women. Sci Rep. (2017) 7:11955. 10.1038/s41598-017-12109-9 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Unamuno X, Gómez-Ambrosi J, Rodríguez A, Becerril S, Frühbeck G, Catalán V. Adipokine dysregulation and adipose tissue inflammation in human obesity. Eur J Clin Invest. (2018) 48:e12997. 10.1111/eci.12997 [PubMed] [CrossRef] [Google Scholar]
- Liu M, Liu F. Regulation of adiponectin multimerization, signaling and function. Best Pract Res Clin Endocrinol Metab. (2014) 28:25–31. 10.1016/j.beem.2013.06.003 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Balaskó M, Soós S, Székely M, Pétervári E. Leptin and aging: Review and questions with particular emphasis on its role in the central regulation of energy balance. J Chem Neuroanat. (2014) 61–62:248–55. 10.1016/j.jchemneu.2014.08.006 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Nakazawa S, Kojima T, Takayama M, Abihara Y, Shimizu K, et al. High adiponectin concentration and its role for longevity in female centenarians. Geriatr Gerontol Int. (2006) 6:32–9. 10.1111/j.1447-0594.2006.00304.x [CrossRef] [Google Scholar]
- Bik W, Baranowska-Bik A, Wolinska-Witort E, Kalisz M, Broczek K, Mossakowska M, et al.. Assessment of adiponectin and its isoforms in Polish centenarians. Exp Gerontol. (2013) 48:401–7. 10.1016/j.exger.2013.01.015 [PubMed] [CrossRef] [Google Scholar]
- Meazza C, Vitale G, Pagani S, Castaldi D, Ogliari G, Mari D, et al.. Common adipokine features of neonates and centenarians. J Pediatr Endocrinol Metab. (2011) 24:953–7. 10.1515/JPEM.2011.373 [PubMed] [CrossRef] [Google Scholar]
- Baranowska B, Bik W, Baranowska-Bik A, Wolinska-Witort E, Szybinska A, Martynska L, et al.. Neuroendocrine control of metabolic homeostasis in Polish centenarians. J Physiol Pharmacol. (2006) 57 (Suppl. 6):55–61. [PubMed] [Google Scholar]
- Miura Y, Hashii N, Tsumoto H, Takakura D, Ohta Y, Abe Y, et al.. Change in N-glycosylation of plasma proteins in Japanese semisupercentenarians. PLoS ONE (2015) 10:e0142645. 10.1371/journal.pone.0142645 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Atzmon G, Pollin TI, Crandall J, Tanner K, Schechter CB, Scherer PE, et al.. Adiponectin levels and genotype: a potential regulator of life span in humans. J Gerontol A Biol Sci Med Sci. (2008) 63:447–53. 10.1093/gerona/63.5.447 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mariotti S, Barbesino G, Caturegli P, Bartalena L, Sansoni P, Fagnoni F, et al.. Complex alteration of thyroid function in healthy centenarians. J Clin. Endocrinol Metab. (1993) 77:1130–4. 10.1210/jcem.77.5.8077303 [PubMed] [CrossRef] [Google Scholar]
- Maugeri D, Russo MS, Di Stefano F, Receputo G, Rosso D, Rapisarda R, et al.. Thyroid function in healthy centenarians. Arch Gerontol Geriatr. (1997) 25:211–7. 10.1016/S0167-4943(97)00012-5 [PubMed] [CrossRef] [Google Scholar]
- Ostan R, Monti D, Mari D, Arosio B, Gentilini D, Ferri E, et al.. Heterogeneity of thyroid function and impact of peripheral thyroxine deiodination in centenarians and semi-supercentenarians: association with functional status and mortality. J Gerontol A Biol Sci Med Sci. (2018). 10.1093/gerona/gly194. [Epub ahead of print]. [PubMed] [CrossRef] [Google Scholar]
- He Y, Chen X, Yan D, Xiao F, Liu Y, Lin R, et al.. Thyroid function decreases with age and may contribute to longevity in chinese centenarians' families. JAGS (2015) 63:1474–6. 10.1111/jgs.13553 [PubMed] [CrossRef] [Google Scholar]
- Corsonello A, Montesanto A, Berardelli M, De Rango F, Dato S, Mari V, et al.. A cross-section analysis of FT3 age-related changes in a group of old and oldest-old subjects, including centenarians' relatives, shows that a down-regulated thyroid function has a familial component and is related to longevity. Age Ageing (2010) 39:723–7. 10.1093/ageing/afq116 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Pereira da Silva A, Matos A, Valente A, Gil Â, Alonso I, Ribeiro R, et al.. Body composition assessment and nutritional status evaluation in men and women portuguese centenarians. J Nutr Health Aging (2016) 20:256–66. 10.1007/s12603-015-0566-0 [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Ostan R, Santoro A. Nutrition and inflammation: are centenarians similar to individuals on calorie-restricted diets? Annu Rev Nutr. (2018) 38:329–56. 10.1146/annurev-nutr-082117-051637 [PubMed] [CrossRef] [Google Scholar]
- Gentilini D, Mari D, Castaldi D, Remondini D, Ogliari G, Ostan R, et al.. Role of epigenetics in human aging and longevity: genome-wide DNA methylation profile in centenarians and centenarians' offspring. Age (2013) 35:1961–73. 10.1007/s11357-012-9463-1 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sgarbi G, Matarrese P, Pinti M, Lanzarini C, Ascione B, Gibellini L, et al.. Mitochondria hyperfusion and elevated autophagic activity are key mechanisms for cellular bioenergetic preservation in centenarians. Aging (2014) 6:296–310. 10.18632/aging.100654 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Emanuele E, Minoretti P, Sanchis-Gomar F, Pareja-Galeano H, Yilmaz Y, Garatachea N, et al.. Can enhanced autophagy be associated with human longevity? Serum levels of the autophagy biomarker beclin-1 are increased in healthy centenarians. Rejuvenation Res. (2014) 17:518–24. 10.1089/rej.2014.1607 [PubMed] [CrossRef] [Google Scholar]
- Raz Y, Guerrero-Ros I, Maier A, Slagboom PE, Atzmon G, Barzilai N, et al.. Activation-induced autophagy is preserved in CD4+ T-cells in familial longevity. J Gerontol A Biol Sci Med Sci. (2017) 72:1201–6. 10.1093/gerona/glx020 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Fontana L, Villareal DT, Weiss EP, Racette SB, Steger-May K, et al. Calorie restriction or exercise: effects on coronary heart disease risk factors. A randomized, controlled trial. Am J Physiol Endocrinol Metab. (2007) 293:E197–202. 10.1152/ajpendo.00102.2007 [PubMed] [CrossRef] [Google Scholar]
- Ravussin E, Redman LM, Rochon J, Das SK, Fontana L, et al.. A 2-year randomized controlled trial of human caloric restriction: feasibility and effects on predictors of health span and longevity. J Gerontol A Biol Sci Med Sci. (2015) 70:1097–104. 10.1093/gerona/glv057 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Bruunsgaard H, Andersen-Ranberg K, Jeune B, Pedersen AN, Skinhoj P, Pedersen BK. A high plasma concentration of TNF-α is associated with dementia in centenarians. J Gerontol A Biol Sci Med Sci. (1999) 54:M357–64. 10.1093/gerona/54.7.M357 [PubMed] [CrossRef] [Google Scholar]
- Gangemi S, Basile G, Merendino RA, Minciullo PL, Novick D, et al.. Increased circulating interleukin-18 levels in centenarians with no signs of vascular disease: another paradox of longevity? Exp Gerontol. (2003) 38:669–72. 10.1016/S0531-5565(03)00061-5 [PubMed] [CrossRef] [Google Scholar]
- Gerli R, Monti D, Bistoni O, Mazzone AM, Peri G, et al.. Chemokines, sTNF-Rs and sCD30 serum levels in healthy aged people and centenarians. Mech. Ageing Dev. (2000) 121:37–46. 10.1016/S0047-6374(00)00195-0 [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Capri M, Monti D, Giunta S, Olivieri F, Sevini F, et al.. Inflammaging and anti-inflammaging: a systemic perspective on aging and longevity emerged from studies in humans. Mech Ageing Dev. (2007) 128:92–105. 10.1016/j.mad.2006.11.016 [PubMed] [CrossRef] [Google Scholar]
- Salvioli S, Monti D, Lanzarini C, Conte M, Pirazzini C, Bacalini MG, et al.. Immune system, cell senescence, aging and longevity–inflamm-aging reappraised. Curr Pharm Des. (2013) 19:1675–9. 10.2174/1381612811319090015