在开始介绍材料之前,我想对自己说几句话:反对HIV否认HIV的社区成员(“ HIV / AIDS持不同政见者”):2016-2018年,“ HIV / AIDS持不同政见者及其子女”,从2018年开始-“拒绝提供HIV / AIDS和替代药物。”
我的观点(不仅是我的观点)是,大多数拒绝接受HIV治疗的情况都是由于对这种慢性感染的平庸误解以及对HIV感染者的耻辱所致-使用常见的陈词滥调-社会底层的疾病,反之亦然,“文化精英”。 长期以来情况并非如此-在俄罗斯,约有1%的人口患有艾滋病毒,而且这种情况并没有计划好转。
大约一年前,关于该资源的几篇文章鼓励我写出五篇关于反病毒历史的笔记。 这些文章的目的是描述各种HIV药物的工作原理(顾问是微生物学家和传染病专家)。 我希望您喜欢安排这些笔记。
关于病毒
因此,一般来说,病毒几句话:它们在有生命的世界和无生命的世界之间处于中间位置; 它们不能独立繁殖;为此,需要宿主生物的细胞。
该病毒的组织非常简单:它带有一个遗传密码,该密码封闭在衣壳中,衣壳有时被外壳包围。 该代码可以通过多种方式呈现。 密码载体是DNA或RNA,即 核酸(NK)。 代码链可以是一两个:双链NK和单链NK。 链条可以成环或线性闭合。 根据这些迹象,1971年,大卫·巴尔的摩将病毒分为7类。 该分类法今天仍在使用,对于解释某些药物的工作原理将非常重要。
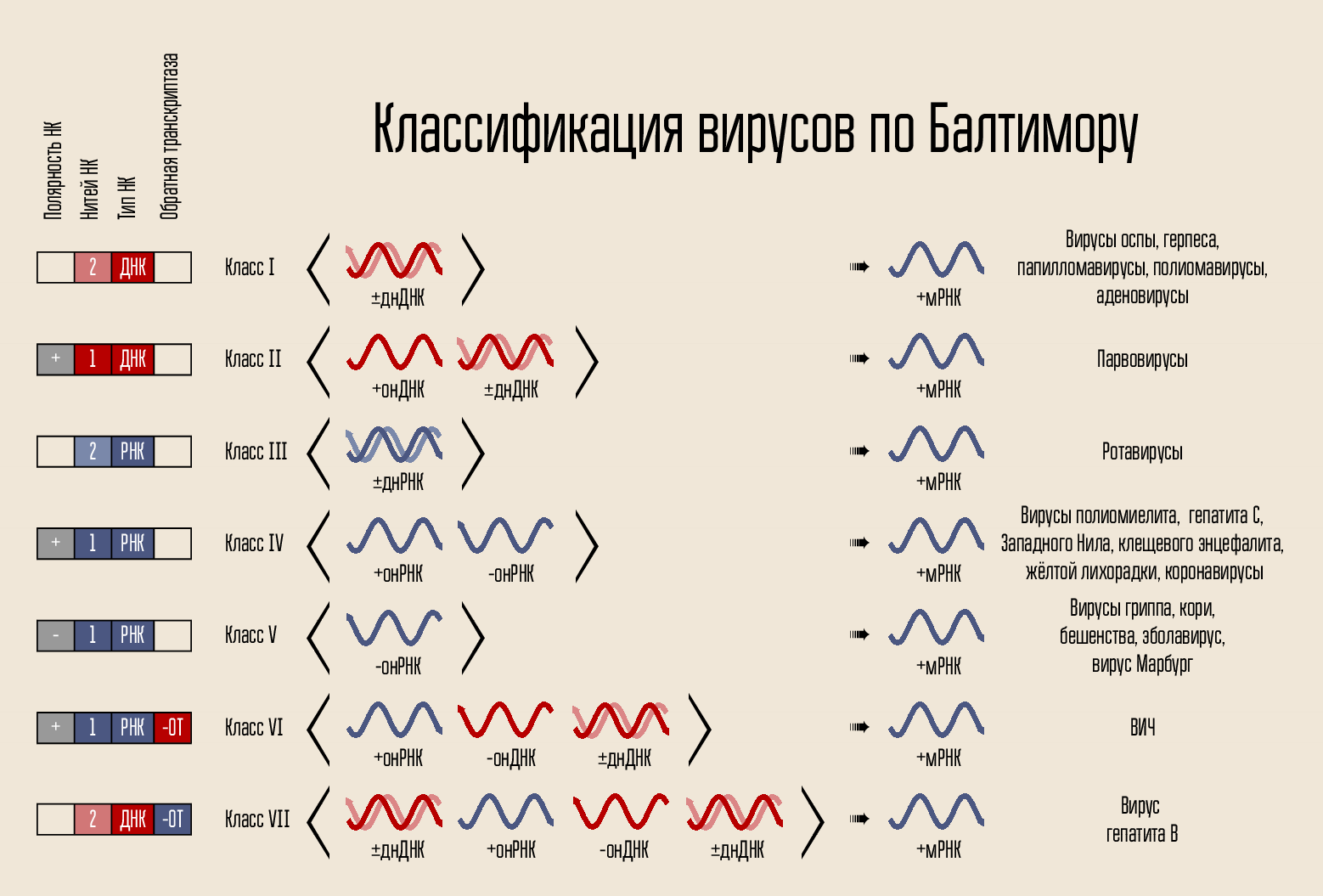
用于构建新病毒的代码本身无法穿透细胞;它需要某种穿透机制。 因此,有一个蛋白质壳-衣壳,可以保护病毒的NK,并有助于渗透到细胞中。 在某些情况下,病毒可能具有其他脂质膜。
病毒渗透到细胞中

要进入细胞,病毒必须连接至其膜。 为此,病毒表面上存在与宿主细胞受体蛋白结合的蛋白质-在病毒能够附着的细胞壁表面上。 而且他们必须严格适应病毒,否则它将甚至无法附着在细胞上。
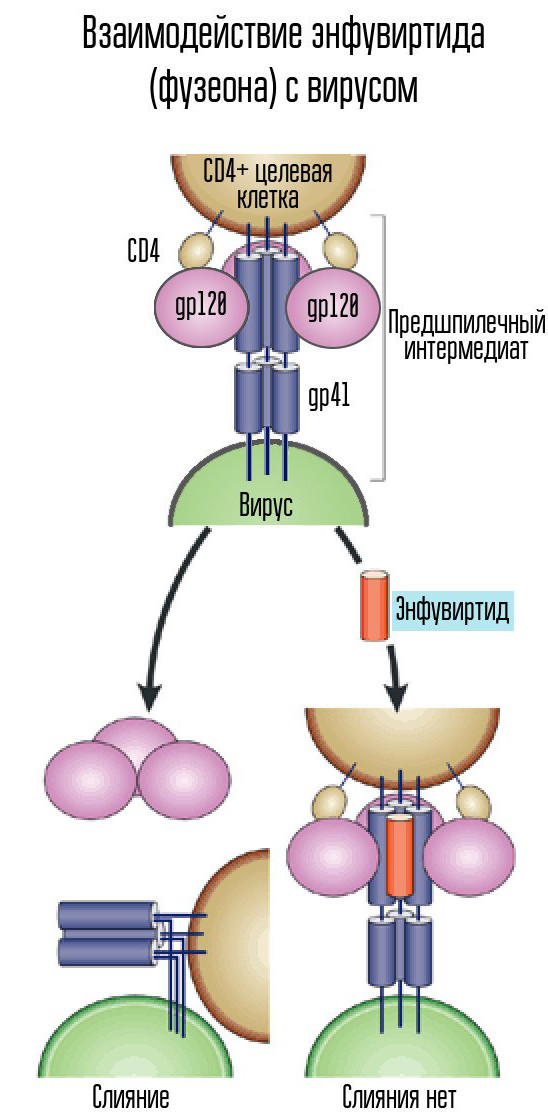
为此,HIV使用CD4受体(具有这种受体的细胞是人体的免疫细胞,包括T淋巴细胞,单核细胞,巨噬细胞等)。 仅靠CD4是不够的-您需要另一个共受体,CCR5或CXCR4。 艾滋病毒使用gp120鞘蛋白参与。 此后,另一种病毒包膜蛋白gp41的形状发生了变化。 它弯曲到一边,形成发夹并使病毒的衣壳与细胞融合。
Enfuvirtide(Fuzeon)是gp41蛋白的抑制剂,是用于抵抗病毒的药物之一。 Enfuvirtide与该蛋白结合可防止发夹的形成。 因此,病毒的衣壳不能与细胞融合并且不会发生感染。 该药物是唯一开发和批准的融合抑制剂。
属于艾滋病毒的逆转录病毒由于其可变性而成为药物的极不方便的靶标。 人类细胞的挥发性要小得多。 众所周知,北欧约有1%的人口对HIV免疫:它们是CCR5-∂32突变的携带者,这使得CCR5受体形式不适合与HIV结合。
不幸的是,要永久改变这种受体的形状(包括不断在人体中出现的新细胞)是一项极其艰巨的任务(尽管已经进行了尝试),但是开发一种受体抑制剂是一种会附着在细胞受体上从而阻止HIV感染的药物。对他-很有可能。
几种CCR5和CXCR4受体抑制剂正在开发中,但迄今为止唯一批准的一种是CCR5抑制剂maraviroc。
反转录
如果是艾滋病毒,病毒与细胞融合后会发生什么?
HIV是巴尔的摩的VI类病毒;它以RNA形式存储其基因组。 细胞的核心中有DNA,因此HIV需要将一种核酸转变为另一种核酸。 这种转录(NK→NK)由称为聚合酶的相应酶进行。 对于依赖于RNA的(即从RNA读取信息)DNA聚合酶(即DNA出现在输出端),有一个特殊的名称-逆转录酶。 逆转录酶吸收所需的脱氧核苷(为简单起见,实际上涉及三磷酸脱氧核苷),并构建与相应病毒RNA互补的DNA。
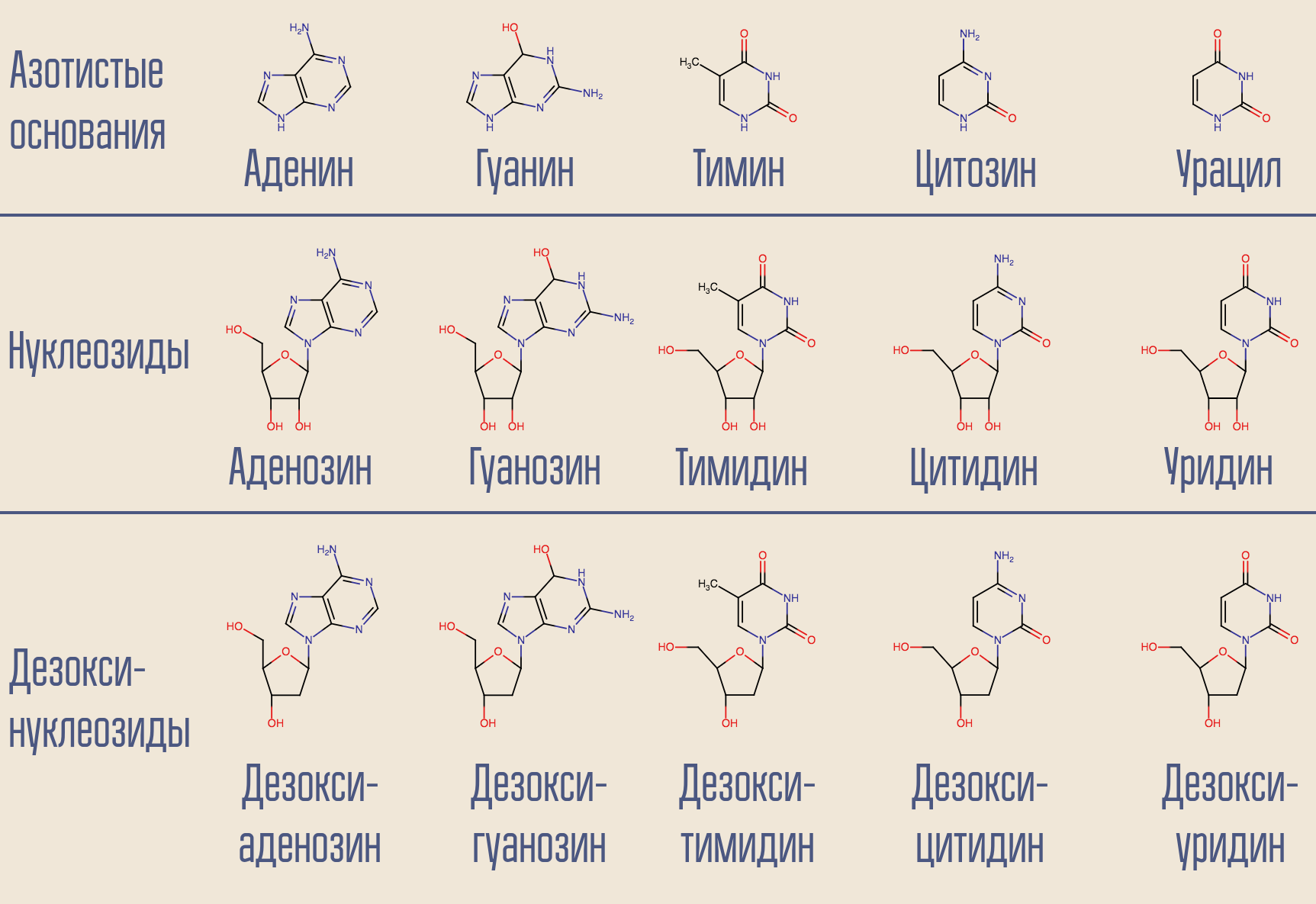
是否可以中断此过程? 是的,为此,您只需要去除一种类似于脱氧核苷但不是一种的逆转录酶即可。 这就是最早的艾滋病毒药物齐多夫定(叠氮胸苷,AZT)的作用。 它与脱氧胸苷相似,但不相似。
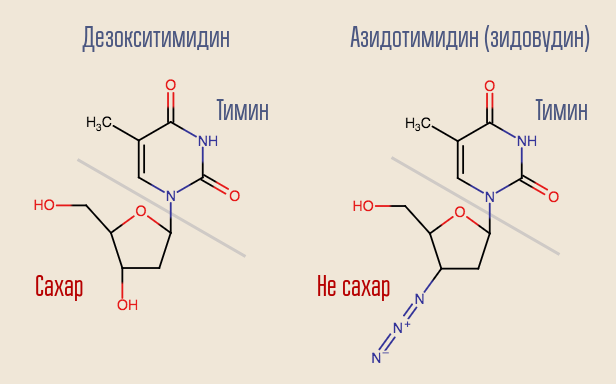
叠氮胸苷的开发是为了寻找可以对抗肿瘤的物质。 据推测,他将被嵌入普通人类DNA的构建中,从而打断它。 因此,该药物将最强烈地影响分裂最迅速的细胞-肿瘤细胞。 有某些理由认为-先前合成的该组另一种药物6-巯基嘌呤在治疗白血病方面有效。
不幸的是,在动物实验中,这种药物被证明无效并且被遗忘了一段时间,直到1984年,在Burroughs Wellcome基金会实验室工作的病毒学家Marty St. Clair发起了研究,以检查所有可用物质的治疗选择。他们有一种新疾病-HIV感染。
逆转录酶将齐多夫定“识别”为脱氧胸苷,并试图将其掺入DNA。 由于该药物仅与脱氧胸苷相似,因此该位点的DNA合成被中断。 齐多夫定完全抑制了病毒的繁殖,几乎立即开始了人体试验。
感染HIV的志愿者分为两组,一组接受安慰剂,另一组接受AZT。 两组之间的差异如此惊人,以至于进一步测试被认为是不人道的-该药显示出惊人的功效。
齐多夫定的成功促使人们对其他核苷逆转录酶抑制剂(NRTIs)进行了研究,并且许多其他药物在很短的时间内就出现了。 首批药物中最有趣的是拉米夫定,拉米夫定是另一种脱氧核苷,脱氧胞苷的类似物。 拉米夫定的缺点是使用这种药物进行单药治疗后,耐药性会在大约一个月内迅速发展。 这是由于HIV M184V的单点突变。 尽管如此,还是希望将拉米夫定留在该方案中。 事实是具有此突变的病毒对齐多夫定高度敏感,而突变本身降低了病毒复制的速度。
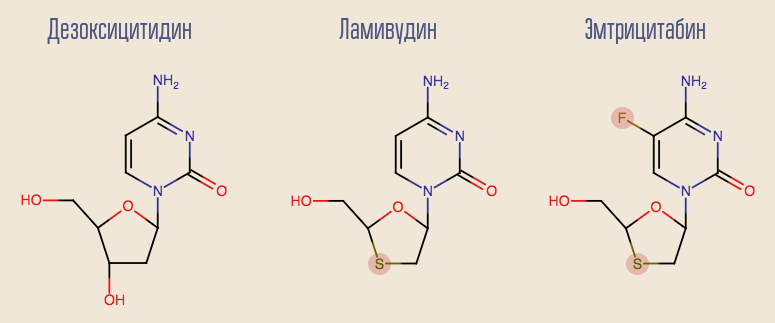
目前,拉米夫定逐渐开始消退至过去,取而代之的是更现代的类似物恩曲他滨。 拉米夫定和脱氧腺苷类似物阿德福韦均在乙型肝炎的治疗中显示出良好的效果。不幸的是,阿德福韦已被证明在治疗艾滋病毒方面无效。 但是,在对其分子进行轻微修饰后,出现了它的更新版本-替诺福韦。 替诺福韦和恩曲他滨是许多现代疗法的一部分。
两种NRTI的组合可以显着延长HIV感染者的寿命,但是很明显,为了完全抑制该病毒,必须包含至少一种具有不同作用类型的药物,因为该病毒迟早会对NRTI的任何组合产生耐药性。 具有不同作用类型的首批物质之一是另一种逆转录酶抑制剂-非核苷(NNRTI)。 尽管逆转录酶(RT)希望与核苷(三磷酸核苷)结合使用,但是您可以尝试制造一种能够与RT结合并改变其形状的物质,从而使其不再发挥作用。
1996年和1998年,分别批准了奈韦拉平和依法韦仑这两种物质。 它们中的每一个都有效地抑制了OT的工作,并且与两种NRTI结合使用,它创建了一个完整的高效抗逆转录病毒疗法(HAART)方案-足以使艾滋病毒感染者充分生活,其持续时间与没有艾滋病毒感染者的生活相差无几。
2006年,批准了首个每日单次使用的组合药物:Atripla。 Atripla由两种NRTI组成:恩曲他滨和替诺福韦(以替诺福韦二酚(一种形式,前药,一种化学修饰的剂型,直接在体内转化为药物)的形式)和一种NNRTI,依法韦伦扎。 Atripla已成为改善患者生活质量的新的定性步骤。 迄今为止,Atripla的非专利药是世界上(在发展中国家)最常用的药物之一。
但是,今天的NNRTIs逐渐退出市场-旧药物会引起各种副作用。 因此,例如,开始服用依非韦伦后的头两个月可能对某些患者(并非全部!)引起头晕和其他类似作用。 当然,这比即将发生的死亡要好得多。 这种病不会持续太久,他们已经学会了应对-但是,当前的趋势是向此类药物的过渡,患者并没有注意到这种副作用。
整合性
如果逆转录酶已完成工作,是否有可能停止将病毒DNA掺入细胞DNA中? 此过程涉及一种称为整合酶的特殊酶。
整合病毒DNA的过程分为几个阶段。 最初,整合酶与病毒DNA结合,从每条链的3'末端去除GT二核苷酸。 然后将整个复合物转运至细胞核,整合酶催化了链转移的阶段。 这个阶段是酯交换反应(自由基交换)反应:细胞DNA的核苷酸彼此之间不连接,而是与病毒DNA的核苷酸相互连接。 整合酶攻击位于五个核苷酸距离处的核苷酸间键。 因此,整合后,仍然存在:病毒DNA链5'末端的加工,5个缺失核苷酸的完成和连接(两个NK链与酶连接酶的连接),这是在细胞蛋白的参与下进行的[1]。
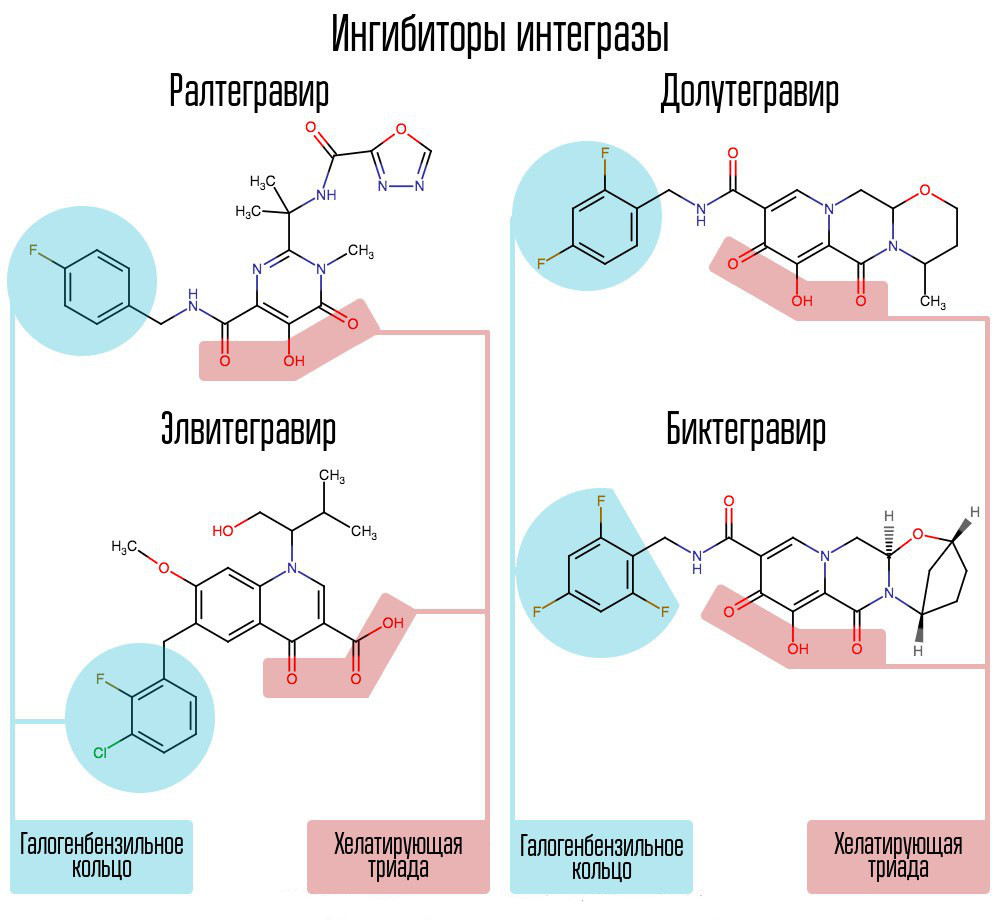
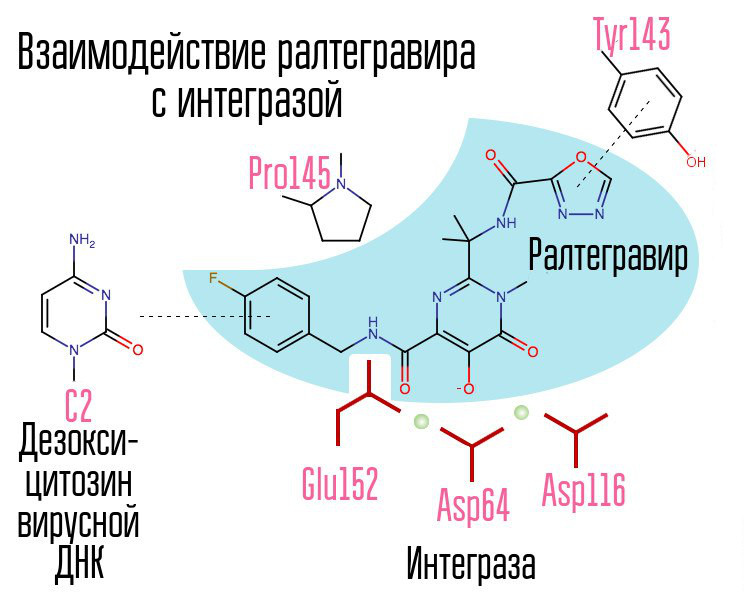
在化合物库中筛选了约25万种物质,发现了抑制HIV整合的物质。 所有人都是2,4-二氧代丁酸化合物。 他们在整合酶的活性中心协调金属离子-在那部分负责链转移。 进一步开发HIV-1整合酶抑制剂的尝试导致了N-嘧啶酮衍生物的出现,该衍生物为MK-0518,称为拉格列韦。 [2]
raltegravir和随后的整合酶抑制剂共有的是螯合三联体(配位金属离子)和在与该酶结合的病毒DNA的3'端与倒数第二个脱氧胞嘧啶相互作用的卤素-苄基环。
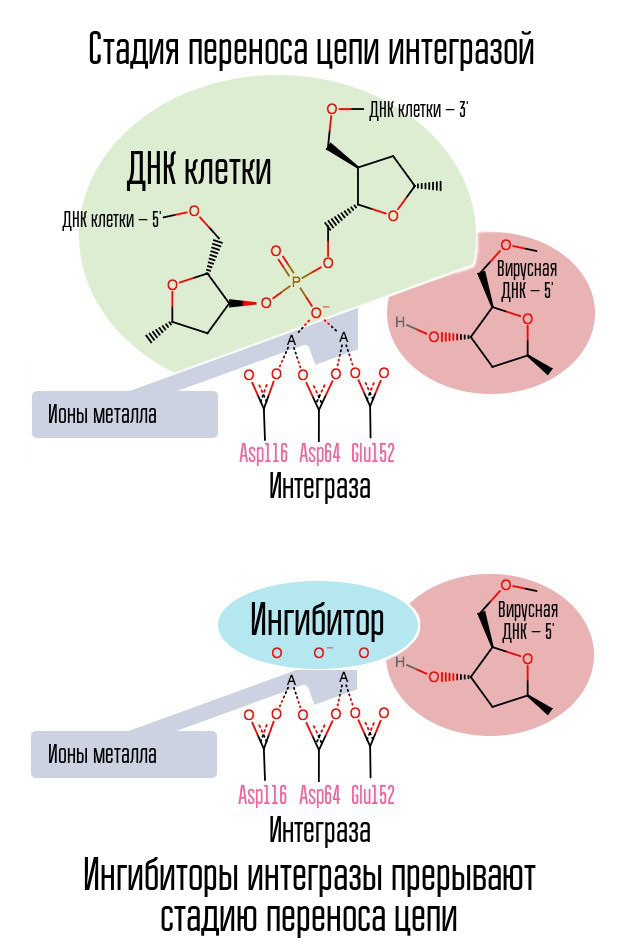
将病毒整合到细胞中的过程是暴露后预防有效的最后一步。 此后,在人体核中出现携带HIV DNA的细胞。 预防接触后最有效的时间约为6-10小时。
整合酶抑制剂分子中的卤素苄基环与病毒DNA相互作用,而氧原子团与两个金属原子相互作用。 病毒整合酶利用这些金属原子将病毒DNA引入细胞。 结果,阻止了集成过程。
诸如dolutegravir之类的现代AI能够战胜raltegravir与耐药性迅速形成有关的“儿童疾病”。
蛋白水解
病毒基因组通过转录阶段后,创建的病毒RNA被送出细胞。 在产生病毒体的过程中,涉及另一种称为蛋白酶的病毒酶。 蛋白酶将长的多蛋白切割成单个功能蛋白,从而导致病毒酶和病毒结构蛋白的形成。
蛋白酶不仅对HIV蛋白有活性,而且对宿主细胞蛋白也有活性,这可以解释HIV的细胞毒性作用(细胞死亡)。
如果蛋白酶被阻断,则病毒体将不能通过成熟阶段,并且将保持完全无功能。 HIV-1蛋白酶是一种典型的逆转录病毒天冬氨酸蛋白酶,在活性中心具有特征性氨基酸序列Asp25 Thr26 Gly27(天冬氨酸-苏氨酸-甘氨酸)。 第一种蛋白酶抑制剂沙奎那韦于1995年12月6日被FDA批准。 因此,在沙奎那韦诞生后,才首次出现了高效抗逆转录病毒疗法。
这组药物的另一个典型代表是洛匹那韦(与利托那韦-卡乐特拉(俄罗斯最常见的HIV药物之一)联合使用)。 利托那韦也是一种蛋白酶抑制剂,但被用作增强剂-由于其作用,主要药物的浓度增加。
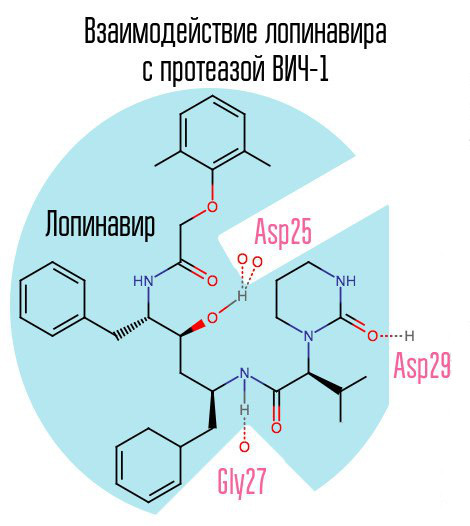
由于沙奎那韦和随后的蛋白酶抑制剂(PIs)专门针对酶的活性中心,随着对一种PI的耐药性的发展,很有可能发生对其他PI的耐药性。 解决该问题的方法可以是制备针对其他蛋白酶区的抑制剂。
darunavir(prezista)于2006年问世,在某种程度上减轻了对HIV-1耐药性HIV毒株的急性问题,因为它与30位天冬氨酸形成了以前未曾使用的联系。
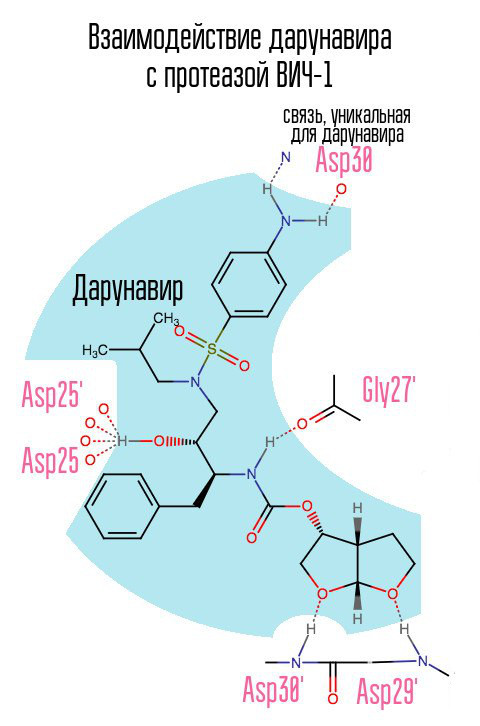
没有蛋白酶,病毒就无法成熟。 抑制剂与蛋白酶的活性中心结合并阻止其起作用。
蛋白酶抑制剂在高病毒载量下非常有效:由于此时许多新病毒体在体内产生,PI不允许它们成熟,从而有效地在短时间内降低了病毒载量。 但是,目前,一线治疗中未使用PI,因此让位给整合酶抑制剂(II)。
其原因是副作用:事实是,例如,同一羽衣甘蓝导致非特异性抑制食物中蛋白质的蛋白水解,原因是这些蛋白质进入小肠并引起腹泻。 遵循特定的饮食习惯或使用新的PI(例如prezista)可以将这种作用降低到几乎为零,但是与糖水平升高相关的另一种作用通常会无限期地阻止蛋白酶抑制剂的使用。
现代治疗方案
迄今为止,人们认为最现代的方案包括整合酶抑制剂和一或两个NRTI(杜鲁格韦+阿巴卡韦+拉米夫定;杜鲁韦+拉米夫定是一种流行的两组分方案,但是并不适合所有人)。 这些计划使一个人过着与没有艾滋病毒的人一样的寿命。
尽管取得了所有成功,但仍无法完全治愈HIV(从具有CCR5-∂32突变的供体进行骨髓干细胞移植可以达到这样的结果,但是显然,只有当发生移植物抗宿主反应时,在很多情况下导致接收者死亡)。
结论
先进的HIV方法已有助于对抗其他传染病:如上所述,拉米夫定和替诺福韦对乙型肝炎病毒有效(巴尔的摩VII类-乙型肝炎聚合酶可以将RNA转移至DNA,因此某些NRTI可以有效地对抗它) 。 所获得的知识有助于开发出抗丙型肝炎的直接作用药物,如今它可以完全治愈该疾病(丙型肝炎没有潜伏期,因此,在抑制病毒载量时,无新病毒体来源-这种疾病可以完全治愈)。
[1] Korolev S. P.,Agapkina Yu。Yu。,Gottikh M. B. HIV-1整合抑制剂临床使用的问题和前景
[2] Shahgildyan V.I. HIV整合酶抑制剂-有效和安全的抗逆转录病毒疗法的基础