
现代临床肿瘤学的成功不可否认。 越来越复杂的手术,新药,减轻疼痛和消除疼痛症状的有效方法。 我们在博客中
谈论了足够多的今天,即使在疾病的最后阶段,也可以延长患者的生活,并使他们的生活更轻松。
但是,尽管如此,世界各地成千上万的癌症患者每天都知道,昨天接受某种治疗的肿瘤今天又在增长或转移。 医生通常会陷入停顿:尝试了所有处方药和治疗方法,并且没有给该患者留下有效的药物。
但是,甚至可以找到摆脱这种僵局的方法。 随着遗传学和分子生物学的发展,肿瘤学家找到了一种研究肿瘤的新方法,以发现其中的脆弱性。
为此,请使用分子遗传测试-确定癌细胞DNA的特征。 该方法技术上复杂,昂贵,需要医生的专门知识。
研究需要3周的时间,费用从250到670 tr 结果,医生收到了30页复杂信息的报告,他应该仍然可以使用。 但是对于已经不再抱有希望的患者,这可以延长生命。
在《
医学24/7》中,当“每个人都尝试过-无事可做”时
,我们经常求助于分子遗传学研究治疗一个人。 而且似乎无济于事的患者继续生活。 有些是两个月而不是两个星期,而另一些是几年而不是几个月。
今天,我们想谈谈分子遗传学测试是如何完成的,在什么情况下可以帮助患者以及医生提供什么知识。
我们都是突变体,这是正常现象。 但是某些突变会导致癌症“体面”的细胞活着而不会干扰其他人。 他们使用严格分配的资源,充分发挥其生物学功能,并在适当的时候死亡,让位给下一代(此过程称为细胞凋亡)。 每7至10年,人体就会完全更新一次。
为此,除红血球外,所有体细胞(组成人体的那些细胞)都持续分裂。
在分裂之前,将其核心内的遗传遗传信息的“副本”储存在细胞中。 复制“折叠”到细胞核内染色体的DNA链,即 加倍。 之后,细胞分裂,向每个子细胞悄悄分配一组相同的染色体。 从一个细胞中,两个细胞是绝对相同的,并且每个人连同其基因包都“了解”它的生存方式,执行的功能以及生命中要分享多少次。
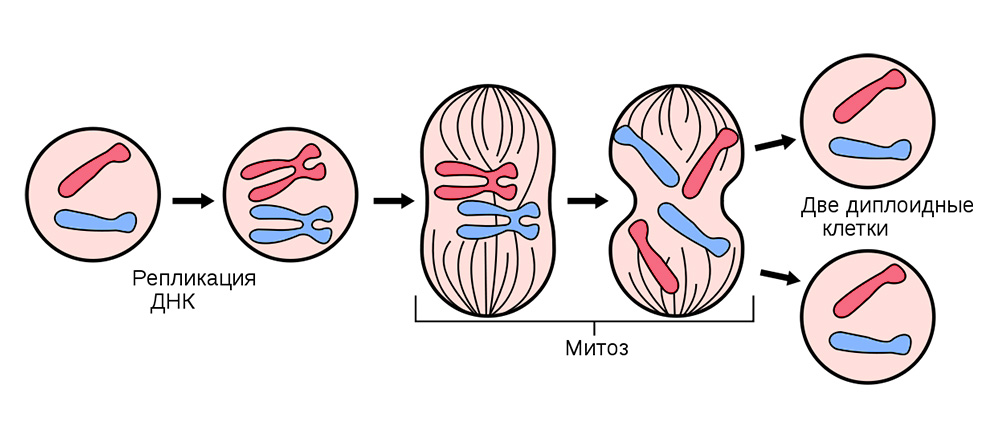 体细胞分裂发生在所有器官和组织中。
体细胞分裂发生在所有器官和组织中。有时在除法失败的过程中-会出现突变。 DNA链断裂,将被错误复制,或者染色体部分将被混合。 数百种因素会影响到这一点:从压力和烟草烟雾到暴露于辐射。
突变可分为4种类型。1. 碱基对的替换 (单核苷酸多态性,SNP):一个核苷酸-遗传密码的“字母”-变为另一个。 该核苷酸序列编码的蛋白质的结构也被破坏。
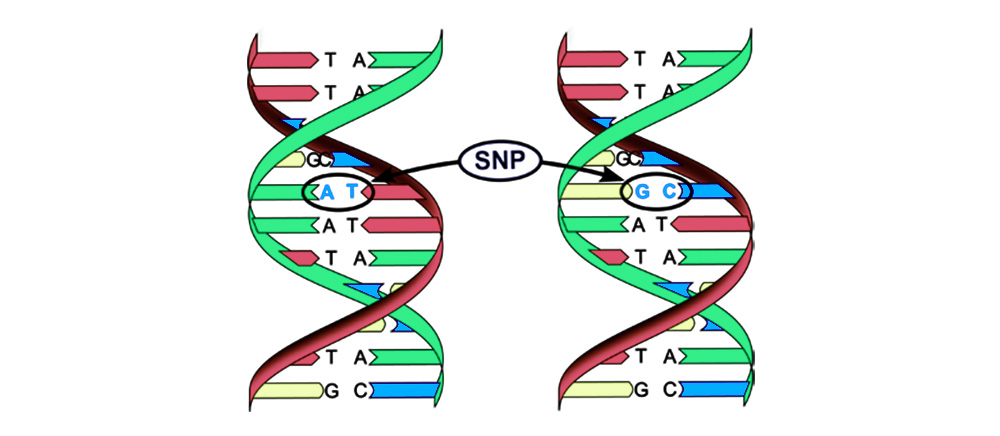 2. 染色体畸变。缺失
2. 染色体畸变。缺失 -染色体位点的丢失。 它们是由于末端部分的终止或DNA断裂同时在两个位置发生。 就是这样-该基因不再在染色体上表达。
可以将撕下的“片段” DNA插入相邻的染色体中-会导致
插入 (或反转,如果插入以相反顺序发生)。 有时在染色体之间存在DNA区段的“相互交换”-
易位 。 结果是:
表达 “额外”基因。
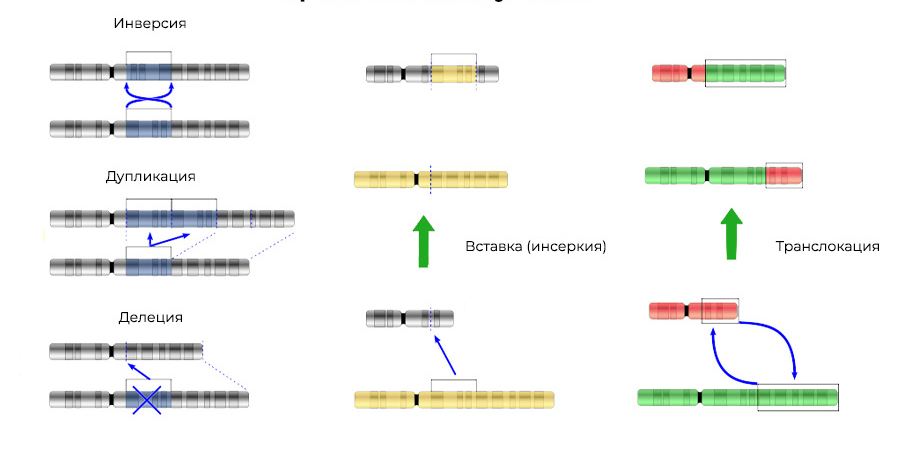 突变不仅会改变DNA位点的结构,而且会改变这些位点的顺序3. 基因融合
突变不仅会改变DNA位点的结构,而且会改变这些位点的顺序3. 基因融合 -从其他基因的一部分“组装”一个基因,然后整体表达(触发)。 这种嵌合基因表达中的蛋白质也被证明是异常的,杂种的,具有有害的特性。
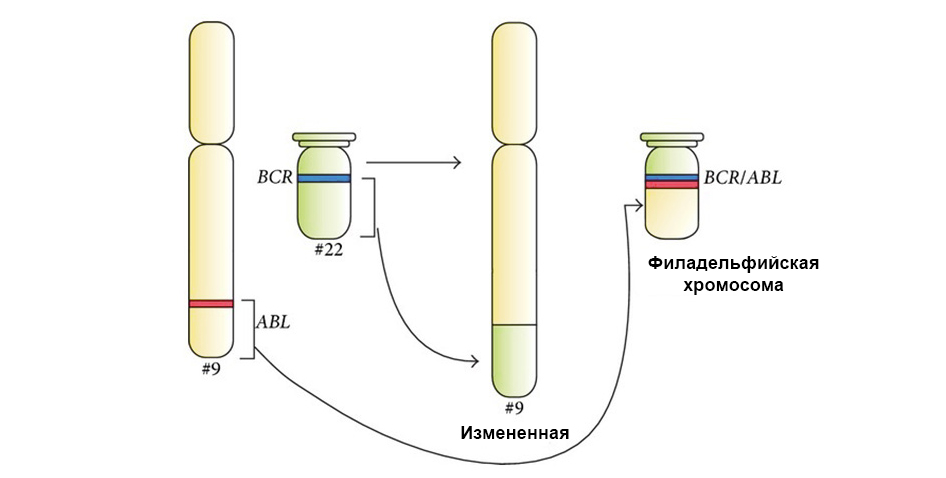 易位期间两个基因“卡在一起”并形成嵌合基因(导致白血病)
易位期间两个基因“卡在一起”并形成嵌合基因(导致白血病)我们很幸运,DNA充满了不编码任何内容的不太重要的部分。 在这些区域中发生许多突变-事实证明它们是微不足道的,对细胞的进一步工作没有影响。 与“标准”稍有不同的此类单元将继续正常生活和共享。
70多年来,人体发生了100万亿个细胞分裂。 每年有1.4万亿个分裂-随着时间的推移,有足够多的案例会积累DNA的“临界质量”错误,否则,另一个失败仍然可能进入编码重要内容的DNA部分。 这将导致无害的突变,由于该突变,细胞将变为恶性(恶性)。
恶性细胞不同于正常细胞周期疾病。细胞周期 (从分裂到分裂/死亡的细胞生命)受到
特殊蛋白质的
作用的严格调控
:激酶,细胞周期蛋白,生长因子和转录因子 -每个活细胞中都有数十种
蛋白质 ,每种都有其特殊但重要的功能。
它们在多细胞生物的细胞之间传输信号,彼此激活,开始分裂过程并控制其正确性,维持基因的正确激活,由细胞执行其功能,“检查”基因组完整性,“命令”细胞死亡时开始凋亡,以及.p。
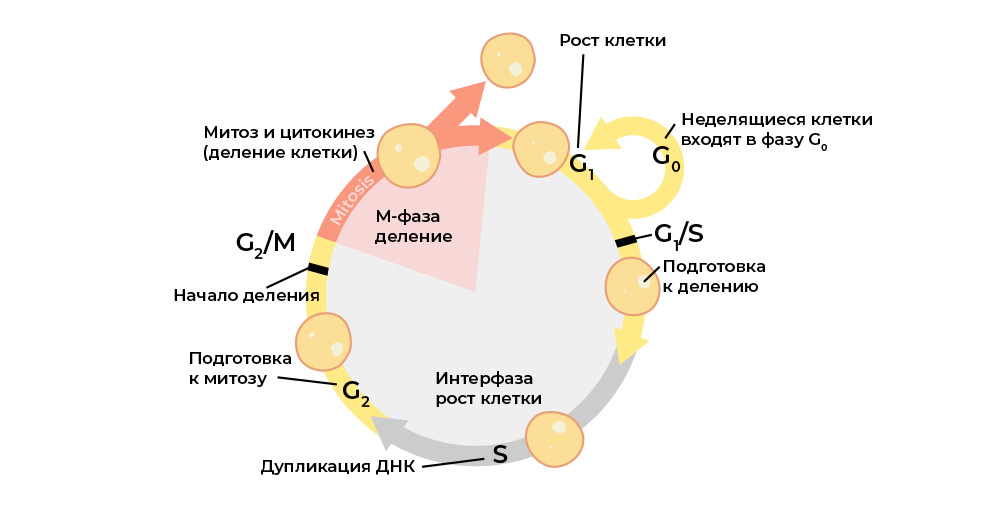 细胞周期的每个阶段均由调节蛋白控制。
细胞周期的每个阶段均由调节蛋白控制。这些蛋白质中的每一个都编码在
DNA的
特定部分-基因中。 如果此类基因发生有害突变,它将错误地“复制”相应的调节蛋白。 而“错误的”蛋白质调节剂会破坏细胞周期,从而破坏整个细胞的行为。
例如,用于增殖(细胞质量增长)的蛋白质调节剂的基因“分解”了,而“突变体”开始分裂得比正常情况更多,健康细胞“破碎”了。
如此重要的基因(可导致癌变(癌症发作)的变化)分为两个大类。原癌基因是“正常”基因,由于其功能的增强或改变而可以变成
癌基因 。 表达会导致细胞恶性和肿瘤发生的
基因被称为
癌基因 。 如果在原癌基因中发生有害的突变,它将变成
癌基因并引起肿瘤。
在
研究最
深入 ,广为人知的那些语言中:
- EGFR,ALK,BRAF-非小细胞肺癌;
- BRAF-黑色素瘤;
- HER2-乳腺癌(乳腺癌);
- KRAS-大肠癌。
此外,在几种类型的肿瘤中发现了这些基因的突变。 例如,不仅在乳腺癌中,而且在肺癌和胃癌中发现HER2的表达增加。
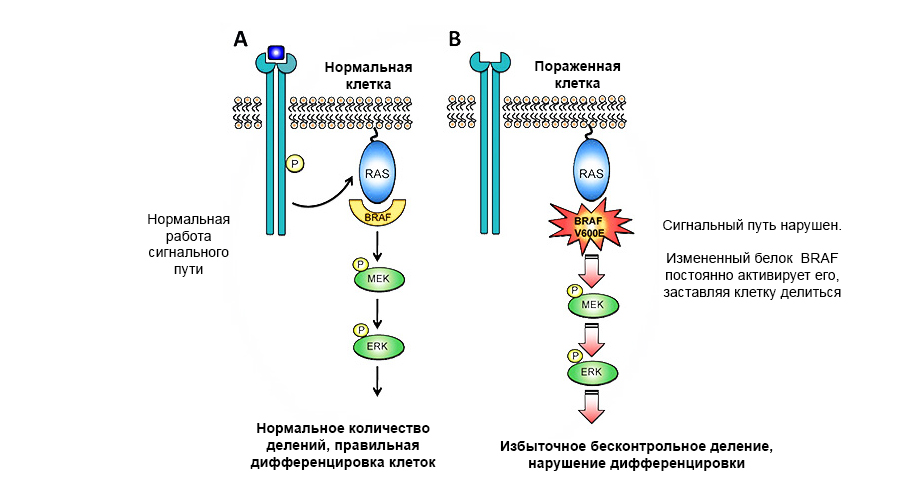 BRAF蛋白的原癌基因突变导致不受控制的肿瘤生长。
BRAF蛋白的原癌基因突变导致不受控制的肿瘤生长。肿瘤抑制基因(抗癌基因)-相反,可以
抑制肿瘤细胞
的生长或参与受损DNA的修复(修复)。 但是由于突变导致抑制基因的失活极大地增加了恶性肿瘤的可能性。
例如:
- 突变BRCA1,BRCA2-乳腺,卵巢癌;
- p53突变-多达50%的各种类型的癌性肿瘤,包括 肉瘤
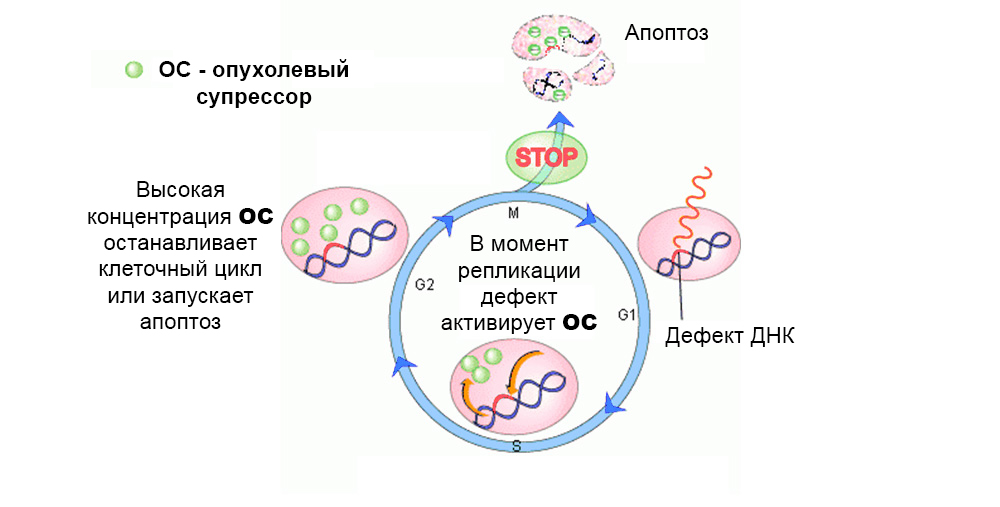 通常,保护机制可抵抗突变细胞的发育。 肿瘤抑制基因的缺陷“关闭”了它们
通常,保护机制可抵抗突变细胞的发育。 肿瘤抑制基因的缺陷“关闭”了它们总的来说,研究了数十种原癌基因和抑癌剂对癌变的影响。
为什么会有这么多困难,如何延长患者的寿命在原癌基因或抑制基因中发现的每个突变都是导致癌细胞“超能力”的原因,例如忽视细胞凋亡和躲避免疫的能力。 但同时-这是其潜在的弱点。
知道造成肿瘤手术机制异常的原因是什么,人们就可以找到一种物质,使该机制“楔住”并中断细胞中的病理反应链。 也就是说,肿瘤中的特定突变-表明医生用药物“击中”的目标。 这一原则使
靶向治疗得以发展。
靶向疗法 -一种有效的癌症药物疗法分支的名称-源自英文单词target。 靶向药物对癌细胞具有“靶向”作用-因为只有它们在相应的基因中才会发生突变。 健康细胞没有这种突变-药物也不会对其起作用。
下图显示了靶向药物伊马替尼对具有费城染色体突变的肿瘤细胞BCR-ABL融合基因的作用机理。 这种突变导致细胞凋亡机制停止在细胞中起作用的事实-基因组中的错误累积,细胞退化为癌性细胞。
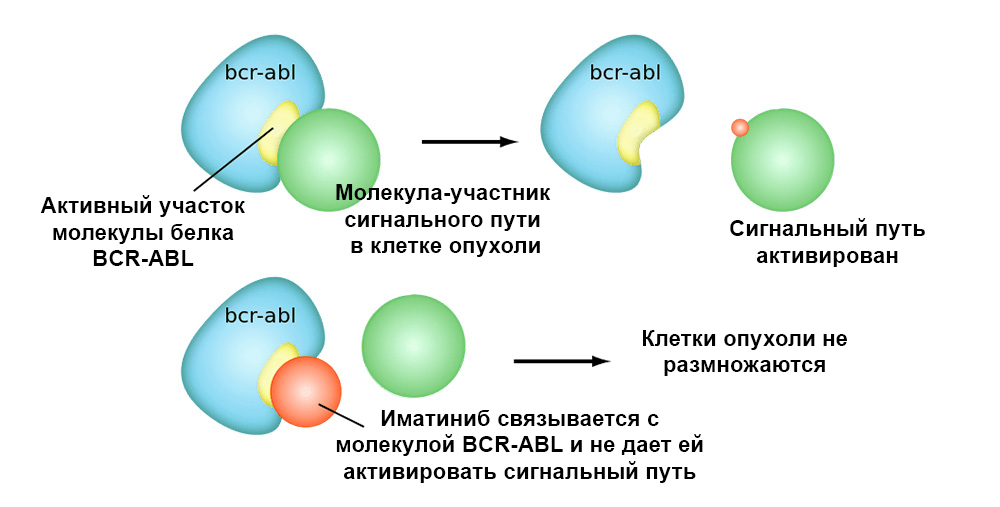 伊马替尼与BCR-ABL蛋白分子的活性位点结合,并阻断其与信号通路中其他分子相互作用的能力。因此,靶向药物与经典化疗相比具有两个重要优势。效率更高。
伊马替尼与BCR-ABL蛋白分子的活性位点结合,并阻断其与信号通路中其他分子相互作用的能力。因此,靶向药物与经典化疗相比具有两个重要优势。效率更高。 对肿瘤细胞的靶向作用可以实现更好的肿瘤对治疗的“反应”。 例如,与经典疗法相比,针对具有HER2过表达的乳腺癌,靶向药物曲妥珠单抗联合化疗的添加
显着增加了 “应答”
的频率-81%比73%,完全形态缓解(肿瘤消失)的频率-43%比23%
副作用少。 经典化学疗法具有细胞毒性作用。 本质上,有毒物质可以杀死或至少减慢癌细胞的生长。 它们大多数作用于迅速分裂的细胞。 例如,这就是为什么头发掉下来的原因:它也是一种活跃分裂的细胞,它们“处于分布之下”。 由于这种针对性不强的作用,化学治疗药物会产生严重的副作用:胃肠道和其他器官也会受到损害。
在
医学24/7的实践
中,我们最常将靶向药物处方作为全面治疗的一部分:我们将化疗,靶向治疗和免疫治疗相结合。
困难在于每个肿瘤在其“靶标”突变集中都是独特的正如每个人都有独特的DNA编码一样,肿瘤也是独特的。 毕竟,它们是从人体自身的细胞中“诞生”的。 没有具有相同遗传分子特性的肿瘤。 因此,根本不可能为癌症创建通用的“药丸”。 癌症太个别了。
但是基于我们确定他的肿瘤细胞突变的事实,对他的治疗应该是适当的-为特定患者单独选择。
在最近的过去,恶性肿瘤只能通过组织学进行分类,也就是说,取决于它们起源于哪个器官以及在显微镜下癌细胞是什么样的。
要有效地使用靶向疗法,这还不够。 医生应该知道特定患者的肿瘤细胞中存在哪些突变,该药物或该药物是否有生物标志物“靶标”。 就是个性化医学。
为此,我们使用分子遗传学研究。 要找到您需要用靶向和免疫治疗药物打中的“靶标”,您需要确定从哪些基因中收集肿瘤的DNA,以及其中的哪些基因被“破坏”。 结果:
- 我们了解了肿瘤对药物的敏感性;
- 找出肿瘤是否对某些药物有抗药性;
- 发现使药物过敏的遗传特征;
- 如果肿瘤不再对标准疗法产生反应,我们将选择一种新的疗法;
在非常早期就检测出肿瘤/转移-通过血液中DNA的片段; - 我们可以预测疾病的有利或侵袭性病程。
样本通常是肿瘤组织,可以在手术中去除原发灶或进行活检-用特殊的细长针截取肿瘤的微观部分。
您可以搜索血液中肿瘤细胞的DNA-然后需要进行所谓的液体活检,即两个装有8.5 ml血液的试管。
在活检过程中,我们经常会遇到这样一个事实,即许多患者害怕完全触摸到肿瘤-他们担心这会激发肿瘤的生长。 迄今为止, 尚无研究表明这种关系。 当然,必须正确进行活检。 当我们进行活检时,医生通常会标记出针的进入位置:要么做一个小的纹身(有这样的工具),要么就放一个支架(手术)。 如果以后需要进行手术,他们会切除针头的整个过程-从皮肤到肿瘤-因此我们使癌细胞扩散到肿瘤以外的机会更少。接下来,样品被送到分子遗传学研究实验室。在那里,从样品中分离出肿瘤DNA并进行测序。 即-他们“读取”“字母”的序列-核苷酸。 然后,他们将其与从图书馆数据库中选择的诊断小组进行比较-已经解密了成千上万其他人的基因组。 考虑到病史和临床数据,为每个患者选择面板。 当然,所有这些都是由自动音序器和计算机完成的。
而且如果20年前对基因组的“读取”花费了几个月的时间,它需要缓慢而复杂的解密,那么今天在我们与之合作的实验室中,将在几个工作日内完成分析。
此外,一次使用几种方法:
新一代测序(NGS),Sanger测序和荧光杂交方法(FISH) 。 它们一起使您能够读取肿瘤的整个DNA序列,找出驱动程序突变(即那些启动了恶性过程并且现在可以通过靶向疗法靶向的突变),甚至可以看到整个核型(染色体组)。
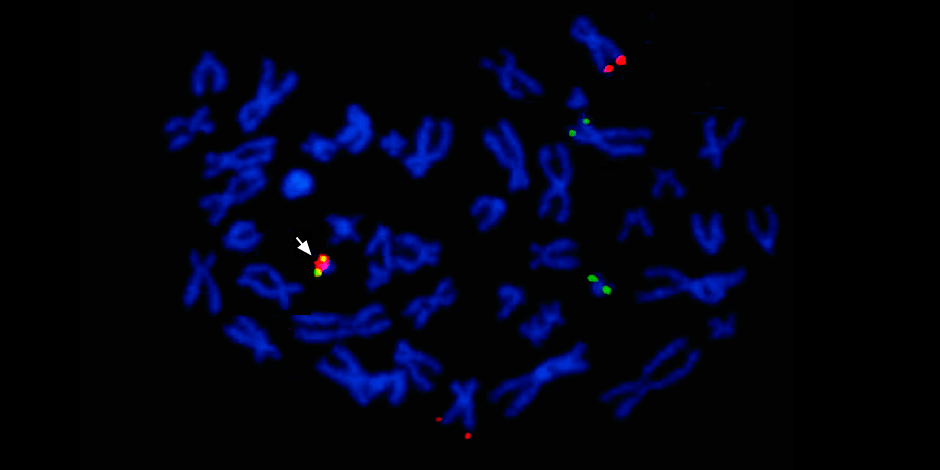 在向左的箭头下方-红色和绿色信号的融合-染色体9和22的遗传物质与嵌合费城染色体形成融合的证据。
在向左的箭头下方-红色和绿色信号的融合-染色体9和22的遗传物质与嵌合费城染色体形成融合的证据。此外,一项完整的分子遗传学研究必然会确定
微卫星不稳定性(MSI,微卫星不稳定性) ,这违反了DNA修复机制,导致细胞中突变的迅速积累。 这个因素使您可以对疾病的进一步发展做出预测。
获得肿瘤的分子遗传学特征后,对其进行分析特殊程序会处理结果并自动提出建议。 但是随后,这些建议必须由专家团队手动监督。 分析涉及遗传学,生物信息学,肿瘤学家,免疫学家和化学治疗师。 在此阶段,必须进行改进和添加。
根据要求,这样的研究可能需要
5到15个工作日 :一名患者只需要确定肿瘤的类型并阐明推荐的治疗方法-只需根据世界癌症协会的建议检查是否存在20种基本的DNA突变即可。 另外,对于罕见的诊断或对标准治疗的抵抗力,您需要制作肿瘤的“分子护照”,并为此对400个基因进行测序。
结果,在报告的第一部分中,所有在患者肿瘤中
发现的突变均已
注册 ,并且针对这种情况下最有效的靶向药物进行了
注册 。
靶向治疗被批准用于具有检测到的突变的这种类型的肿瘤,并且靶向治疗被批准用于治疗具有相同突变的其他类型的癌症。 在实践中,我们曾开出处方以外的二阶药物并行之有效的案例。
此外,实验室工作人员在监视科学研究方面做得很出色,这对于该患者而言可能意义重大。
该报告的第二部分回顾了当时存在的研究,并提供了有关该突变发生频率,不同药物作用以及使用一种或另一种类型靶向疗法治疗已鉴定突变的详细数据的详细数据。 这有助于使患者至少获得粗略的预后。
报告的第三部分包含相关的临床研究,患者可以参与其中以接受实验性治疗。 这是最新的紧急方法,但是了解有关此方法的所有详细信息有助于患者放心。
结果,从这份报告中,医生获得了恶性肿瘤最完整的分子遗传学特征。 他掌握了我们到底该如何对待,某个单元中有哪些具体故障的信息。 对当前批准或可用于临床试验的药物有“最新鲜”的了解。
 该报告非常重要-30页令人叹为观止的阅读
该报告非常重要-30页令人叹为观止的阅读谁需要这个?
对标准治疗方案的所有药物均产生了肿瘤耐药性或不耐受性的患者。
“每个人都尝试过-并没有帮助”的情况。, , (NCCN), « 24/7», – « » .
, 1- – , . . – – – 2- – , . – 3- , .. «» .
, , : , «» , . – . , , . – , , .
– «», . , off-label, . , ?
- , , . – .
. , . , , 80% , 20% – . , - , 80% , 20% .
- , , . , , . , : , , , . , , 10 – 10 .
30% – . , – : 600 . , , HER2/Neu.
. - – , – . , . 600 . ., 5 – , , , . .
- . . «» . , , , , ..
, . (, , ) – , .
, , «». – .
, , .
, 48 , ( ). , . , , . .
- . , 600 . , , 250, – , .
, . EGRF – .
4 . 5 , . , , 4 , .
,
« 24/7» , – .
.