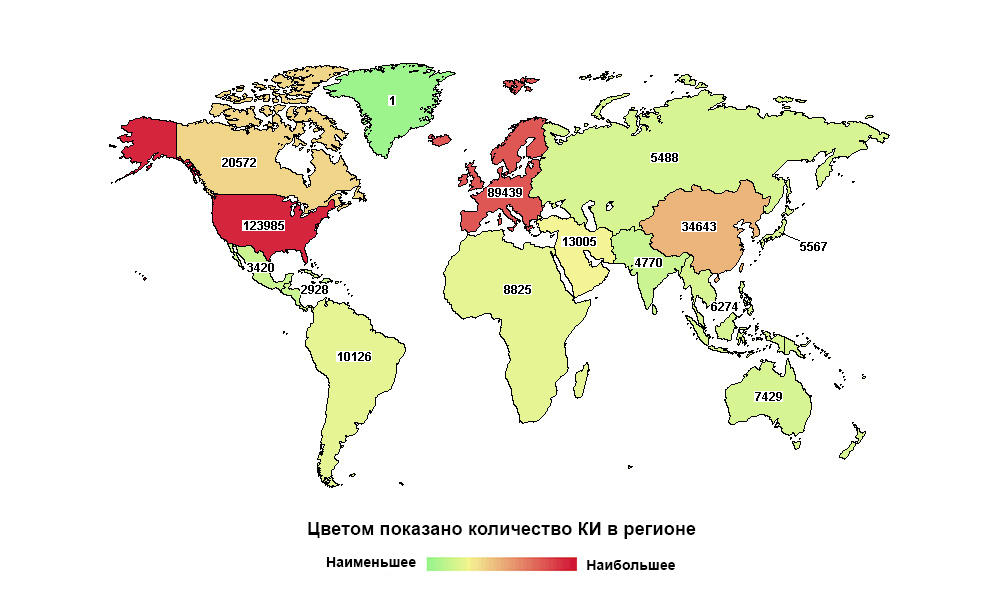
 俄罗斯远非世界第一,但其宏观区域的研究数量却第一
俄罗斯远非世界第一,但其宏观区域的研究数量却第一如今,在接触患者之前,任何药物都必须经过一系列的临床试验。 有必要证明它能够解决特定的健康问题,并且比以前的解决方案更有效,最好是更安全。
选择非常严格-所有研究的药物中有98%不能达到患者。 “新药”以“幸运药”的2%投放市场之前,对它的科学研究需要12年以上,超过15亿美元的资金。
我们在
医学24/7诊所直接参与临床试验。 我们已经连续第二年进行国外抗肿瘤药物的临床试验。 在我们的帮助下,新药可以更快地进入俄罗斯,每年有100余人免费获得另一种治疗机会。
对于私人诊所,这种做法是不寻常的:最小的商业利益,组织流程的太多困难以及对医疗机构的严格要求。 通常只有大型的联邦中心才能遵守这些规定。
但是对于俄罗斯的许多患者来说,对该药进行临床试验是获得致命疾病免费治疗的唯一机会。 但是在俄罗斯癌症患者中,有30%的人根本不知道什么是临床试验,只有少数人参加了试验。
因此,我们希望尽可能多的人学习和检查:也许他们有机会获得可以挽救生命的药物。
在本文中,我们将解释我们为什么需要以及如何组织临床试验,谁以及如何到达那里。
悲伤的故事。 为什么需要临床试验,为什么没有它们就不好
临床研究/试验(以下简称CI) -以人为主体的科学研究,旨在评估新药的有效性和安全性或扩大使用已知药物的适应症。 除药物外,CI还可以研究新的治疗和诊断方法的功效和安全性。
医学正在发展,并变成一门精确的科学,没有统计数字就无法做到。
以前,家庭医生非常了解他所有患者的故事,医生可以一生都住在一个小镇上,找到并记住个人对待每个人的方法。 而且,药水的选择很小:草药,水ches,汞和砷。 在“上帝的所有旨意”对医生的假设中,责任减少了。
 从十八世纪末开始的砷“恢复”效力和“治愈”关节炎...
从十八世纪末开始的砷“恢复”效力和“治愈”关节炎... ……例如,汞是泻药,是“来自梅毒”。
……例如,汞是泻药,是“来自梅毒”。当医学广泛传播时,医生需要制定真正无误的治疗策略。 在某些情况下,某些药物应该可以帮助大多数患者。
理想情况下,医生应仅使用获得“随机结果”可能性极低的那些预防,诊断和治疗方法,因为它们的有用性和有效性已通过许多正确进行的实验证明。
这是
循证医学 ,是当今人类健康等严重问题的唯一适当方法。
而
临床研究是循证医学的基础。
直到20世纪中叶为止,还没有关于新药研究的规定。 为了恢复秩序,经常发生两次悲剧。
1937年,有105名儿童和一名成人丧生,他们服用了消毒剂磺酰胺和有毒的二甘醇中的“ elixir”。 是的,今天用于防冻液中的那一种。 然后,制药公司
ME Massengill不知不觉地将其用作溶剂,赋形剂。 尚未对由此产生的人类“鸡尾酒”进行安全性研究。 当他们突然意识到并从销售中扣押毒品时,已经有一百多名受害者。 1938年,美国国会通过了一项关于强制销售毒品的强制性研究的法律。 对此的控制权已委托给FDA(
英国食品药品监督管理局),食品药品管理局在1950年代末和1960年代初,
沙利度胺发生了更大的丑闻。 “舒缓和安眠药,完全有助于孕妇中毒”迅速售罄。 他的研究仅在大鼠上进行。 事实证明,这还不够。 在人类中,沙利度胺会导致胎儿发育缺陷。 在欧洲,澳大利亚和日本,大约有10,000名儿童出生时四肢畸形。 1961年,大多数国家都禁止使用该药。
 这些孩子的妈妈喝了未经人类测试的安眠药
这些孩子的妈妈喝了未经人类测试的安眠药从那时起,药物在注册之前已经经过仔细研究。 这受《
国际药品质量管理规范三方规则》(《 ICH药品质量管理规范三方指南》(简称ICH GCP))的约束
。 从1996-97年开始,他们在美国,日本和欧盟开展业务,从2003年开始将其引入俄罗斯。研究进展如何,为什么持续了这么长时间?
制造毒品的整个过程可以分为三个大阶段。
1.在体外和动物中寻找想法和临床前研究。
2.如果还没有结束,那么就对人们进行临床研究:首先要小心,然后要进行更大的研究。
3.然后,该药物在监管机构中注册,成为医疗目录中的熟悉名称。
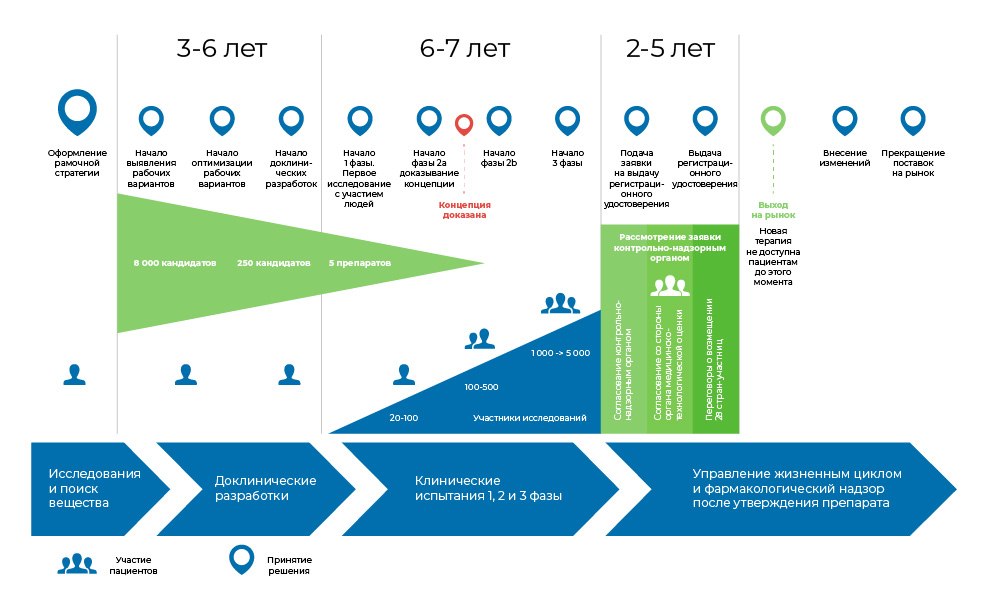 开发药物的过程。 从创建分子到药物开始销售,这需要8到20年的时间。那么有人需要吗?
开发药物的过程。 从创建分子到药物开始销售,这需要8到20年的时间。那么有人需要吗? 就未满足的药物需求而言,肿瘤学是医学上最糟糕的领域之一。 根据世界卫生组织的数据,2018年,癌症
导致 960万人死亡。 当仅剩下姑息治疗时,通常在晚期发现肿瘤。
同时,分子生物学和遗传学领域的发现使人们有可能了解导致癌症发生和发展的机制,并增强了对抗肿瘤免疫工作的理解。
如今,抗肿瘤药物的开发已成为科学最密集和最受欢迎的领域之一。
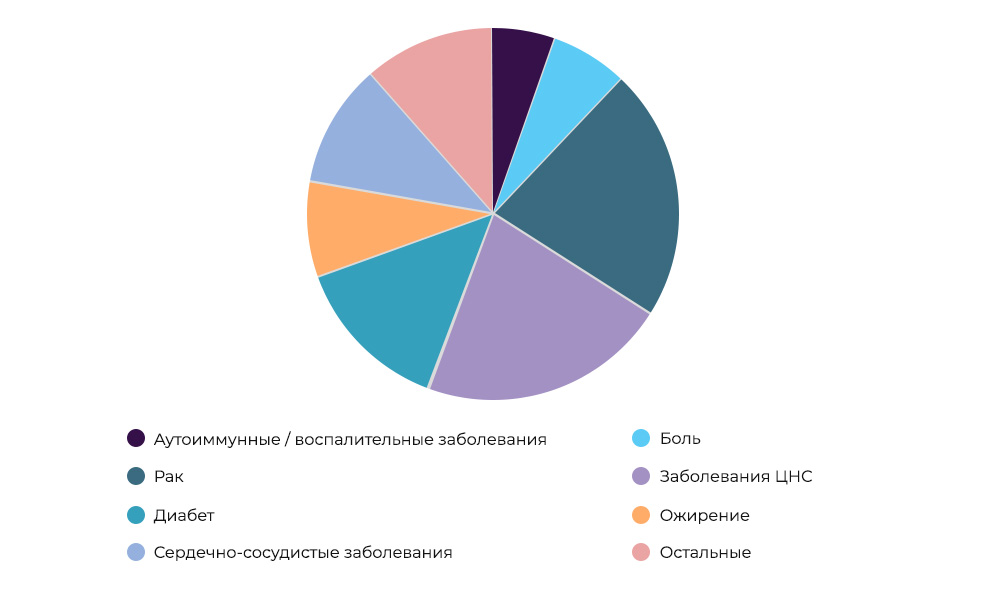 抗癌药物研究-全球23%的CI谁为这项研究付费。
抗癌药物研究-全球23%的CI谁为这项研究付费。 有时组织者和赞助者可能是研究组织。 但是更多时候,科学家从事科学研究而不是制药公司。 那些希望通过成功的药物进入市场,获利并弥补CI和开发成本的人。 这就像购买一部新电影以租借一部电影:发行商不知道他是否会“拍摄”。 生产新药是非常冒险的业务。
以前,许多制药公司都是靠科学家的力量自己进行研究的。 现在,已经通过认证并满足某些要求的医疗机构可以成为该实验的平台和执行者。
我们的
“医学24/7”就是这种情况。 制药公司已准备好付款,但在研究结束时会根据产生的费用分配资金。 该诊所没有任何超级利润。 而且研究医生通常不会在平时的薪水之外赚任何钱。 相反,这是诊所负责人的职位:一个人认为向前推进该国的药物是正确的,并借此机会参与其中。
首先想到一个主意。 其实,要调查什么? 在肿瘤学中,首先找到“靶标”-该病的薄弱环节。 如果您破坏或简单地“关闭”靶分子,则肿瘤将“遭受痛苦”。 许多现代的
靶向或
免疫治疗癌症药物都建立在这一原理之上。
 靶向药物在大肠癌中的作用机理。 癌细胞停止分裂,或向肿瘤生长其他血管,或者该药物保护邻近细胞免于恶性肿瘤
靶向药物在大肠癌中的作用机理。 癌细胞停止分裂,或向肿瘤生长其他血管,或者该药物保护邻近细胞免于恶性肿瘤要找到此类物质,然后选择最合适的候选物,需要大量的资源和时间进行
体外和硅质研究 -即体外或使用计算机模拟。
所选择的物质以适当的数量存储-根据特殊规则生产(在俄罗斯为GOST R 52249-2009),没有杂质和技术违规。 借助这些试管,科学家们可以在动物身上测试这种药物。
鼠标是进步的动力。 在体外测试了想法之后,提供了潜在药物的科学家来到了动物饲养箱-您需要检查原型在哺乳动物体内的行为(体内)。
即使在1025年,阿维森纳(Avicenna)在《医学正典》中写道,必须对药物进行检查。 此外,对于潜在的患者,最好是一个人。 毕竟,从狮子和马身上获得的结果并不能保证药物会以同样的方式影响人们。
而且仍然在医学上,没有对动物的实验-无法做到。 然而,狮子和马匹却被独自留下。 全世界的临床前研究主要在小鼠,豚鼠和兔子中进行。
 实验室老鼠甚至在新西伯利亚研究院上都放了一座纪念碑
实验室老鼠甚至在新西伯利亚研究院上都放了一座纪念碑在此阶段,检查药物的危害性/安全性:
- 它会引起过敏吗
- 对组织和器官有毒作用吗?
- 它如何影响动物的繁殖能力和胎儿的正常发育等
此外,他们观察候选药物在动物体内的行为(药代动力学):
- 吸收率和血液浓度增加,
- 最大和最小剂量是多少
- 它从体内排泄的速度,等等。
需要所有这些数据来确定
是否可以将测试物质用于人类。 如果是这样,则需要多少。
不可避免的邪恶。 官僚主义 国务院监督 CI
的正确进度
。 卫生部和联邦医疗保健监督局(Roszdravnadzor)对药品流通的监管。如果科学家到了必须进行人体临床试验的时刻,那么该准备进行CI的申请了。 为此,他需要几个
文件 。
- 研究药物的档案。 关于该药物的所有发现:药代动力学,有效性,毒性等数据。
- 研究方案 它详细说明了未来研究的计划和评估结果的方法;
- 研究员手册。 简短的备忘单可向志愿者和患者明确说明研究的实质,并征得他们的知情同意。
道德委员会。 任务的下一个阶段是获得道德委员会的评估和结论。
道德委员会由医生,科学家,医务人员和非专家(公众)组成的独立团体。 他们研究研究方案并获得知情同意,以确保患者,研究人员,制药公司和国家监管机构之间达成协议,没有人的权利受到侵犯,没有人受到胁迫,并且没有人侵犯自由意志。
在2006年从一种药物产生严重的副作用后,道德委员会变得更加严格。 因此,有时研究可能会在此阶段“冻结”一年或更长时间。
在检查了所有文件并获得伦理委员会的批准后,潜在的药物进入了
人类的
临床试验阶段
。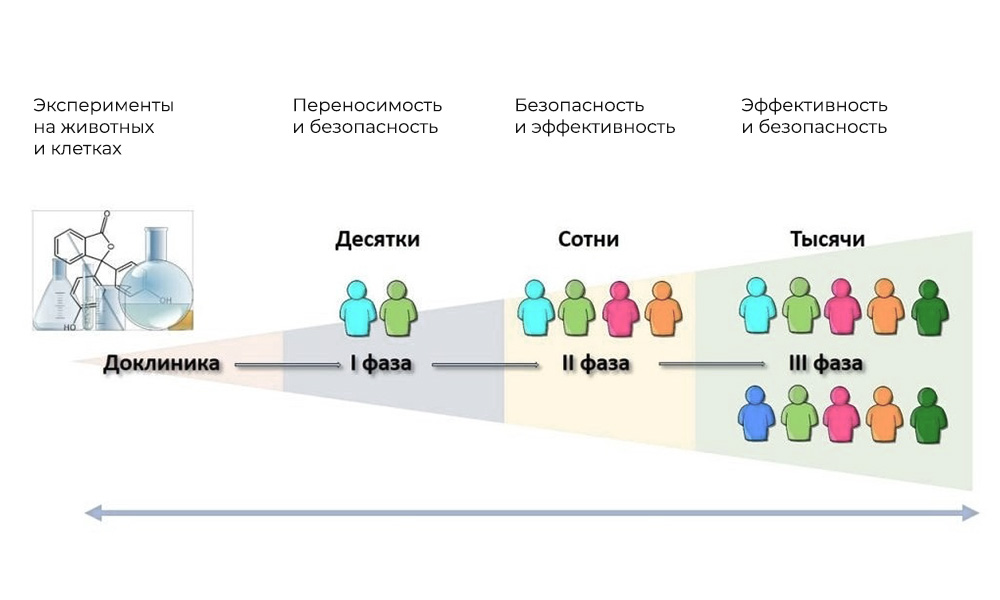 临床试验的主要阶段是在人类中。
临床试验的主要阶段是在人类中。第一阶段:测试作用机制
参加人数
: 20-100人。
时间:从几个月到1年。
目的:研究耐受性,药效学和药代动力学。
检查该物质是否以与动物相同的方式作用于人类,是否安全。
从理论上讲,在临床研究的第一阶段,应由健康的志愿者参加,但是在健康的身体中对有效物质进行肿瘤学测试不能被认为是道德的。 因此,涉及到具有相应疾病的人,未来的药物可能会有效。
从允许的最小剂量到最大剂量,逐渐向参与者注射所有更大剂量的药物。 每次给药后,都要监测患者的状况。
对药代动力学进行了评估 :吸收速率和排泄(未改变物质的排泄),在组织和器官中的分布。 还评估了
药效学 :药物对肿瘤细胞,其他器官和器官的副作用。 明确了优选的应用和剂量水平。
除了增加剂量的研究外,在第一阶段检查:
- 食物对药物的影响;
- 与其他药物的相互作用;
- 可能影响所需药物剂量的其他疾病的影响(例如,在肾衰竭患者中)。
根据
FDA的说法,有70%的药物成功通过了CI的第一阶段。
第二阶段 检查既定目标的行动:特定类型的疾病
参加者: 100至500位患者。
时间:从几个月到两年。
目的:测试某些适应症的有效性
有必要研究将新药与安慰剂或现有疗法进行比较的效果。 另外,更多的参与者可以检测到阶段I中未检测到的罕见副作用。
为了参与CI的这一阶段,根据比第一阶段要多得多的标准选择患者。 例如,不仅是“乳腺癌”,还包括“乳腺癌,T2N1M0期,HER2阳性亚型”。
通常,此阶段的研究以
双盲,随机,安慰剂对照进行。双盲:医生和患者都不知道谁正在接受活性物质,谁正在接受安慰剂或目前存在的最佳治疗方法。
随机化意味着使用随机数生成器将患者随机分组。 医生或CI参与者都无法影响此过程。
安慰剂对照是指一组中的参与者将在与另一组中被给予活性物质的参与者相同的条件下接受安慰剂。
 每个人-药物的外观,味道和气味相同。
每个人-药物的外观,味道和气味相同。所有这些“阴谋神学”都需要排除参与者或研究人员对实验数据的故意或无意识的扭曲。
因此,在没有如此严格要求的第一阶段中,会有惊人的结果。 这是一个“肮脏”的统计数据;在第二阶段,它被清除了多余的数据,结果变得合理。
根据FDA的说法,进入第二阶段的药物中只有33%成功通过CI并进入下一阶段。
第三阶段 支持研究
参加人数: 300-3,000或更多。
持续时间:一年到几年。
目的:确认大样本中被测物质的有效性和安全性。
这是药物开发过程中最大,最复杂,最昂贵的部分。 此类研究的目的是确认被大量患者使用时测试物质的有效性和安全性。
根据此阶段的结果,药品制造商将获得许可将其推向市场。
在第三阶段,来自不同国家的数千名患者可以参加。 一切都应以最小的细节进行计划,以便在研究的所有地方其设计和重要条件都完全相同。
该研究的设计是如此狭窄,以至于不仅垂死的患者,而且预后稳定的患者都可以进入研究。 这种药物应该非常安全,可以送给实际上健康的人-而且生活质量不会降低。
在第三阶段开始之前,研究人员和第三方专家之间进行了许多磋商和讨论:考虑实验设计非常重要,以免错过重要的实验并获得所有必要的数据。
在第三阶段,新药的有效性和安全性以及剂量反应关系最终得到确认。
分析了优势与风险的相关性。 根据结果,监管机构决定是否有可能将该药物推向市场。 为此,必须满足以下条件:
- 该药物比以前已知的类似物更有效,
- 副作用更少/耐受性更好
- 当先前已知的药物无效时有效,
- 经济上更有利可图,
- 更容易使用。
主管对申请的审核过程需要12到18个月。
根据FDA的说法,在第三阶段开始时,只有25-30%的病例在第三阶段临床试验中获得了积极的结果。
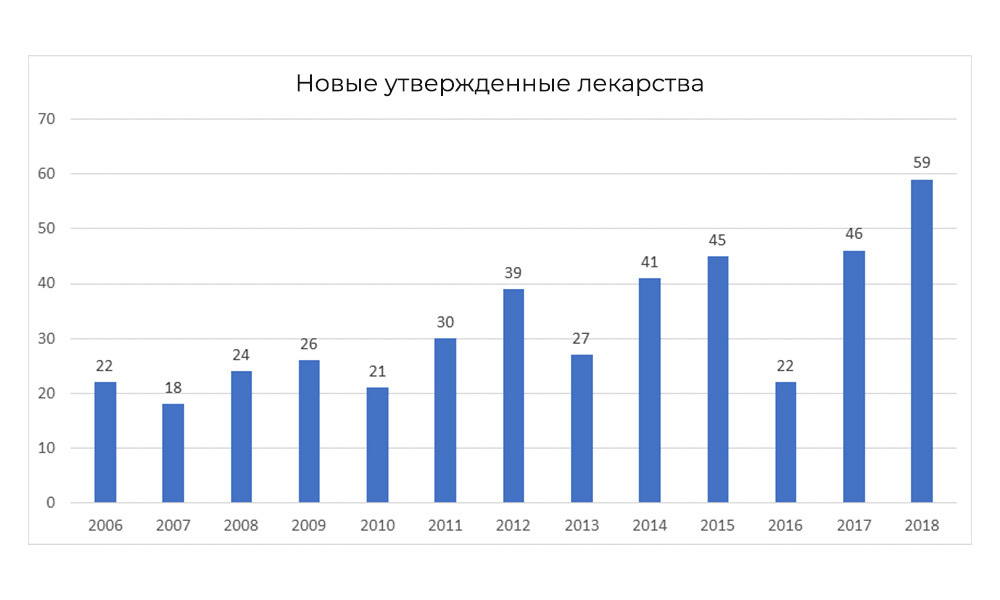 但是,在2018年,FDA打破了其批准药品数量的记录。
但是,在2018年,FDA打破了其批准药品数量的记录。国家研究的特点:俄罗斯CI的新阶段
俄罗斯对新药的控制有其自身的错误(或功能,外观)。 根据法律,获准使用的外国药品必须在俄罗斯进行其他临床试验:据推测,这将提高外国药品的质量。
当该药物已经通过三个阶段,并开始向世界市场销售时,在我国它可能仍未注册。我们知道它是有效的,在其外语说明中,有迹象表明在美国,加拿大或欧洲的3个研究阶段已得到证实。假设有12种适应症-12种可以有效治疗的诊断。但是在俄罗斯,并不是所有这些适应症都得到了官方确认,只有12个中的6个。如果患者的确切癌症类型尚未在俄罗斯联邦正式注册,则他将不会免费获得这种药物作为强制性医疗保险的一部分。这使患者使用新药的时间减慢了2-3年。24/7 Medicine参与了III期研究。这就是我们为加快药品注册流程做出的贡献。制药公司掌握所需患者人数的数据越快,药物被“采用”的速度就越快。首先是世界各地,然后是我们。结果,根据强制性医疗保险,我们影响到每个人都可以接受它-不仅在私人诊所,而且在任何州的肿瘤科室都可以接受。此外,对于我们的患者而言,参与III期临床试验是获得充分验证和安全的新治疗的机会-无需等待几年就可以正式“到达”俄罗斯。不幸的是,我们的人数很少。并非每个诊所都可以接受CI。首先,诊所必须具有GCP证书“良好临床实践”。其次,至少应有两名研究人员。它们也有证书,而且很难获得:它们是由药品生产国的监管机构签发的。在我们的案例中,这些是美国和法国。两名医生接受了六个月的检查。第三,诊所本身。必须要有一个复苏部门,自己的实验室,合格的护士,正确校准必要的机器,某些用于存放药物和文件的房间,没有照相机的匿名房间(供患者使用)。第一次开始时,我不得不重新配置一些房间和病房:直到新床为止,所有都根据KI的设计。总之, 对于不同的药物-不同的冰箱,总而言之,那些想要这样做的诊所和医生仍应尝试创造某些条件。
对于不同的药物-不同的冰箱,总而言之,那些想要这样做的诊所和医生仍应尝试创造某些条件。学习怎么样
在完全保密的气氛中,规定了研究的设计和规程,将物质本身和厚达1200张的文件夹送给我们。每个小事都会在这里显示出来:我们应该如何,在什么时间,以什么剂量给药,多长时间和多少血液进行分析,进行什么测试,多久进行MRI和CT检查。一天多少次以什么形式发送“加密到中心”-向KI的组织公司报告。我们招募2或3组患者,并与他们签署知情同意书。通常,人们出于以下两个原因同意参加临床试验:- 缺乏有效的疾病治疗方法,
- 渴望为科学的发展做出贡献。
无论如何,这是完全自愿的决定。要求研究人员向患者提供有关CI的目的,如何管理,使用何种药物等信息。所有这些都反映在特殊的文件知情同意书中。每位参加研究的人都可以免受生命和健康伤害。我们的患者从未拒绝过-对于他们来说,这是一个令人难以置信的机会,可以免费接受其他治疗方法用尽的治疗。当然,将所有人带入研究是行不通的。要求是“从上方”给出的,这是一组非常狭窄的参数:参与者应该多大了,有什么确切的诊断,没有/没有进行过手术,血液中的肌酐和铁水平在小数点前。但是我们有很多癌症患者。如果客户承认没有治疗费用,我们一定会检查参加研究者的要求。他有可能找到一个地方。目前开放了一组18项大规模研究。当然,私人诊所的规模根本不是大型研究机构的规模,而是通常每周有3-4名患者参加研究方案。费用很多:每月至少有10个人免费获得最先进的先进治疗。而且他们自己还有更多的机会,将来的患者在CI结束时更有可能获得这种药物。患者不一定会一直在诊所里-如果CI的设计没有禁止它并且患者感觉良好-他会在门诊患者的基础上参加。过来,拿起他的滴管离开。有些人最好在监督下留在诊所。由于长期严格执行一长串要求,持续监控患者的病情,整合数十个参数的数据,我们正在做即将发表的研究,来自该国所有癌症中心的所有医生都将使用该结果-扩大的使用新药的能力。现在有数十人得到治疗的机会。我们希望本文对您来说是有趣的一读。但是,如果这个话题很接近您,请在RosOncoWeb,CTAgency和卫生部的网站上查看临床试验清单。并且请务必与“医学24/7”的肿瘤学家联系-您需要抓住机会。