对抗衰老有几个方向。 其中之一是与年龄有关的神经退行性病变,阿尔茨海默氏病和帕金森氏病。 尽管积极研究了它们的分子机制,但他们还没有学会抵抗它们。 对于最容易发生神经退行性变的老年人来说,这已成为一个大问题。 抗神经退行性疾病疗法的失败促使科学家寻找与神经病理学发病机制有关的其他关键因素。 我们将在这篇评论中考虑其中的一些。
阿尔茨海默氏病(AD)是老年人痴呆症最常见的形式,其临床表现为进行性认知和功能障碍。 根据官方数据,今天,全世界有4750万人患有痴呆症。 每年有770万新病例被登记。 预计到2030年,痴呆症患者的人数将增加到7560万,到2050年将增加到1.355亿。 今天,年龄被认为是增加AD风险的主要因素。
病理学AD通常以在老年斑中β-淀粉样肽(Aβ)在细胞外积累和高磷酸化tau蛋白的细胞内沉积为特征,其形成神经原纤维缠结。 遗传上,载脂蛋白E等位基因(APOE)(ε2,ε3和ε4)对AD的发展具有各种风险。 与具有更常见的ε3等位基因的个体相比,具有ε-4等位基因的个体具有更高的风险,而ε2等位基因则具有降低的风险[1]。 不久之前,事实证明,AD的发病机制历史悠久,大脑中淀粉样蛋白的沉积可在临床症状出现之前10至20年[2]。 有证据表明AD与中枢神经系统和周围的慢性炎症有关[3-5]。 尽管进行了长期的研究,AD的治疗尚不存在。 迄今为止,所有尝试产生有效疗法的尝试均以失败告终。 因此,科学家正在寻找这种疾病的新方法。
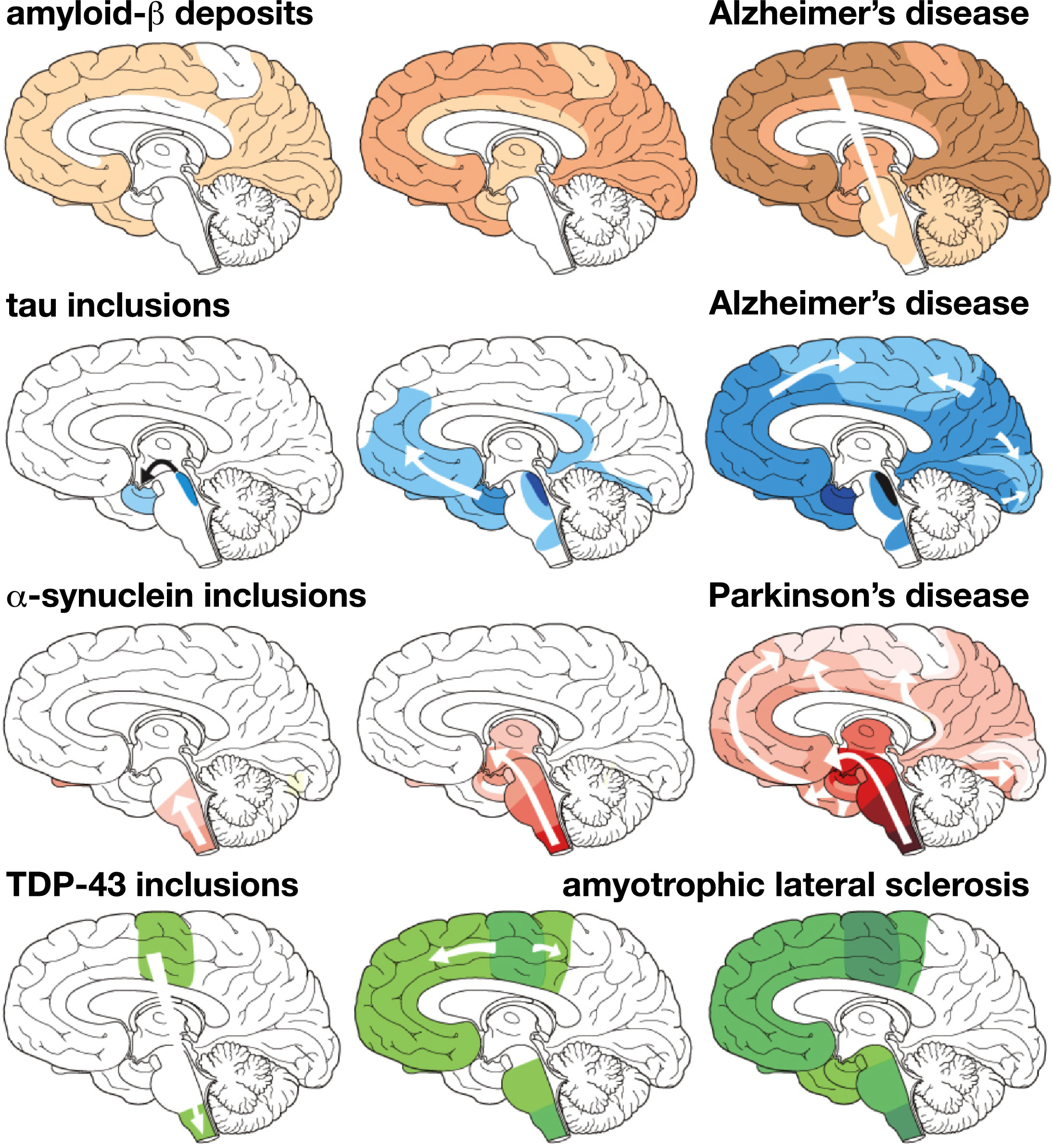 图 1神经变性疾病中特定蛋白质损伤的特征性进展,由验尸后的大脑测试确定。 β淀粉样蛋白沉积在阿尔茨海默氏病中; 阿尔茨海默氏病中的tau蛋白; 帕金森氏病中的α-突触核蛋白; TDP-43用于肌萎缩性侧索硬化症。 进行性神经退行性变的三个阶段,从左到右,用白色箭头指示所称的病灶扩散[54]。
图 1神经变性疾病中特定蛋白质损伤的特征性进展,由验尸后的大脑测试确定。 β淀粉样蛋白沉积在阿尔茨海默氏病中; 阿尔茨海默氏病中的tau蛋白; 帕金森氏病中的α-突触核蛋白; TDP-43用于肌萎缩性侧索硬化症。 进行性神经退行性变的三个阶段,从左到右,用白色箭头指示所称的病灶扩散[54]。钙和线粒体功能障碍
因此,今年8月,《自然通讯》刊登了约翰·W·埃罗德(John W. Elrod)等人的一篇文章,“违反线粒体钙的流出有助于阿尔茨海默氏病模型中疾病的发展”。 在其中,基于获得的结果,作者假设线粒体功能障碍和钙超载在阿尔茨海默氏病的发展中至关重要[6]。
接下来是天普大学卫生系统对本文的引用。
“有时候,一个人尝试解决看似微不足道的问题的努力越多,情况就越糟。 事实证明,这些细胞的作用类似,试图弥补因轻度不足或功能障碍而引起的后果可能会变得很糟糕。
就阿尔茨海默氏症而言,研究人员表明,线粒体钙转运的重塑-似乎是细胞试图弥补能量减少和代谢功能障碍的一种尝试-最初可能有用,最终变得不适应,从而导致线粒体功能和认知能力下降。
发表在《自然通讯》杂志上的一项新研究首次将线粒体中钙转运的非适应性变化(即产生能量的细胞)与阿尔茨海默氏病的发展联系起来。
研究负责人约翰·W·埃罗德(John W. Elrod)解释了这一发现的实质:“淀粉样蛋白沉积和tau病理被认为是阿尔茨海默氏病的主要原因,因此,它们是疗法发展的主要方向。 但是,针对这些途径的主要临床试验在各地都失败了。”
“但是到目前为止,还没有人研究过钙转运改变的影响
线粒体往返阿尔茨海默氏病的进展。 我们目前的研究为阿尔茨海默氏症的发病机理提供了这两个假设之间的缺失联系。”
线粒体中的钙转运在许多细胞功能中起着重要作用,并且需要多种蛋白质的有效参与。 该过程的关键调节剂之一是一种称为NCLX的蛋白质,该蛋白质先前在J. Elrod实验室中发现,参与调节心脏细胞中钙的转运。 NCLX表达对于神经元中线粒体钙转运也很重要。
在一项新的研究中,约翰·W·埃罗德(John W. Elrod)及其同事研究了神经元摄取线粒体钙在阿尔茨海默氏病中的作用。 为此,研究小组使用了一个阿尔茨海默氏病小鼠模型,其中的动物具有三个基因突变,这些突变导致与年龄相关的病理变化,与人类阿尔茨海默氏病的进展相当。
随着带有三个突变的小鼠的年龄增长,研究人员观察到NCLX表达的稳定下降。 这种减少伴随着限制线粒体钙积累的蛋白质表达的减少,这导致破坏性的钙超载。 NCLX的损失还与细胞破坏性氧化剂的产生增加有关。
为了更好地了解NCLX丢失的生理意义,科学家完全抑制了NCLX在阿尔茨海默氏症小鼠脑中的表达。 对这些小鼠的脑组织的分析表明,NCLX的减少和随后线粒体钙流出的损失加速了淀粉样β的积累和tau病理。
“我们的结果表明,通路的适应不良性重塑可补偿钙的失调,这可能被设计成维持细胞中的能量产生,从而导致神经元功能障碍和阿尔茨海默氏病病理。 而且,我们的数据表明,在阿尔茨海默氏病的发展过程中,淀粉样蛋白β的积累和tau病理学实际上位于线粒体功能障碍之下,这开辟了新的治疗方向。” [7]
肠道菌群和饮食
除了线粒体和钙外,饮食和肠道菌群也可能显着影响AD的发展。 自2014年以来,研究人员已经显示出包括肠道在内的病原微生物在AD的发生和发展中的潜在作用。 众所周知,肠道菌群是人类健康的重要组成部分。 肠道微生物对人体健康具有关键作用,包括能量提取,维生素的生物合成,防止病原体过度生长等。肠道微生物在分娩时发生定植,在婴儿期非常活跃,并在大约3岁时发展为成年结构。
已经确定,复杂的微生物生态系统的组成变化与各种胃肠道和代谢性疾病的发展有关,包括炎症性肠病,肥胖症,胰岛素抵抗和糖尿病[8]。 最近,人们对肠道菌群对中枢神经系统功能的影响给予了极大关注,中枢神经系统通常被称为肠轴-脑。 肠道微生物组的变化与神经系统疾病有关,包括自闭症谱系障碍,多发性硬化症和帕金森氏病[9-11]。
AD动物模型的研究表明,肠道菌群的改变会影响淀粉样蛋白的沉积速率[12,13]。 与患有年龄和性别的对照组相比,在患有AD的人群中,科学家观察到肠道微生物组的微生物多样性下降。 检测到细菌类型之间的差异,包括AD人群微生物组中的菌毛和放线菌(包括双歧杆菌科)减少,拟杆菌属的增加[14]。
与其他因素一起,饮食可能在AD病理中起作用。 罹患痴呆症的风险增加与饱和脂肪和简单碳水化合物含量高的饮食有关,这被称为“西方”饮食。 相反,单价和多价不饱和脂肪,蔬菜,水果和低脂蛋白质含量高的饮食与降低AD的风险有关[15-17]。
2013年,教科文组织将地中海饮食纳入“人类非物质文化遗产代表作名录” [18]。 地中海式饮食是一种均衡饮食,其特点是大量摄入纤维,橄榄油,水果,坚果,蔬菜和谷物。 适量食用鱼类和家禽; 乳制品,红肉,肉制品和糖果的消费量低。 以及适度饮用葡萄酒[19]。 已经发现,地中海饮食与某些慢性疾病,例如肥胖,2型糖尿病,癌症,心血管和神经退行性疾病(包括阿尔茨海默氏病)的发生频率降低有关[17、20、21]。
尽管尚不清楚其基本机制,但最近的证据表明,肠道微生物组和微生物代谢产物的调节是介导地中海饮食健康影响的可能因素之一[20,22]。
在患有轻度充血性疾病的人中,科学家发现某些细菌与脑脊液中阿尔茨海默氏病的标志物有关。 改良的地中海生酮饮食(MMKD)改变了肠道微生物,并降低了AD主要标志之一Aß42的水平。 MMKD减少了碳水化合物的摄入,饮食的主要部分是来自橄榄油和鱼的脂肪和蛋白质。 生酮饮食的作用机制有多种,包括神经元过度兴奋性降低,线粒体代谢增加,氧化应激降低和mTOR抑制,都可能影响AD的病理过程[23]。
MMKD饮食6周后,轻度认知障碍的参与者(通常在AD之前)表现出乳酸盐的减少和丁酸盐的增加,以及肠道微生物组的阳性变化和脑脊液Aß42的减少[24]。
为了证实肠道菌群在AD发病机理中的重要作用,今年立即发表了三项关于粪便菌群移植的研究。 用AD模型将健康小鼠的正常肠道菌群移植到转基因小鼠中。 在所有情况下,AD动物的状况都有明显改善:“我们的结果表明,FMT(粪便微生物群移植)的使用可以改善认知缺陷并减少转基因(Tg)APPswe / PS1dE9小鼠大脑中淀粉样蛋白(Aβ)的沉积。 这些改善伴随着tau蛋白磷酸化以及Aβ40和Aβ42水平的降低。 我们观察到Tg小鼠突触可塑性增加,而FMT后PSD-95蛋白表达和突触素I表达增加。 我们还观察到FMT后Tg小鼠的COX-2和CD11b水平降低。 我们还发现,使用FMT会引起肠道菌群和SCFA(短链脂肪酸)的变化。 因此,FMT可能是AD的潜在治疗策略[42-44]。
神经病理学的本质
今年也是关于阿尔茨海默氏病的另一重要新闻。 公布的第一项前瞻性研究显示输血后AD的风险增加。 研究组由63,813名接受输血的患者组成,对照组的人数相同。 随访期为10年。 结果表明,与未接受输血的人相比,接受输血的人患痴呆症的风险高1.73倍,而患阿尔茨海默氏症的风险高1.37倍。 接受冲洗后的红细胞输血的患者患痴呆症的风险是未接受冲洗的患者的2.37倍[45]。
尽管作者的结论很谨慎,但这一重要发现的可能原因之一可能是阿尔茨海默氏病的the病毒性质。 值得详细说明。
该主题的首批突破性作品之一于2015年发表在《自然》杂志上。 塞巴斯蒂安·布兰德纳(Sebastian Brandner)及其同事检查了死于Creutzfeldt-Jakob病或“疯牛病”的人的脑样本。 这种疾病具有a病毒性质。 注射了生长激素病毒后,被科学家研究过的人被感染。 他们的平均年龄为36-51岁,除了病毒,他们的大脑组织还含有淀粉样β的积累。 所有这些人都没有阿尔茨海默氏病的遗传易感性。 此外,科学家检查了116例年龄相同且超过10岁的其他病毒病患者。 接受检查的人中没有一个显示出大脑中淀粉样β的积累。 这使科学家们认为淀粉样蛋白β出现在克雅氏病患者的大脑中,其原因与病毒相同,这是注射液感染生长激素的结果[46]。
2018年,该科学家团队又发表了两篇作品。 Nature发表了他们的文章,其中他们报道了从人类垂体中获得的导致obtained病毒病发展的生长激素样品的研究结果。 “鉴于我们的假设对公共健康的重要性,我们已开始鉴定和鉴定c-hGH(生长激素)档案小瓶。 在这里,我们显示Creutzfeldt-Jakob病理和Aβ簇患者使用的某些批次的c-hGH具有显着水平的Aβ40,Aβ42和tau蛋白。 并且这种物质可以在表达人类淀粉样蛋白前体蛋白的小鼠中引起Aβ斑块的形成和脑淀粉样蛋白血管病。 这些结果证实了已归档的c-hGH小瓶中存在Aβ,并且与所谓的医源性(即通过医疗程序介导的)Aβ病理学向人类的传播相一致”,研究作者得出结论[47]。
在同年的第二项工作中,S。Brandner等人。 提供的数据表明在神经外科手术过程中可能会感染β-淀粉样蛋白。 “在这里,我们介绍了四名在童年或青春期接受神经外科手术并且在大约三十年后接受了由严重的脑淀粉样血管病(CAA)引起的脑出血的患者。 这些患者均无与Aβ病理学早期发展相关的致病突变。 此外,我们在文献中确定了四名有神经外科干预史和随后发生CAA的患者” [48]。
一年以前,中国科学家的轰动性研究引起轰动。 在健康和转基因小鼠中,AD合并了血流,导致大脑正常野生动物的淀粉样β积累。 实际上,淀粉样蛋白感染是通过血液从患病的动物到健康的动物发生的。 “在这项研究中,使用APsswe / PS1dE9转基因AP小鼠与野生野生动物之间的共生模型,我们发现源自转基因AD模型小鼠的人Aβ进入血液循环并积聚在野生型小鼠的大脑中,形成了脑淀粉样血管病在共生12个月后出现Aβ斑块。 在野生型共生生物小鼠的大脑中发现了与Aβ积累相关的AD型病理,包括tau过度磷酸化,神经变性,炎症和微出血。 据我们所知,我们的研究是第一个揭示源自血液的Aβ可以穿透大脑,形成与Aβ相关的病理并引起神经元功能缺陷的研究[49]。
根据the病毒原理,关于这种感染可能性以及β-淀粉样蛋白进一步传播的假说的重心是由the病毒的发现者诺贝尔奖得主斯坦利·普鲁兹纳(Stanley Pruziner)的发现者支持的。 在2019年,S。Pruziner及其同事的工作出现在《科学转化医学》中,他们在其中为这一假设提供了新的证据[50]。
引起注意的是:AD之后的第二和第三最常见的神经病理学(帕金森氏病和肌萎缩性侧索硬化症)也可能以a病毒样方式传播到全身。 对此有许多研究[51,52]。 因此,如2019年最新研究所述,帕金森氏病主要参与者α-突触核蛋白簇首先出现在肠道中,然后穿过through病毒等其他组织。 , - , , 20 . “
, . , , , , , — . — , . , , , , ” — , P. Borghammer [53].
«» Z. Zhang . , , - (AEP), - AD, - , [54].
, . . 2019 , J. Weickenmeier ., . , , : «
, , . — ». [55].
, AD. , Shelley J. Allen ., AD
P. acnes . "
P. acnes , , , - . , , , , . ( Propionibacteriaceae ) , , ; , , . , Actinobacteria (
P. acnes ) AD .
P. acnes " — [56].
“” AD
, . . — , , . AD, , - -. , GHSR1α. D1 (DRD1). DRD1 GHSR1α Gαq-Ca 2+, .
GHSR1α , , AD.
, , AD AD. , ( ) , .
, β- GHSR1α. , GHSR1α- DRD1 AD. AD , , MK0677 SKF8129. GHSRr1α β-, [25].
, – «» , . , 3 .
, AD . (MetS) AD. AD. AD (IR). IR MetS, AD. , , . Aβ , Aβ . , Aβ , Aβ IR. , AD , , AD 3 [26, 27].
, - , . [28]. (InsRs) , , , , [29]. InsRs [30].
胰岛素信号向大脑的传递在调节食物摄入,体重,繁殖,学习和记忆方面起着重要作用。鼻内注射胰岛素可改善人和动物研究的工作记忆[31]。另外,在短期记忆形成过程中,海马CA1区的insR mRNA和蛋白水平增加[32]。这表明在训练过程中神经元对胰岛素的敏感性可能会增加。, , . , AD [33]. AD InsR (CSF) [34, 35]. , IRS, AD [36,37]. IRS-1, IR, AD [38]. , InsR, , AD [39, 40]. , , IR, AD.
, , AD . TZD , GLP-1 AD . , , AD. , , [41].
. , , , ( ), .
:
:, , ., 2016 2018 :
: , .., - , , . , , .
www.ncbi.nlm.nih.gov/pubmed/28987937, , , :
, : / TLR4www.ncbi.nlm.nih.gov/pmc/articles/PMC6418006? “ ” (, , , , ), , .
, , , .
:, AD. 2018 PNAS N. Volkow ., , - [57].
2019 , , [58].
. . . , . , , — , .
: . , . .1. Liu,CC,Liu,CC,Kanekiyo,T.,Xu,H.和Bu,G.载脂蛋白E和阿尔茨海默氏病:风险,机制和治疗。 Nat Rev Neurol。 2013; 9:106–118
2. Penke,B.,Bogar,F.和Fulop,L.β-淀粉样蛋白与阿尔茨海默氏病的致病机理:全面的看法。 分子(瑞士巴塞尔)。 2017; 晚上10:10
3.Le Page,A.,Dupuis,G.,Frost,EH,Larbi,A,Pawelec,G.,Witkowski,JM等。 外周先天免疫系统在阿尔茨海默氏病发展中的作用。 Exp Gerontol。 2018; 107:59–66
4. Bronzuoli,MR,Iacomino,A.,Steardo,L.和Scuderi,C.针对阿尔茨海默氏病的神经炎症。 炎症研究杂志。 2016; 9:199–208
5. Kagan,BL,Jang,H.,Capone,R.,Teran Arce,F.,Ramachandran,S.,Lal,R.等。 淀粉样肽的抗菌特性。 摩尔制药 2011; 9:708–717
6. Jadiya P,Kolmetzky DW,Tomar D,Di Meco A,Lombardi AA,Lambert JP,Luongo TS,Ludtmann MH,PraticòD,Elrod JW。 线粒体钙外排受损在阿尔茨海默氏病模型中促进了疾病进展。 Nat Commun。 2019八月29; 10(1):3885。
7.寺庙科学家确定了对抗阿尔茨海默氏病的新靶标。
www.templehealth.org/about/news/temple-scientists-identify-promising-new-target-to-combat-alzheimers-disease8. Clemente,JC,Ursell,LK,Parfrey,LW和Knight,R。肠道菌群对人类健康的影响:综合观点。 细胞148,1258-1270(2012)。
9. Fung,TC,Olson,CA&Hsiao,EY健康和疾病中微生物群,免疫和神经系统之间的相互作用。 纳特 神经科学。 20,145–155(2017)。
10,Scheperjans,F.等 肠道菌群与帕金森氏病和临床表型有关。 电影 不和谐 30,350–358(2015)。
11. Keshavarzian,A.等。 帕金森氏病中的结肠细菌成分。 电影 不和谐 30,1351–1360(2015)。
12. Cattaneo,A。等人。 认知障碍老年人的脑淀粉样变性与促炎性肠道细菌类群和外周炎症标志物的关联。 神经生物学。 年龄49,60-68(2017)。
13.Minter,MR等。 抗生素引起的肠道微生物多样性扰动会影响阿尔茨海默氏病小鼠模型中的神经炎症和淀粉样变性。 科学 代表 6,1-12(2016)。
14.Harach,T。等。 在没有肠道菌群的情况下减少APPPS1转基因小鼠中Abeta淀粉样蛋白的病理学。 科学 代表 7,41802(2017)。
15.莫里斯,MC和坦尼,CC饮食中的脂肪成分和痴呆风险。 神经生物学衰老。 2014; 35:S59 – S64
16. Gu,Y.和Scarmeas,N.。阿尔茨海默氏病和认知老化的饮食模式。 Curr Alzheimer Res。 2011; 8:510-519。
17.Chianese,R.,Coccurello,R.,Viggiano,A.,Scafuro,M.,Fiore,M。,Coppola,G。等。 饮食脂肪对脑功能的影响。 Curr Neuropharmacol。 2018; 16:1059–1085
18. Bach-Faig,A.,Berry,EM,Lairon,D.,Reguant,J。,Trichopoulou,A.,Dernini,S。等。 今天的地中海饮食金字塔。 科学和文化更新。 公共卫生食品。 2011; 14:2272-4284
19.Willett,WC,Sacks,F.,Trichopoulou,A.,Drescher,G.,Ferro-Luzzi,A.,Helsing,E。等。 地中海饮食金字塔:健康饮食的文化典范。 (补充)我是J临床食品。 1995; 61:1402S – 1406S
20. Tosti,V.,Bertozzi,B.和Fontana,L.地中海饮食的健康益处:代谢和分子机制。 J Gerontol生物科学与生物学。 2018; 73:318–326
21. F. Sofi,F.,Abbate,R。Gensini,GF和Casini,A。坚持地中海饮食对健康的益处的证据不断积累:最新的系统评价和荟萃分析。 我是J临床食品。 2010; 92:1189–1196
22.David,LA,Maurice,CF,Carmody,RN,Gootenberg,DB,Button,JE,Wolfe,BE等。 饮食可快速且可重复地改变人类肠道微生物组。 自然。 2014; 505:559–563
23.Ma,D.,Wang,AC,Parikh,I.,Green,SJ,Hoffman,JD,Chlipala,G。等。 生酮饮食可通过改变年轻健康小鼠的肠道微生物组来增强神经血管功能。 科学代表 2018; 8:6670
24. Nagpal R1,Neth BJ2,Wang S1,Craft S3,YadavH。改良的地中海生酮饮食可以调节轻度认知障碍受试者的肠道微生物组和短链脂肪酸,并与阿尔茨海默氏病疾病标志物相关联。 EBioMedicine。 2019年8月30日.pii:S2352-3964(19)30554-7。
25.Tian J等。 海马生长激素促分泌素受体1α破坏与多巴胺受体D1的相互作用在阿尔茨海默氏病中起作用。 科学翻译医学。 2019八月14; 11(505)。 pii:eaav6278。
26. Frisardi V,Solfrizzi V,Capurso C,Imbimbo BP,Vendemiale G,Seripa D等。 胰岛素抵抗性脑状态是否是代谢认知综合症的主要特征? J Alzheimers Dis 2010; 21:57-63。
27. Lester-Coll N,Rivera EJ,Soscia SJ,Doiron K,Wands JR,de la Monte SM。 3型糖尿病的脑内链脲佐菌素模型:与散发性阿尔茨海默氏病的相关性。 J Alzheimers Dis 2006; 9:13-33。
28.巴斯金DG,菲格勒维奇DP,伍兹SC,Porte D Jr.,多萨DM。 大脑中的胰岛素。 Annu Rev Physiol 1987; 49:335-347。
29. Unger JW,Livingston JN,莫斯AM。 中枢神经系统中的胰岛素受体:定位,信号传导机制和功能方面。 Prog Neurobiol 1991; 36:343–362。
30.van der Heide LP,Ramakers总经理,Smidt议员。 中枢神经系统中的胰岛素信号传导:学习生存。 Prog Neurobiol 2006; 79:205-221。
31. Benedict C,Frey WH 2nd,Schioth HB,Schultes B,Born J,Hallschmid M.鼻内胰岛素作为治疗认知障碍的治疗选择。 Exp Gerontol 2011; 46:112-115。
32. Zhao W,Chen H,Xu H,Moore E,Meiri N,Quon MJ等。 脑胰岛素受体和空间记忆。 水迷宫训练大鼠海马中基因表达,酪氨酸磷酸化和信号分子的相关变化。 J Biol Chem 1999; 274:34893–34902。
33.de la Monte SM。 胰岛素抵抗和阿尔茨海默氏病。 BMB Rep 2009; 42:475–481。
34. Duarte AI,Moreira PI,Oliveira CR。 中枢神经系统中的胰岛素:不仅仅是一种外周激素。 老化研究杂志,2012年; 2012:384017。
35. Moloney AM,Griffin RJ,Timmons S,O'Connor R,Ravid R,O'Neill C.阿尔茨海默氏病中IGF-1受体,胰岛素受体和IRS-1 / 2的缺陷表明可能对IGF-1和胰岛素信号传导。 Neurobiol老化2010; 31:224-243。
36. Bosco D,Fava A,Plastino M,Montalcini T,PujiaA。胰岛素抵抗和葡萄糖代谢在阿尔茨海默氏病发病机理中的可能影响。 J Cell Mol Med 2011; 15:1807-1821。
36. Li L,Holscher C.阿尔茨海默氏病和2型糖尿病的常见病理过程:综述。 Brain Res Rev 2007; 56:384-402。
37. Talbot K,Wang HY,Kazi H,Han LY,Bakshi KP,Stucky A等。 在阿尔茨海默氏病患者中表现出的脑胰岛素抵抗与IGF-1抵抗,IRS-1失调和认知能力下降有关。 J临床投资2012; 122:1316-1338。
38. de la Monte SM,魔杖JR。 审查中枢神经系统中胰岛素和类胰岛素生长因子的表达,信号传导和功能障碍:与阿尔茨海默氏病的相关性。 J Alzheimers Dis 2005; 7:45-61。
39. Freude S,Schilbach K,SchubertM。IGF-1受体和胰岛素受体信号传导在阿尔茨海默氏病发病机理中的作用:从模型生物到人类疾病。 Curr Alzheimer Res 2009; 6:213–223。
40. Gammeltoft S,Fehlmann M,Van Obberghen E.哺乳动物中枢神经系统中的胰岛素受体:结合特征和亚基结构。 生物化学1985; 67:1147–1153。
41. Bhumsoo Kim,Eva L Feldman。 胰岛素抵抗是代谢综合征Exp Mol Med中认知障碍风险增加的关键链接。 2015年3月; 47(3):e149。 在线发布于2015年3月13日。
42.孙静等。 粪便菌群移植减轻了APP / PS1转基因小鼠的阿尔茨海默氏病样发病机理。 Transl精神病学。 2019年 9:189。
43.莎琳妮·埃兰戈万,托马斯·波罗迪,达米安·霍尔辛格。 粪便微生物群移植减少淀粉样蛋白负荷并改善阿尔茨海默氏症的认知。 BioRxiv 2019年7月1日。
44. Kim M,Kim Y,Choi H等在阿尔茨海默氏病动物模型中转移健康的微生物群可减少淀粉样蛋白和tau病理。 肠道。 首次在线发布:2019年8月30日.doi:10.1136 / gutjnl-2018-317431。
45. Shih-Yi Lin等。 输血与痴呆或阿尔茨海默氏病风险的关联:一项基于人群的队列研究前沿精神病学。 2019年 10:571。
46. Jaunmuktane Z等。 人类传播淀粉样β病理和脑淀粉样血管病的证据。 自然。 2015年9月10日; 525(7568):247-50。
47. Purro SA等。 尸体垂体生长激素传播淀粉样β蛋白病理。 自然。 2018年12月; 564(7736):415-419。 doi:10.1038 / s41586-018-0790-y。 EPUB 2018年12月13日
48.Jaunmuktane Z等。 通过神经外科手术传播淀粉样β-脑淀粉样血管病的证据。 神经病理学报。 2018年5月; 135(5):671-679。
49.Bu XL等。 血液来源的β淀粉样蛋白可诱发阿尔茨海默氏病。 摩尔精神病学。 2018年9月; 23(9):1948-1956。
50.奥苏吉·奥亚吉(Atsushi Aoyagi),卡洛·孔德洛(Carlo Condello),扬·斯托尔(JanStöhr),岳威州,布莱恩娜·M·里维拉,乔安妮·李,阿曼达·沃尔曼,格伦达·哈里代伊,舍尔德·范·杜嫩,马丁·英格森,拉尔斯·兰菲尔特,卡罗琳·格拉夫,托马斯·D·伯德, C. Dirk Keene,William W. Seeley,William F. Degrado和Stanley B. Prusiner。 寿命长的Aβ和tau pr病毒样活性在人的阿尔茨海默氏病脑中下降。 科学转化医学,2019年。
51. JI Ayers,Cashman NR。 肌萎缩性侧索硬化的病毒机制。
Handb临床Neurol。 2018; 153:337-354。
52. Kujawska M,Jodynis-Liebert J ..有什么证据证明帕金森氏病是一种起源于肠道的Pri肌疾病? 国际分子科学杂志。 2018十一月12; 19(11)。 pii:E3573
53. Van Den Berge N等。 在大鼠中双向和突触副交感和交感性传播的证据。 神经病理学报。 2019六月26。
54.张振涛,成城康,刘霞,恩熙安,张朝晖,李赫,迈克尔·尤文,杜克·邓阳,尼古拉斯·塞弗里德,马修·本斯基,弗雷德里克·P·曼弗雷德森,金玲京,孙怡恩,简-王志,叶克强。 天冬酰胺内肽酶切割α-突触核蛋白并介导帕金森氏病的病理活动。 自然结构与分子生物学,2017; DOI:10.1038 / nsmb.3433
55.约翰内斯·魏肯迈尔(Johannes Weickenmeier),玛蒂亚斯·贾克(Mathias Juckerb),阿兰·高丽莉(Alain Gorielyc),艾伦·库(Ellen Kuh)。 基于物理学的模型解释了阿尔茨海默氏病,帕金森氏病和肌萎缩性侧索硬化症中神经变性的the病毒样特征。作者链接打开覆盖面板。 固体力学和物理学杂志第124卷,2019年3月,第264-281页。
56.大卫·埃默里(David C. Emery),黛博拉·斯科特(Deborah K. Shoemark),汤姆·E·巴特斯通(Tom E. Batstone),克里斯蒂·M·瀑布(Christy M. Waterfall),简·A·科希尔(Jane A. Coghill),丹妮·L·塞拉杰夫斯卡(Tanya L. Cerajewska),玛丽亚·戴维斯,尼古拉·X·韦斯特,雪莱·艾伦。 16S rRNA下一代测序分析显示阿尔茨海默氏症后脑中的细菌。 神经科学的前沿,2017年; 9 DOI:10.3389 / fnagi.2017.00.005
57. Shokri-Kojori E.等人。 一夜睡眠剥夺后,β-淀粉样蛋白在人脑中积累。 Proc Natl Acad Sci US A.2018年4月24日; 115(17):4483-4488。
58. Lucey BP,McCullough A,Landsness EC,Toedebusch CD,McLeland JS,Zaza AM,Fagan AM,McCue L,Xiong C,Morris JC,Benzinger TLS,Holtzman DM。 非快速眼动睡眠减少与早期阿尔茨海默氏病的tau病理学有关。 科学转化医学,一月 2019年9月9日