使用减缓衰老过程的药物的主要目的是延长健康积极的寿命。 后者反过来旨在改善星球上迅速老化的人口的经济状况。 为了使任何药理学干预得到普遍认可,药物必须对任何成年人有效并且具有良好的安全性。 在本文中,我们证明了借助科学已知的药物,我们能够显着提高秀丽隐杆线虫的预期寿命。 蠕虫寿命的增加是通过改变与衰老相关的几种进化保守信号通路的活性来实现的。 由于对不同信号通路的影响具有共同的协同作用,我们希望我们能够减缓衰老过程,延长寿命一倍,并使健康寿命的持续时间延长一倍以上,而无需进行身体发育和活动的补偿性变化。
据我们所知,成人吸毒线虫的预期寿命是我们工作中最高的。 我们使用了最初用于治疗成人各种疾病的药物。 基于使用已经批准的药物同时作用于与衰老相关的几种信号通路的方法的开发被认为是非常有前途的。 它可以导致预防与年龄有关的疾病的发展,以及正在迅速老龄化的世界老年人的身体虚弱。
引言
衰老科学中最重要的阶段之一是发现了负责调节人体寿命的进化保守信号通路。 影响这些信号通路的基因突变可导致模型生物的预期寿命从30%延长到100%。 组合的基因突变可引起协同作用,从而延长寿命。 药理学干预的作用通常比基因突变弱得多,即使它们作用于相同的信号通路。
与几种合并的基因疾病协同作用的存在表明,同时影响几种进化保守信号通路的此类药物的使用将成为可能的有希望的方向。 迄今为止,关于使用药物以增加预期寿命的协同作用的数据还很少。 在本文中,我们报告了使用此类药物的一项新的体内研究结果。 我们已经证明了一种药物组合如何作用于多种信号通路,并且彼此之间具有相互促进的作用,因此如何使治疗效果最大化。 同时,由于在单独的但相互作用的信号传导途径中进行了点改变,因此可以最小化不良反应的频率和人体发育中的代偿性干扰水平。 该研究的最终目标是为成年人群开发一种药理学方案,其对衰老过程的作用已被证实,该作用等于或大于突变的作用。
由于几乎没有公认的衰老生物学标志物,目前,为了评估研究结果,他们只是比较生物体的总寿命。 秀丽隐杆线虫的线虫被用作短命的模型生物。 接下来,我们选择了几种药物组合,从而创建了两组药物,每组中有三种药物。 正如先前在研究中发表的那样,当使用这些药物组合时,在增加线虫线虫的预期寿命和延长健康寿命方面存在显着差异。
药物组合获得的协同效应与在与衰老相关的众所周知的基因进行定向突变后所观察到的协同效应相当。 我们没有发现与药理学干预相关的生物发展过程中的任何补偿性干扰。 随着某些标记物水平的提高,我们能够间接确定药物治疗减缓了自然衰老的速度。 此外,我们得出的结论是,TGFβ(转化生长因子β1)是提供信号通路协同作用的关键因子。 此外,研究表明,在用上述药物组合治疗的线虫中,单不饱和脂质与多不饱和脂质的比例改变了前者的流行趋势(MUFA与PUFA的比例增加),并且膜脂质的过氧化水平降低了。 最后,我们证实在果蝇果蝇的果蝇中也确定了类似的协同作用。
结果
秀丽隐杆线虫的信号传导途径和靶标的选择。根据现代科学文献,我们发现了一些与衰老有关的进化保守信号通路和机制(支持材料,表S1)。 我们选择的靶标和机制是:AMP激活蛋白激酶,c-Jun-N末端激酶(JNK),哺乳动物雷帕霉素靶标(mTOR)以及参与该过程的机制:卡路里限制(CR),有丝分裂(小剂量物质的作用)大剂量有毒)和线粒体代谢。 上述目标和过程被认为是延长生命的信号通路的主要目标。 对于每种信号传导途径,确定了在至少一种已知的模型生物(线虫,果蝇或小鼠)中描述了其对寿命的影响的药物。
人们对毒品进行测试对我们特别感兴趣。 因此,我们首选在哺乳动物中已声明功效或在人类中已获批准的药用化合物。 最初,我们发现了11种符合上述标准的潜在药物(辅助表S1)。 我们根据尿囊素可延长秀丽隐杆线虫寿命的能力报告和转录分析结果,将尿囊素添加到我们的列表中。 我们怀疑其作用机理不同于其他物质。 为了避免在使用药物后测量生物的预期寿命时出现错误,我们首先使用盲法对承包商进行了测试。 造成这种情况的主要原因是,研究结果在很大程度上取决于实验条件的正确性,并且在不同实验室之间差异很大。 我们仅使用了科学论文中先前描述的那些剂量的药物。 在我们的实验室中已经反复证实了五种影响寿命的药物的有效性(图1,支持表S2)。 通常,在我们的研究中,与增加生物寿命相关的化合物的有效性略低于以前发表的著作(补充方案1,支持表S2)。
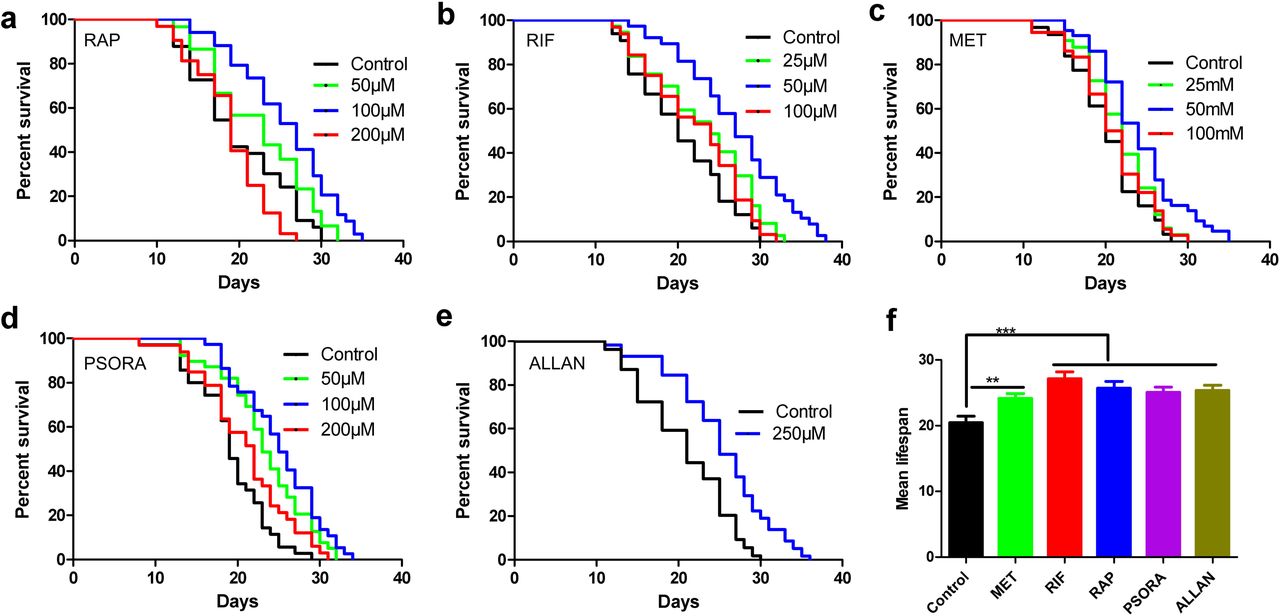 图 1个
图 1个成绩单,毒品和长寿
为了评估药物在研究中的有效性,我们进行了转录组分析,确定了差异表达基因(DEG),并丰富了与对照相关的信号传导途径。 我们注意到实验组中基因表达和信号通路活性的某些差异,而对照组中没有。 基因表达和信号通路中最显着的变化是由一种由利福平,雷帕霉素和psora-4(PSORA)组成的药物组合的作用引起的,其中最后一种药物在前两种药物之后给药。 与提到的药物不同,二甲双胍(MET)和尿囊素(ALLAN)影响较少基因的表达(方案2a,支持表S3)。
对转录结果的分析表明,每种药物都具有其改变的基因的独特特征。 同时,在其余药物的转录谱中也发现了其中一些基因(方案2a)。 因此,MET参与了许多“流行”基因的工作,但涉及的独特基因数量却很少。 MET和PSORA制剂改变了几乎所有“流行”基因谱的活性,其中一些也受到方案2a中所示药物的个别影响。
ALLAN化合物影响的基因数量最少,但其中大多数属于一个独特的群体。 不到一半的基因在其他药物的转录谱中出现。 使用RIF和RAP的效果彼此之间以及与任何其他药物上均存在显着差异。 基于主成分分析(PCA)的三个标准,我们得出结论,RIF,RAP和PSORA与其余药物非常不同。 相反,ALLAN和MET的影响变化更大,但非常相似。 此外,他们的结果与对照组的结果有些接近。
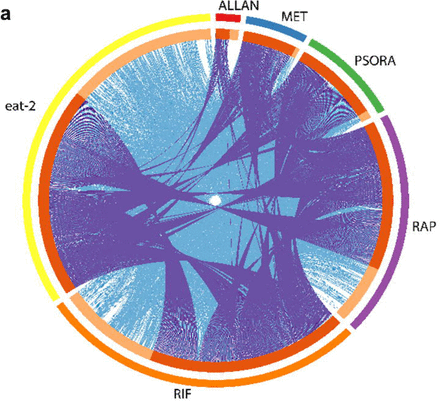
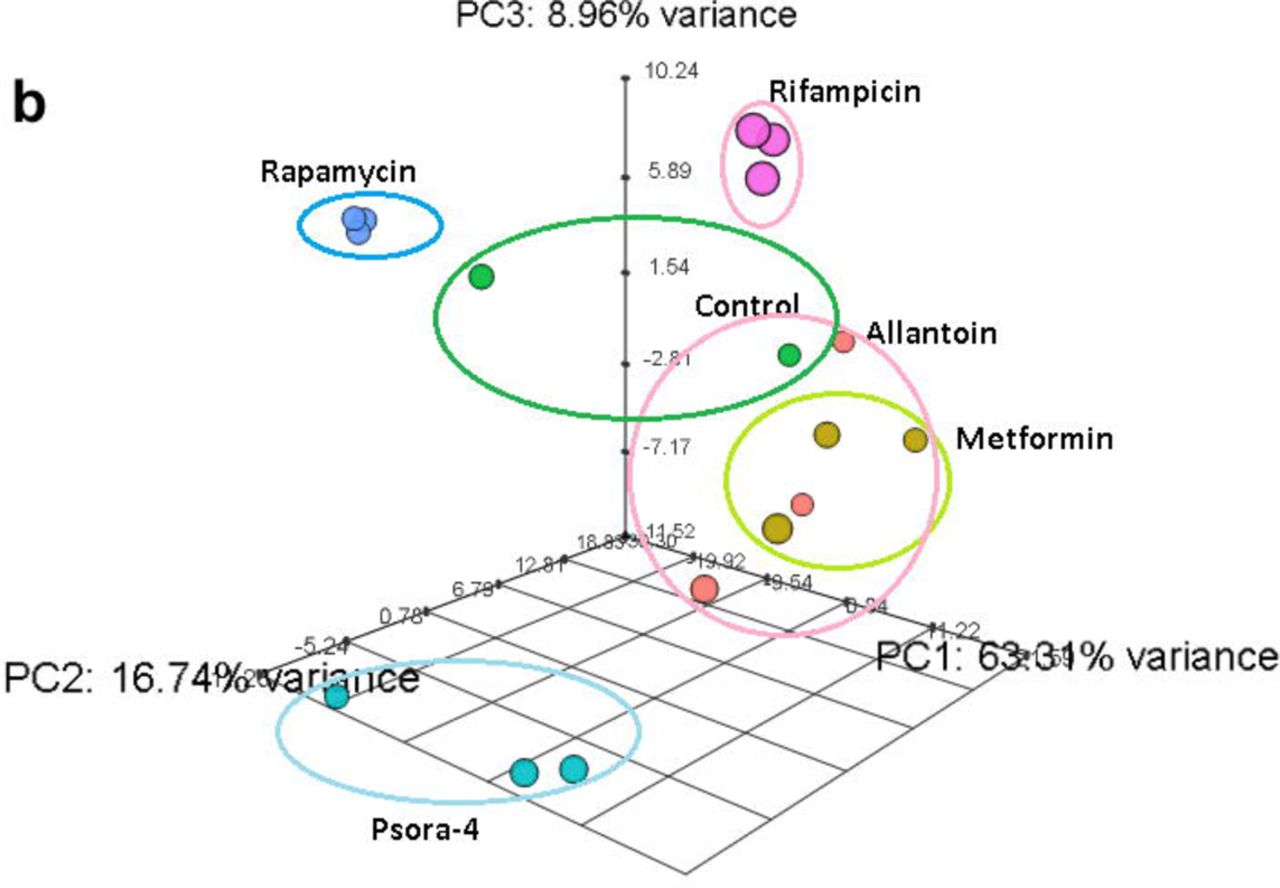
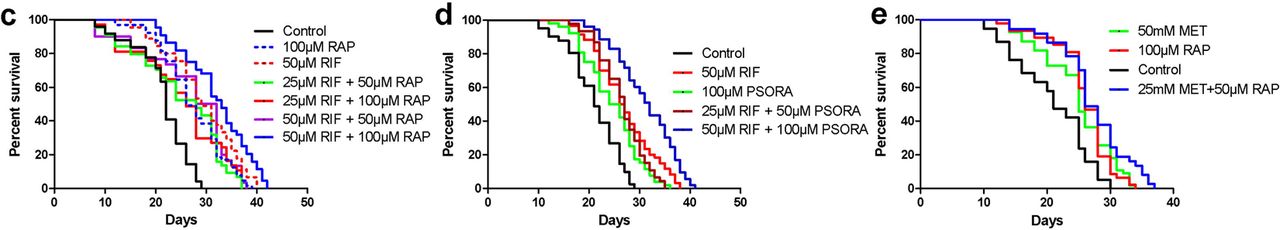

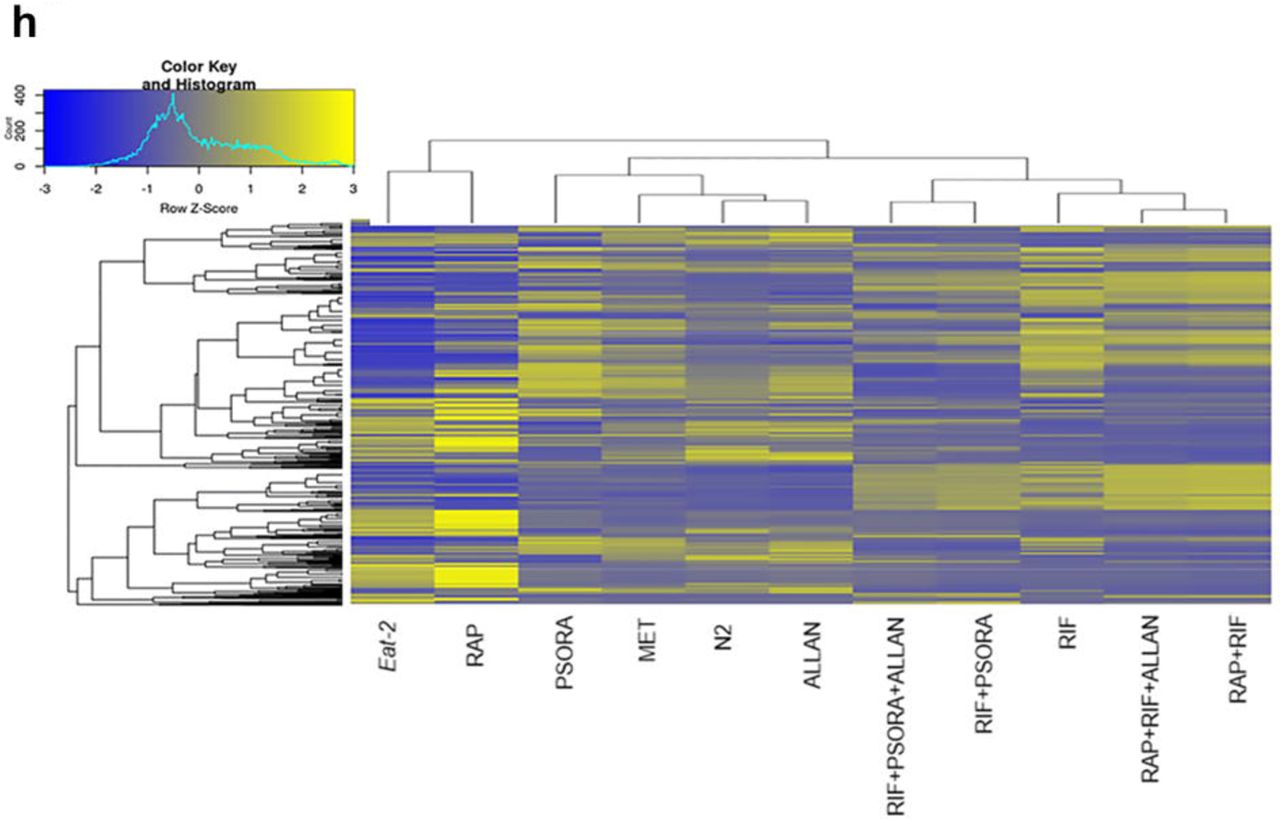 图2
图2在下一步中,我们确定了各种药物组合如何影响线虫的寿命。 由于MET和RAP的作用更易于传递给人类,因此我们首先研究了这些药物。 然而,事实证明,最佳剂量为50 mg和100 mg的MET和RAP的组合并不能延长寿命(补充方案2 J,P)。 我们使用最佳和半最佳剂量的这些药物的所有可能组合进行了更多研究(附加方案2 JP)。
以半最佳剂量使用MET和RAP可以增加线虫的最大寿命(方案2e,附加方案2 m,s),而不是平均预期寿命(附加方案,2p)。 MET和RAP的这一轻微优势与另一项小鼠研究的结果一致。 事实证明,向RAP中添加MET主要延长了雄性的寿命,而在雌性中,结果几乎没有引起注意(完全记录下来)。
接下来,我们依次发现了10种药物组合的效果。 在每种药物组合中,五种可能的药物中有两种(附加方案2 ai)。 使用HSA模型(较高的单活性模型)对协同效应进行了分析,该模型估计了两种药物之一的活性程度。
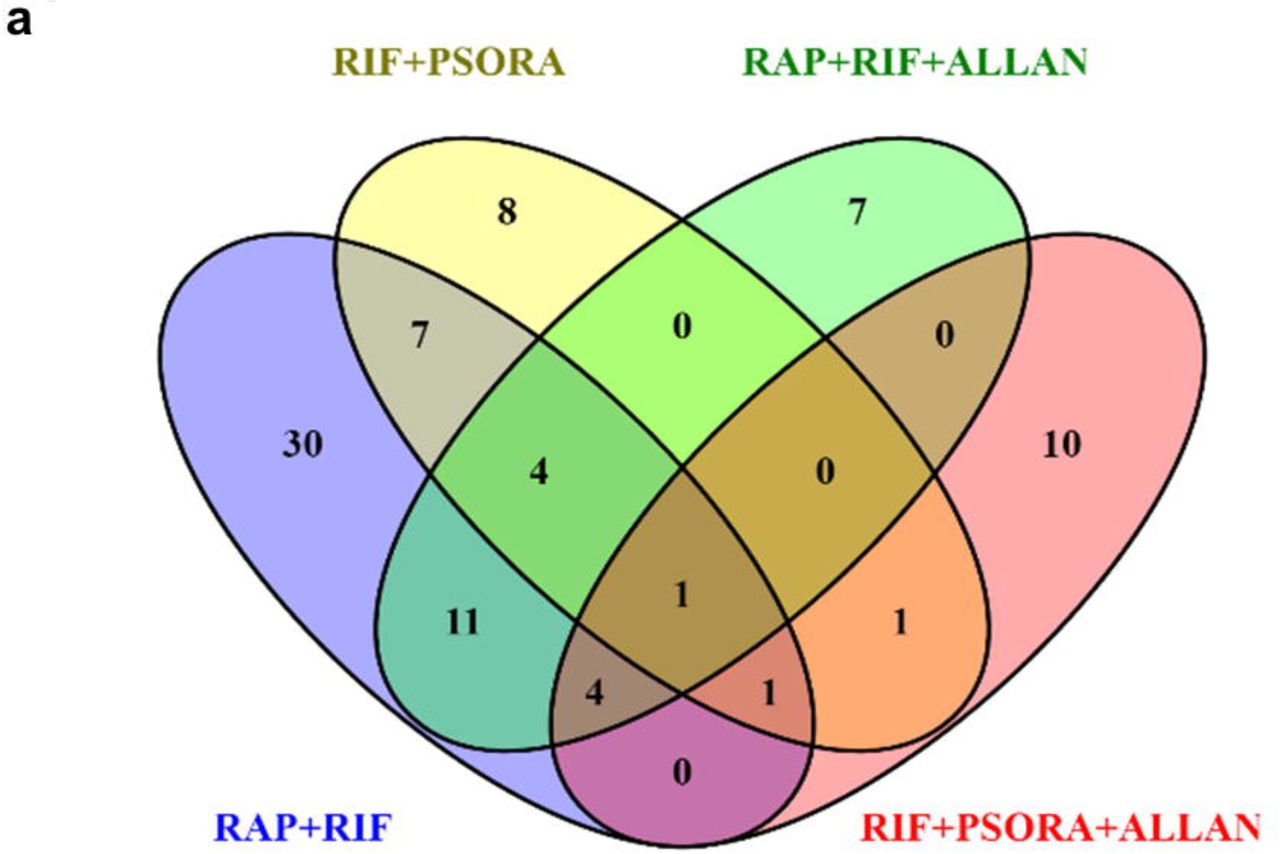
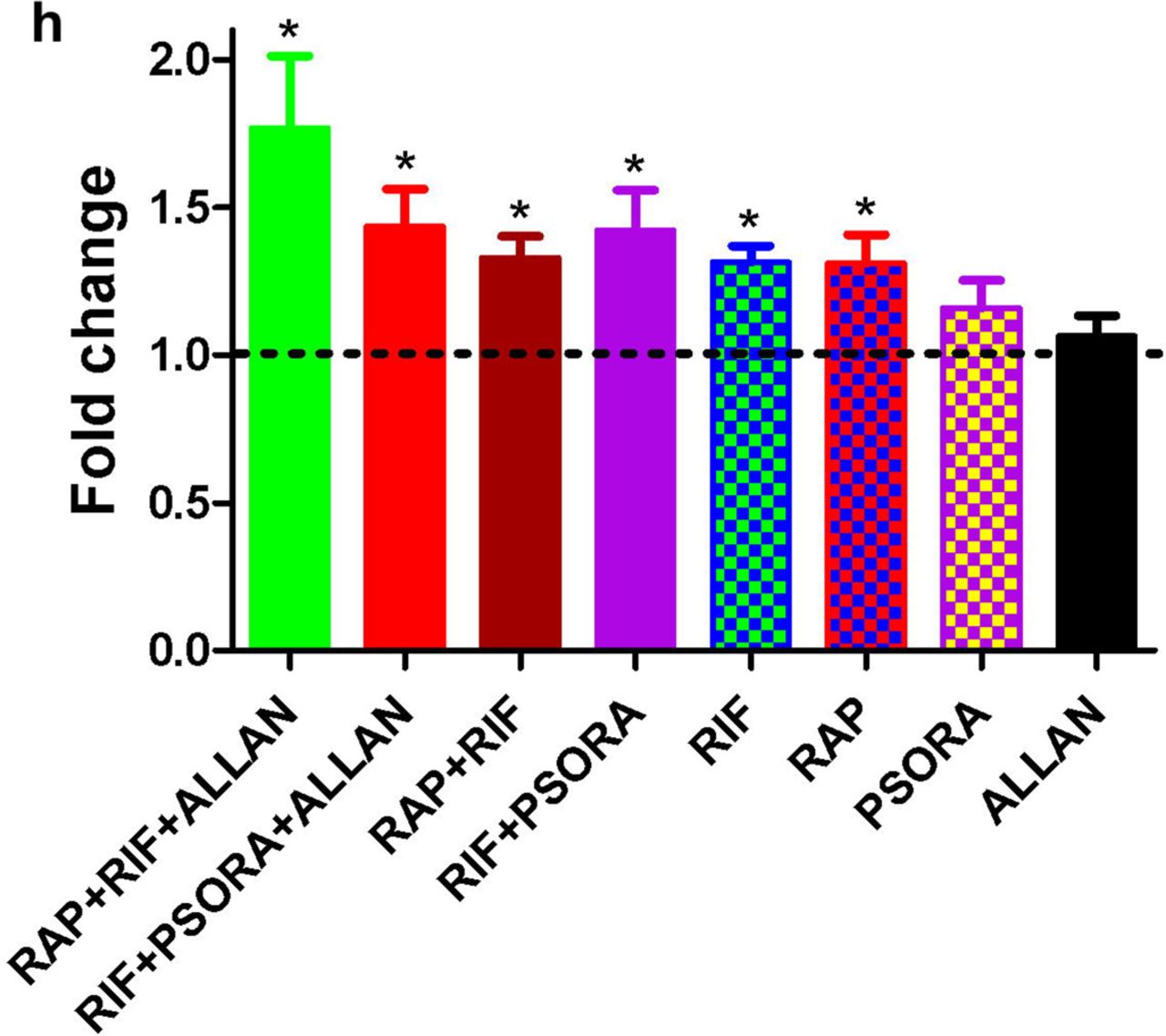
联合使用多种药物的结果被认为具有协同作用,但前提是该结果大大超过了每种药物单独作用且剂量相同时获得的结果。 根据上述定义,我们发现十分之二的药物组合具有协同作用(方案2c,d,补充方案2和支持表S2),并由以下药物组合固定:RIF与RAP和RIF与PSORA。 这些药物可以制成三种不同的药物组合,但是根据PCA分析,只有其中两种药物的区别最大。 在最后两个中显示出协同作用(方案2b,其他方案4a,b)。
在其余8对药物中,有4种对预期寿命的影响与相应药物组合中最有效的药物相同。 在其他4种组合中,一种药物的作用相互排斥另一种药物的作用。 在后一种情况下,还注意到没有毒性反应和寿命增加(附加方案2,支持表S2)。
在我们的研究中,与先前在科学文献中发表的数据相比,两种具有协同作用的药物组合的使用导致寿命显着延长。 但是,吸毒后预期寿命的增加小于突变性疾病的类似影响。 在这方面,我们有一个问题:成年动物的药物治疗可以达到的最大实际生存率吗? 通过添加其他化合物,我们是否可以进一步延长使用寿命? 如果药物组合包含三种药物化合物,则可能的组合数目将增加到30。我们没有机会检查这样的药物组合数目。
因此,我们选择性地研究了某些三联药物组合的效果。 首先,根据PCA方法的标准,我们考虑了一种药物组合,其中所有三种药物化合物之间的差异最大。 另一种情况是与其他药物(RAP,RIF和PSORA)联合使用时,该药物存在协同作用。 但是,使用三种药物组合时的线虫预期寿命要比使用任何两种药物组合时的预期寿命差(补充方案3a,支持表S2)。 然后,我们测试了三重药物组合的有效性,其中包括具有相关基因独特特征的ALLAN药物(浅橙色弧,方案2a)。
ALLAN基因的活性谱与其他药物的活性基因谱不匹配。 它也不同于突变转录组eat-2的光谱。 因此,我们假设ALLAN化合物具有独特的作用机理,因此将其添加到显示出协同作用的这两对组合中。 在这两种情况下,均观察到平均预期寿命及其最大值的统计显着增加(方案2f,g,附加方案3d-f和辅助表s2)。 最好的结果是三种药物的组合:RAP,RIF和ALLAN,这使蠕虫的平均寿命加倍,中位和最长分别达到44天和50天(辅助表s2)。 产生的效果与突变性疾病的效果相当。 根据我们的信息,当使用成人药物时,秀丽隐杆线虫的寿命延长是科学文献中有史以来最大的延长。
药物协同作用的机制
Daf-16 / FOXO是一种转录因子,在调节模型生物甚至人类的寿命中起着关键作用。 为了研究我们确定的药物组合的协同作用机制,我们确定了当蠕虫的Daf-16信号传导途径中的突变为负时,它们的有效性。 药物,如RAP或ALLAN,单独服用,其作用独立于Daf-16信号通路。 相比之下,使用RIF延长预期寿命完全是由于Daf-16途径和PSORA的部分作用(方案3a,其他方案8)。
RAP + RIF药物的协同组合包括一种RIF药物(其作用完全取决于Daf-16途径)和另一种RAP药物,其作用独立于该信号传导途径。 尽管药物的活性与Daf-16通路的功能有关,并且线虫具有突变的Daf-16基因(方案3a,附加方案8),但RIF + PSORA制剂的联合使用也记录了协同作用。
这样的结果是出乎意料的,因为事实证明协同作用不仅是由Daf-16途径引起的:这种作用是在Daf-16基因蠕虫的突变体中使用的药物完全或部分依赖于该基因的功能来实现的。
 图3
图3根据不同的作者,我们测试的几种药物是CR模拟物(热量限制),即 与体内天然合成的化合物相似的药用物质,可引起食欲下降。 我们使用eat-2突变秀丽隐杆线虫模型来发现药物组合及其协同药物是否影响CR信号通路。 只有RIF化合物可以延长eat-2突变线虫的寿命。 因此,除RIF制剂外的所有其他制剂均属于CR模拟物。
, , RAP+RIF RIF+PSORA, CR , eat-2. RIF PSORA , ALLAN . , , ALLAN CR .
, . , , . , CR – , , eat-2 . , RIF CR – eat-2 ( 2h).
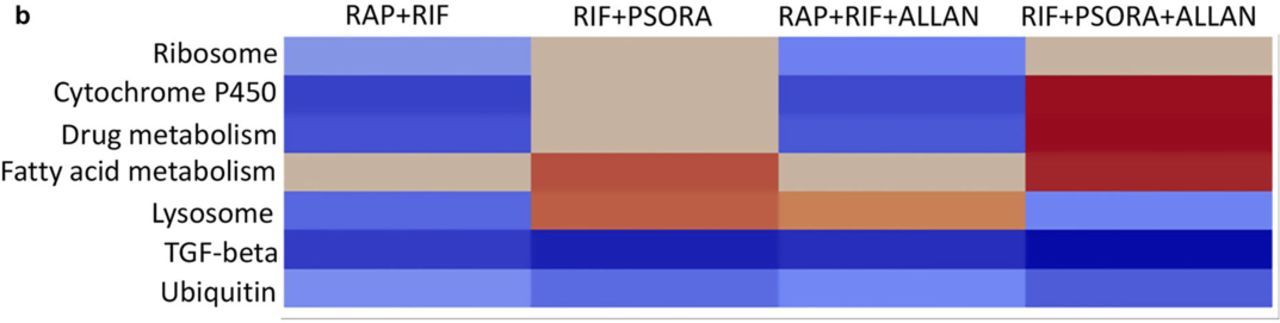
, , eat-2 ( 2h, 4 c, d). , TFGβ- ( 4a, 6, 7a, s4). , , , (. ). , TGFβ . ( s5).
eat-2 , . , eat-2 TGFβ eat-2 . , , TGFβ – ( 7b, S6). , ( 4b, 7a,c, s7).


 .4
.4TGFβ
TGFβ- , , , , . , TGF (daf-7) . daf-2 daf-7, daf-16- ( 7d). , , daf-2-, , . daf-2 .
RAP- : RAP+RIF RAP+RIF+ALLAN. , RAP . , , ( 3, 8, s2). PSORA daf-2- , , (RIF+PSORA RIF+PSORA+ALLAN) ( 3 8).
, , daf-7 . . , daf-7 , , , ( 3d, 8).
, MUFA
, age-1 daf-2 , . , TGFβ/daf-7 (TAG) , , daf-7 . , , , , TGFβ ( s3).
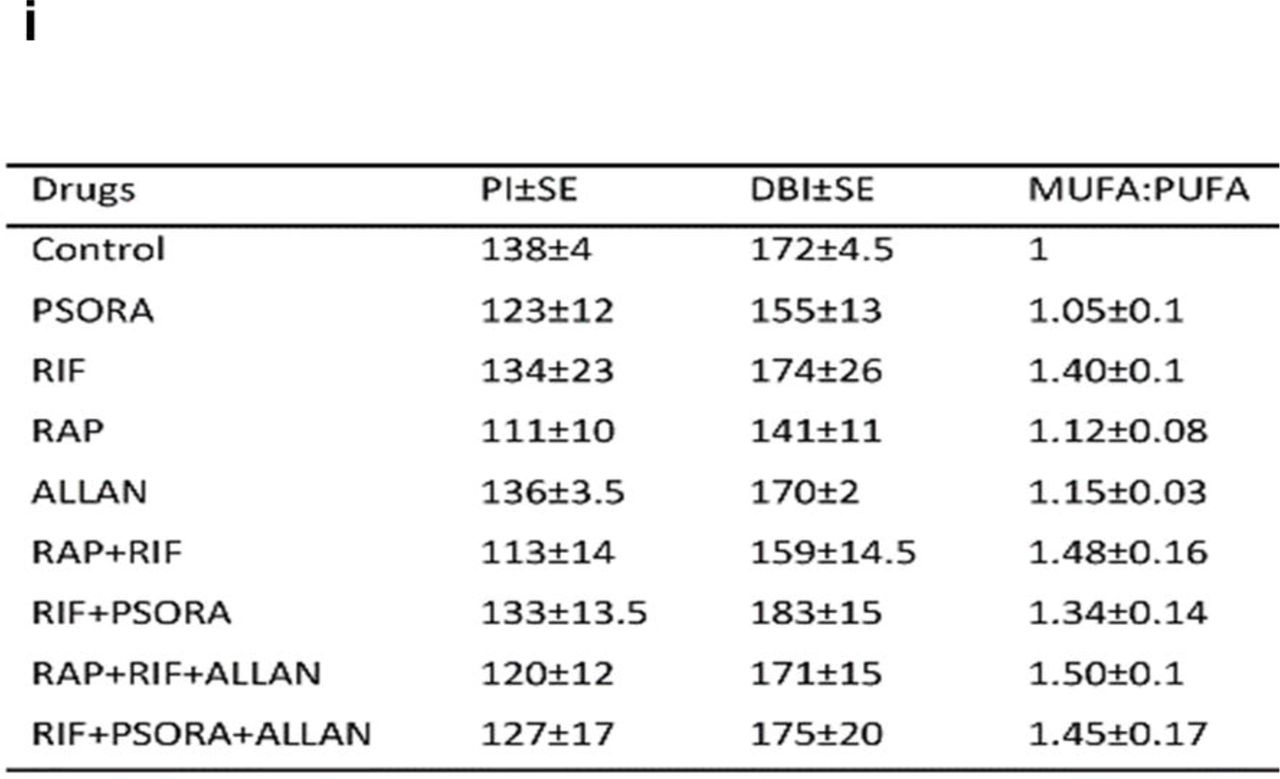
, , , , C.elegans SREBP-1c: sbp-1. , , -. (MUFA) ( 4, ). , -, . , TAG, MUFA:PUFA ( ) 16:1 19:1 (MUFAs)( 4f).
, (DBI)( ) (PI) ( 4i). PI , , . , , , .
, . , , , ( 5 e,f). , ( 4h). , .
 .5
.5C. elegans (ETC). , , ( 5i). , , : , . , , , . , ( 5-, 9).
, : , . , , , , (Herndon). 50% . , RIF+PSORA+ALLAN RAP+RIF+ALLAN, 57% 63% ( 5d, 9). , , .
, , – ( 5d, 9). , , , : RIF+PSORA+ALLAN RAP+RIF+ALLAN, , . , (18 ), , (7 ) ( 5g). , ( , 5e,f, 9b). , , , , , .
, , . , (MRDT ). Survcurv, . RIF+PSORA+ALLAN MRDT , (MRDT=3,7 3 , <0,0001, ).
(IMR) (IMR = 2.7e-3, IMR RIF+PSORA+ALLAN = 8.5e-4, RAP+RIF+ALLAN = 9.3e-4, P< 0,001). , , , .
Drosophila
. , , C.elegans, Drosophila melanogaster. , RAP , MET . . , , RAP ALLAN , RIF PSORA ( 6, s2).
, , RAP: RAP+RIF RAP+RIF+ALLAN ( 6). , PSORA: RIF+PSORA RIF+PSORA+ALLAN ( 6b). , RIF+PSORA , ( 6). Drosophila melanogaster , , - , , .
 .6
.6在这项工作中,我们能够找到具有协同作用的几种药物组合。 他们有选择地影响了与衰老和寿命有关的某些信号通路。 另外,信令路径可以彼此相交。 即使此类药物仅在成年期使用,秀丽隐杆线虫的活跃寿命却翻了一番。 药物干预的效果大小与经典突变减缓衰老后的效果相当。 据我们所知,就成年动物药物干预的数量和数量而言,这项研究已成为最大的研究。
当使用可延长蠕虫寿命的增效药物组合时,我们无法检测到任何伴随的负性代偿性疾病或动物发育中的疾病。 在与衰老相关的基因突变的生物中也观察到了类似的疾病。 同样,注意到的积极的药物作用不是由于电子传输膜链(ETC)功的降低或蠕虫中新陈代谢的抑制。 根据耗氧量对这些指标进行评估。
实际上,就运动活动而言,接受药物组合药物的动物超过了有机体对照组。 实验组的老年人和对照组的年轻人的身体形态和活动均相同(方案5g)。 死亡率分析表明,药物组合的协同作用使生物衰老的速度减慢了约20%(附加方案10)。 为了测试药物协同作用及其进化保守性的积极作用,我们对果蝇的果蝇进行了一些实验。 四种药物组合中的两种证实了协同作用的安全性。
从进化上讲,线虫比哺乳动物更靠近蝇。 因此,果蝇和线虫中的这种保守机制和信号传导途径是古老的。 最初,这三类动物共有的祖先可能存在协同作用的机制。
为了研究可延长蠕虫寿命的药物协同作用的机制,我们进行了几个上位性实验(表皮抑制(通过非等位基因对基因组抑制等位基因对基因的作用))和转录组分析。 结果,我们能够发现daf-2 / daf-16(IGF / FOXO)和TGF(daf-7)信号通路在协同效应的功能中起重要作用(方案4j)。 这两个路径之间的关系在其他研究中也得到了证实。 他们的作者报告说daf-7通过胰岛素信号传导途径调节动物的寿命,而神经TGF途径与营养摄入和寿命有关。 此外,daf-7控制线虫的新陈代谢和脂肪存储过程。 延长线虫寿命的突变通过增加单不饱和脂质的数量和减少多不饱和脂质的数量而作用于蠕虫的脂质代谢。
这些结果与我们的研究结果一致。 药物协同作用增加了主要转录因子sbp-1的水平,从而影响脂质代谢和单不饱和脂质的合成(方案4c,f,其他方案5)。 线虫脂质瘤的质谱分析表明,使用了多种具有协同作用的药物组合,揭示了脂肪代谢的变化:sbp-1因子的活化,三酰基甘油的积累以及单不饱和和多不饱和脂质比例朝前者的增加方向增加(包括分为两类脂质-磷脂酰胆碱和磷脂酰乙醇胺)。 最后,在科学文献中描述了单不饱和脂质相对于多不饱和脂质的优势,发现其父母存活90岁或以上的儿童的红细胞膜的脂质谱。
全世界的科学家对MET和可能的RAP化合物减缓与年龄有关的疾病发展并预防人类疾病的潜在能力抱有极大的兴趣。 鉴于对此问题的关注日益增加,我们要提及的实验中,线虫和小鼠中MET和RAP制剂组合的有效性较弱。 这样的结果使许多科学家感到失望。
在我们的工作中,我们证明了预期寿命是由复杂的信号通路以及相互作用的基因和生化分子决定的。 某些信号通路对多个靶标的同时影响可能导致明显的积极影响,有时甚至导致无法预测的结果。 在这项研究中,基于证据原理,我们使用了在关键信号通路中起作用的药物。
突然,我们发现了一种协同效应,它在本质上是普遍的,并且在进化上是保守的。 我们的工作结果证实了使用药物的有效性,该药物可立即减慢许多保守信号通路的活性,从而减缓生物衰老的速度。 如果科学家设法将这一行动原则传递给人们,这将大大提高医疗服务的有效性和社会的经济利益。
翻译:Tatyana Gneteeva。