随着生物学研究工具的改进,研究人员开始揭示微蛋白的细节,这些蛋白显然是某些细胞过程(包括与癌症有关的过程)的关键。 蛋白质由连接的氨基酸链组成,平均人类蛋白质包含约300个氨基酸残基。 同时,微蛋白包含少于100个氨基酸残基。 科学家最近显示,一种微蛋白PIGBOS由54个氨基酸组成,有助于减轻细胞压力。
Alan Saghatelian等人对此进行了研究。 发表在《自然通讯》上。
这项研究始于科学家在线粒体中发现PIGBOS。
通过绿色荧光蛋白(GFP)检测PIGBOS蛋白的首次尝试失败。 与GFP的大小相比,微蛋白太小。 科学家团队通过尝试一种不太常见的方法来解决此问题,该方法称为共享GFP,在该方法中,他们仅将GFP的一小部分(称为beta)与PIGBOS相结合。
研究人员能够看到PIGBOS并研究其如何与其他蛋白质相互作用。 当他们绘制PIGBOS的位置时,他们意识到它位于线粒体外膜上,准备与其他细胞器上的蛋白质接触。 他们惊讶地发现PIGBOS与称为CLCC1的蛋白质相互作用,CLCC1是称为内质网(ER)的细胞器的一部分。
该研究的另一位合著者钱楚说:“ PIGBOS是线粒体与内质网之间的连接点。” “我们曾经在微蛋白中看不到这种现象,而在普通蛋白质中很少见到。”
研究人员发现PIGBOS实际上与CLCC1结合以调节内质网中的压力。 如果没有PIGBOS ER,它很可能会承受压力,当细胞试图清除有害的变形蛋白(对不正确的蛋白折叠,UPR的反应)时,这会导致一系列事件。 如果细胞无法去除这些蛋白质,它将启动自我破坏序列并死亡。
科学家没想到看到线粒体蛋白在UPR反应中的作用。 对PIGBOS的新理解为将来针对应力细胞的治疗方法打开了大门。
“未来,我们可能会考虑PIGBOS如何参与癌症等疾病,” Q。Chu说。 “在癌症患者中,ER比正常人压力更大,因此控制压力ER可能是一个好目标。”
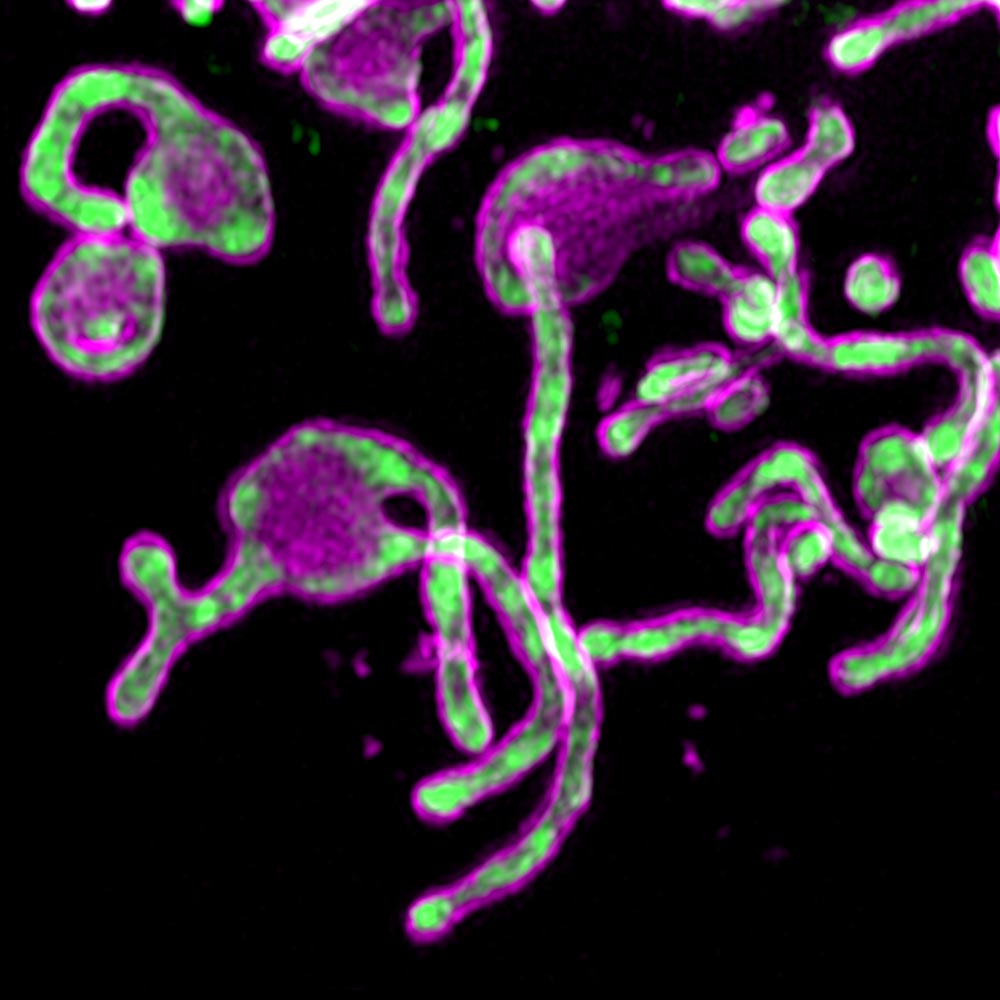 图 1. PIGBOS微蛋白成像www.salk.edu/news-release/mysterious-microproteins-have-major-implications-for-human-disease
图 1. PIGBOS微蛋白成像www.salk.edu/news-release/mysterious-microproteins-have-major-implications-for-human-disease研究人员对研究其他线粒体蛋白在内质网应激中的作用以及PIGBOS在动物模型中的作用感兴趣。 该小组还在表征广泛的微蛋白文库方面取得进展,这些文库对细胞生物学至关重要。
什么是微蛋白?
术语“微蛋白”是指由小的开放阅读框(smORF)编码的小蛋白。 基因组学和蛋白质组学技术的进步表明,哺乳动物基因组被认为包含由smORF编码的数百至数千个微蛋白。 作为蛋白基因组中很大但仍研究不足的部分,微蛋白提供了一个很好的机会,使人们对现代生物学有了新的认识。
美国杂志《科学家》称微蛋白为“人类蛋白质组的暗物质”并非偶然。 尽管其中第一个ID是在30年前发现的。 哺乳动物中Id蛋白家族的共同特征是它们对细胞命运的调节。 Id蛋白作用于各种组织和细胞,包括成肌细胞,神经系统和免疫系统。 除了它们充当转录机制的调节剂并影响发育细胞的命运外,Id蛋白还影响细胞周期控制,并在各种人类肿瘤中过表达。 Id蛋白在发育过程中的分子功能已广为人知,但到目前为止,关于Id蛋白在成人中的功能知之甚少。
迄今为止,只有少数smORF和微蛋白得到了很好的表征。 例如,一些特定于肌肉的smORF使我们能够描述控制肌肉功能和发育的新途径。 MOTS-C人类微蛋白调节代谢稳态,NoBody微蛋白(无注释的P体解离多肽)与mRNA切割蛋白相互作用,这是mRNA分解途径中第一个酶促步骤的分子成分。 称为CYREN的微蛋白调节细胞周期中DNA修复途径的选择。
目前已知的微蛋白作用机制是抑制蛋白复合物的形成。 这就是它的样子。 许多蛋白质通过充当多蛋白质复合物的一部分来实现其功能。 这些复合物的形成受到蛋白质-蛋白质相互作用域的严格调节和介导。 破坏蛋白质形成同二聚体,异二聚体或多聚体的复合物或能力可能会对细胞功能产生严重影响。 在这方面,二聚体和多聚体的形成可以被微蛋白破坏。 微量蛋白起翻译后调节剂的作用,与其靶标形成同型二聚体,并通过显性-负性抑制蛋白复合物的功能发挥作用。
简而言之,微蛋白会干扰较大蛋白的复杂工作,从而抑制某些细胞过程并刺激其他细胞过程。 研究表明,微蛋白的作用在进化上是保守的,并且对于动植物界都是相同的。 初步研究结果表明,微蛋白参与免疫过程,控制有缺陷的RNA分子的破坏,保护细菌免受冷热的影响,决定植物的开花期,并作为多种动物毒素的毒素来源。 根据科学家的说法,似乎微蛋白参与了所有生物过程。 就在他们没有注意之前。
许多其他关键的细胞过程也可能由未描述的微蛋白介导。 smORF和微蛋白的检测和表征都是一项重要的研究任务。
尽管还有其他谜团,科学家们已经在测试这些分子的潜在用途。 一家公司出售源自澳大利亚杀伤剂中毒的微蛋白的杀虫剂。 在临床试验中,测试了一种基于蝎毒中另一种微小蛋白质的造影剂。 该物质的任务是隔离肿瘤的边界,以便外科医生可以更高精度地提取肿瘤。 现在,许多制药公司正在寻找具有医学潜力的微蛋白。
目前还不清楚它们有多小。 果蝇需要一种具有11个氨基酸的微蛋白才能生长正常的爪子,有些微生物可以生产长度少于10个氨基酸的蛋白。 但是,即使最大的蛋白也无法到达中等大小的蛋白质,例如我们的唾液中发现的α-淀粉酶(一种496个氨基酸的酶)并分解淀粉。
只有最近发现的少量微蛋白与大约20年前建立的基因识别标准有关。 当科学家分析人体的基因组时,他们通常会扫描开放阅读框(ORF)。 为了避免淹没大量数据,过去,研究人员通常排除了真核生物中蛋白质少于100个氨基酸或细菌中少于50个氨基酸的任何ORS。 例如,在酵母中,这种情况将OPC的列表限制为约六千。
该标准的弱化表明细胞含有明显更多的OPC。 今年早些时候,科学家们发现了居住在人体四个部分(包括肠道和皮肤)的微生物基因组片段。 当寻找可以编码5到50个氨基酸长的蛋白质的小型OPC时,研究人员发现了大约4000个潜在的微蛋白家族。 它们中的几乎一半与已知蛋白不相似,但是一个小的ORS序列提示相应的蛋白位于核糖体中-这表明它可以发挥某些基本作用。 当科学家忽视小型OPC时,不仅错过了具有某些稀有功能的基因,而且还错过了具有关键功能的基因。
其他细胞也包含大量的短OPC:例如,酵母能够产生超过26万个具有2至99个氨基酸光谱的分子。 但是细胞几乎肯定不会使用所有这些ORS,并且它们产生的某些氨基酸链可能不起作用。
魏斯曼等。 还以另一种方式发现了微蛋白:使用他们发明的方法,旨在更广泛地识别细胞产生哪种蛋白。 为了形成任何蛋白质,细胞首先将基因复制到RNA信使中。 然后,核糖体读取mRNA,并以特定顺序结合氨基酸。 通过对附着在核糖体上的mRNA进行测序,Weissman和他的团队准确地确定了其中的哪些实际上变成了蛋白质,以及核糖体在RNA上开始“读取”的位置。 在2011年的一项细胞研究中,科学家及其团队将这种核糖体分析方法(也称为Ribo-seq)应用于小鼠胚胎干细胞,发现该细胞产生数千种无法预料的蛋白质,其中许多氨基酸的数量将低于100个阈值单位。 韦斯曼说:“很明显,标准宇宙忽略了蛋白质的广阔宇宙,其中许多是短的。”
Saghatelian和同事采用了第三种方法来检测我们自己细胞中大量的蛋白。 科学家使用质谱分析法,其中将蛋白质分成按质量分类的片段,以鉴定每种蛋白质的鉴定光谱。 Saghatelyan及其同事将这种方法应用于人类细胞中蛋白质的混合物,然后从中减去已知类型蛋白质的信号。 正如科学家在2013年《自然化学生物学》杂志上的一篇文章中指出的那样,这种方法揭示了86种以前未知的微小蛋白质的光谱,其中最小的蛋白质长18个氨基酸。
小尺寸限制了蛋白质的潜力。 较大的蛋白质结合成复杂的形式,旨在实现某些功能,例如,催化化学反应。 包含50至60个氨基酸的蛋白质不太可能形成化合物。 因此,它们不适合形成酶或结构蛋白。
然而,它们的小尺寸也带来了某些可能性。 它们足够小,可以放入充当通道和受体的大蛋白质的角落。 小蛋白质通常与较大的伴侣共享短链氨基酸,因此可以结合并改变这些蛋白质的活性。 结合的微蛋白还可以将大分子引导到新的位置-例如,通过促进它们渗透到细胞膜中。
由于它们对较大蛋白的吸引力,较小蛋白可以使细胞激活或失活较大蛋白的可逆方式。 在2016年发表在《 PLOS遗传学》杂志上的一项研究中,Stephan Wenkel及其同事对拟南芥植物进行了基因改造,以产生额外数量的两种小蛋白质。 植物通常在一天的时间足够长的时候开花,但是在两种类型的微蛋白含量过高后,开花就会延迟。 小蛋白质通过阻止开花的大蛋白质称为CONSTANS,引起了这种延迟。 他们将CONSTANS与其他抑制蛋白结合,从而将其关闭。
2016年,Saghatelyan和他的同事发现人类细胞产生一种包含68个氨基酸的蛋白质,他们称之为NoBody。 这种蛋白质可以帮助破坏有缺陷或不必要的RNA分子。 名称“ Nikto”反映了这种蛋白质在防止可能发生RNA破坏的细胞质中的神秘团簇形成过程中的作用。 当蛋白质不足时,会形成更多的过程性物体,从而加速RNA的破坏并改变细胞的内部结构。 科学家说:“这证明小蛋白可以在细胞内产生巨大作用。”
肌肉依赖于许多不同的微蛋白。 在胚胎发育过程中,单个肌肉细胞融合成纤维,从而触发收缩。 正如Olson等人在2017年《科学》杂志上的研究所示,Myomixer 84氨基酸蛋白与更大的蛋白结合以连接细胞。 没有它,小鼠胚胎就无法形成肌肉,几乎是透明的。
此外,随着它的发展,肌红蛋白开始起作用,这有助于调节肌肉活动。 当肌肉受到刺激时,细胞库会释放钙,刺激组织收缩和产生能量。 接下来,离子泵(一种称为SERCA的蛋白质)开始使钙返回储存状态,从而使肌肉组织放松。 Mioregulin与SERCA结合并抑制它。 这种作用限制了肌肉收缩的频率,可能为紧急情况(例如,从捕食者逃跑时)提供能量储备。 另一种小蛋白DWORF具有激活SERCA和刺激系统性肌肉收缩的相反作用。
即使是经过深入研究的生物,例如大肠埃希氏细菌(Escherichia coli),也会隐藏起重要作用的意想不到的小蛋白质。 Storz等。 2012年的报道报道,一种以前未知的称为AcrZ的49个氨基酸的蛋白质通过刺激无药泵而使这种微生物在暴露于某些类型的抗生素时得以存活。
由各种生物体(包括蜘蛛,鞘翅目和有毒的软体动物)产生的毒液也富含微小的蛋白质。 毒药的许多成分无法固定或杀死,从而阻塞了钠或其他离子的通道,这些通道是神经冲动的传递所必需的。 科学家们说,小蛋白质“以惊人的准确性和功效打击了这些离子通道。 它们是毒药的主要成分,并且与大多数药理和生物学后果有关。
例如,这种以鱼类为食的巨型澳大利亚昆虫不仅依靠尖锐的下巴和峰状的嘴部来击败猎物。 它向受害人介绍了一种剂量,该剂量包含130多种蛋白质,其中15种少于100个氨基酸。
与大蛋白(例如抗体)不同,从片剂或注射剂中摄取的微蛋白可以穿透细胞并改变其功能。 卡托普利是被称为血管紧张素转化酶抑制剂的一类高压药物中的第一种,它是从在普通热量(一种有毒的蛇)中发现的小蛋白质开发出来的。 这种药物于1981年在美国获准销售,是偶然发现的,甚至在科学家们认识到小蛋白质是一个单独的组之前。 到目前为止,只有很少的微蛋白进入市场或在临床试验中。
癌症研究人员正在尝试使用在非洲和中东常见的黄蝎毒液中发现的微蛋白。 该分子被神秘地吸引到肿瘤中。 通过将其添加到荧光染色物质中,科学家期望突出脑肿瘤的边界,以便外科医生可以安全地切除受癌症影响的区域。它照亮了肿瘤。 因此,您可以看到其边界并检测是否存在转移。 在临床试验中,研究人员现在正在评估一种双分子药物是否可以帮助外科医生去除儿童脑瘤。
尚不清楚小蛋白在医学中的重要作用,但它们已经扭转了许多生物学家的说法。 柏林马克斯·德布吕克分子医学中心的诺伯特·赫伯纳及其同事在人的心脏细胞中发现了数十种新的微蛋白。 该小组揭示了他们出乎意料的来源:长非编码RNA中的短序列,即以前认为不会产生蛋白质的物种。 通过鉴定出可能被核糖体读取的169个长非编码RNA,Huybner和他的团队使用了一种质谱法,以确认其中一半以上在心脏细胞中产生微蛋白。
他们的表演论文于今年在Cell上发表。其他微小蛋白质的DNA序列也可以在非常规的地方找到。例如,有些在开放阅读框中,OPC是较大的蛋白质。科学家以前认为,这些序列有助于控制较大蛋白质的产生,但很少自身产生蛋白质。新检测到的蛋白的某些编码序列甚至位于编码其他更长蛋白的序列中。宾夕法尼亚州匹兹堡大学的进化系统生物学家Anne-Ruxandra Carvunis说,这些基因组上的惊喜可以揭示新基因的产生方式。科学家以前认为,大多数基因会在现有基因繁殖或融合或物种交换DNA时出现。然而,根据Karvunis的说法,微蛋白表明,当突变在基因组的非编码部分中设置新的起始和终止信号时,就可以形成蛋白原。如果产生的OPC产生有用的蛋白质,则新序列将保留在基因组中并经历自然选择的过程,从而进一步进化为编码更复杂蛋白质的更大基因。在2012年的一项研究中,Carvounis及其同事发现,酵母将一千多种短ORS转化为蛋白质。这表明这些序列是原基因。在一项新研究中,Carvounis和她的团队测试了年轻的ORS是否对细胞有益。他们对酵母进行了基因改造,以提高285种新进化的ORS的结果,这些ORS的靶向分子比标准蛋白质小或略多。在将近10%的蛋白质中,其含量的增加可促进至少一种培养基中的细胞生长。“微蛋白是一个快速增长的领域,” A。Saghatelian说。“但是我认为我们的这项研究确实影响了目前对微蛋白对生物化学和细胞生物学影响的理解。”链接:“微蛋白”调节蛋白质功能新型微蛋白正在颠覆细胞生物学和遗传学 线粒体微蛋白对ER应激反应的调节