有针对性的药物递送方法已达到顶峰-对病灶的点状作用使您可以抵抗疾病,几乎不影响健康组织。 然而,仍然存在问题:如何提高这种疗法的有效性,加速药物的作用并最大程度地减少其在体内的积累? NUST MISiS生物纳米材料实验室的科学家已经朝这个方向努力了几年,该团队的最新发现包括使用嗜中性粒细胞-免疫系统细胞将药物递送至恶性肿瘤的效率提高了30%。 研究结果发表在国际科学期刊
ACS Nano上 。

科学家进行了活体研究(在活组织上),研究了使用脂质体将药物靶向递送至恶性肿瘤的机制。 事实证明,嗜中性粒细胞免疫细胞使药物向肿瘤的递送效率提高了30%。
脂质体-人工产生的脂肪囊泡-由于所谓的增强的渗透性和保留(EPR)效应而穿透肿瘤。 在脂质体内,药物被“缝合”,当它进入恶性组织时,它会被释放。
EPR的产生是由于肿瘤对氧气和营养的异常需求而导致的血管过度生长,随着病理生长,直径达200 nm的血管壁上会出现巨大的孔。 而且,肿瘤的生长引起淋巴管的压缩并阻止细胞间液的正常流出。 因此,脂质体穿透肿瘤并且不能由于淋巴引流受损而退出。
据认为,由于EPR作用,脂质体只能渗透到肿瘤中,而不能渗透到健康组织中。 但是真的是这样吗? 船上发生了什么?
在研究过程中,科学家观察到该药物向健康小鼠的组织以及各种类型的恶性肿瘤的传递:乳腺癌,前列腺癌和黑色素瘤。 使用活体显微镜进行观察,这使您可以直接在活生物体中研究过程。
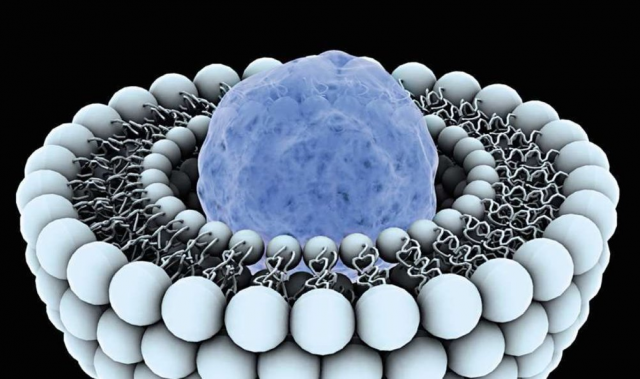 脂质体“依附”于癌细胞
脂质体“依附”于癌细胞研究的第一项结论是,活体组织中发生了两种脂质体从血管向组织的渗透。 微泄漏是脂质体在血管周围的少量孤立堆积。 这样的过程对于治疗肿瘤是无用的,因为它不允许药物到达肿瘤细胞。 此外,在健康组织中发现了微泄漏,这解释了现代临床中使用的脂质体药物的毒性。
第二个最有趣的观察结果是嗜中性白血球(一种白细胞)和人体的免疫细胞泄漏到肿瘤组织中。 当嗜中性粒细胞通过血管壁的“半开门”与血管一起离开血管时,脂质体会设法渗透到肿瘤中。 根据科研小组获得的结果,嗜中性粒细胞将脂质体渗透进肿瘤的效率提高了三分之一。
这一发现给出了一个清晰的模式:中性粒细胞增加了肿瘤的血管通透性,可用于脂质体药物的靶向递送,因此增加了治愈的机会。 而且,这仅在巨漏的情况下发生,巨漏是脂质体的大扩散“云”,其深深渗透到肿瘤中,从而确保了靶向药物的递送。
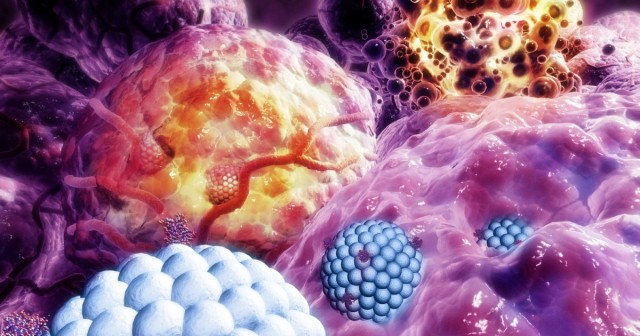
“两种类型的泄漏之间的区别对于理解基于脂质体的药物如何起作用的机制很重要。 我们的结果表明,微渗漏不仅不有助于将药物输送到肿瘤细胞,而且还负责其在健康组织中的有害积累。 Viktor Naumenko强调说,由于大渗漏而达到了治疗效果,嗜中性粒细胞可以帮助增强它。
该小组目前正在继续进行实验室研究,以减少脂质体疗法的不良副作用。 开发用于在患者体内产生嗜中性粒细胞以增强肿瘤治疗的人工刺激机制是获得的数据有希望的应用领域之一。